一种锂二次电池正极材料LiMnO2的制备方法与流程
本发明涉及锂离子电池领域,更具体涉及锂离子二次电池正极材料合成技术领域,尤其是涉及一种锂离子二次电池正极材料LiMnO2的制备方法,还涉及LiMnO2电极材料的掺杂改性提高其电化学储锂容量和充放电循环稳定性。
背景技术:
LiMnO2在锂离子电池正极材料中理论容量高达285mAhg-1而受到越来越多的研究和应用。LiMnO2是目前主流锂离子二次电池正极材料尖晶石LiMn2O4的理论容量的两倍,是一种可在实际应用中比较有潜力的材料。目前,主要有高温煅烧法、水热法、溶胶凝胶法和离子交换法等方法合成LiMnO2。高温煅烧法中,Liu等在800℃的空气中煅烧二氧化锰10h得到前驱体Mn2O3,然后与过量的LiOH混合,在乙醇溶液中球磨12h充分混合,在氮气氛围下煅烧24h,冷却至室温即可得到o-LiMnO2,其中加入过量的LiOH是因为在加热过程中会有Li的挥发损失(见参考文献:LiuC,NanJM,ZuoXX,etal.SynthesisandelectrochemicalcharacteristicsofanorthorhombicLiMnO2cathodematerialmodifiedwithpoly(Vinyl-Pyrrolidone)forlithiumionbatteries,IntJElectrochemSci,2012,7,7152-7164)。此类合成方法合成步骤多,需要前驱体,高温煅烧,条件控制严格(见参考文献:GuYJ,ChenYB,WuHK,etal.StructurechangeoforthorhombicLiMnO2cathodesduringelectrochemicalcycleforrechargeablelithiumbattery,EnergyMaterials,2009,4,40-43;JangY,HuangBY,WangHF,etal.Electrochemicalcycling-inducedspinelformationinhigh-charge-capacityorthorhombicLiMnO2,J.Electrochem.Soc.,1999,146,3217-3223;JiHM,YangG,MiaoXW,etal.EfficientmicrowavehydrothermalsynthesisofnanocrystallineorthorhombicLiMnO2catthodesforlithiumbatteries,Electrochim.Acta,2010,55,3392-3397)。水热合成法,Xiao等通过MnSO4、LiOH、H2O2在200℃条件下水热8h合成出了正交o-LiMnO2纳米颗粒,但是其中含有Li2MnO3杂相。以KMnO4和CTAB在180℃水热12h合成了MnOOH纳米线。将前驱体MnOOH和LiOH在200℃条件下水热8h合成出了单一相的正交o-LiMnO2纳米线(见参考文献:XiaoXL,WangL,WangDS,HeXM,etal.HydrothermalsynthesisoforthorhombicLiMnO2nano-particlesandLiMnO2nanorodsandcomparisonoftheirelectrochemicalperformances,NanoRes,2009,2,923-930)。此类合成方法需要前驱体,易出现杂质(见参考文献:HuangXK,ZhangQS,ChangHT,etal.HydrothermalsynthesisofnanosizedLiMnO2-Li2MnO3compoundsandtheirelectrochemicalperformances,J.Electrochem.Soc.,2009,156,A162-A168;LiuQ,LiYX,HuZL,etal.One-stephydrothermalroutineforpure-phasedorthorhombicLiMnO2forLiionbatteryapplication,Electrochim.Acta,2008,53,7298-7302;XuH,SunJ,GaoL,etal.HydrothermalsynthesisofLiMnO2microcubesforlithiumionbatteryapplication,Ionics,2013,19,63-69)。溶胶凝胶法,Guo等将Mn(CH3COO)2·4H2O和Li(CH3COO)·2H2O在乙醇中按阳离子摩尔比1:1混合,在搅拌过程中加入柠檬酸,80℃下搅拌2h,形成凝胶。在真空干燥箱中110℃烘4h。然后将凝胶在800℃流动的氩气中烘12h制备得到o-LiMnO2(见参考文献:GuoZP,KonstantinovK,WangGX,etal.PreparationoforthorhombicLiMnO2materialviasol-gelprocess,J.PowerSources,2003,119,221-225)。此类合成方法合成步骤多,需要前驱体,高温煅烧,流动的氩气,合成条件相对较为苛刻(见参考文献:ZhaoSX,LiuHX,LiQ,etal.SynthesisandstructuretransformationoforthorhombicLiMnO2cathodematerialsbysol-gelmethod,JMaterSciTechnol,2004,20,46-48)。离子交换法,Wu等通过将Na2CO3和Mn(CH3COO)2混合,在120℃条件下水热3h,然后在空气中250℃煅烧4h,然后在710℃煅烧2h得到NaMnO2。然后在正己烷中,和过量的LiBr交换,将得到的产物过滤洗涤,即可合成层状的单斜m-LiMnO2(见参考文献:WuXM,LiRX,ChenS,etal.ComparativestudyofCo,CrandAl-dopedLiMnO2preparedbyionexchange.BullMaterSci,2008,31,109-113.)。此类合成方法合成步骤多,需要前驱体,高温煅烧,条件苛刻。上述方法都需要先合成前驱体,再通过水热或者固相高温反应来制备目标产物。这些方法都具有较多的反应步骤,而且高温煅烧也会消耗很多能量,不利于清洁生产。而且,目前以水热法合成的LiMnO2都需要较高的LiOH浓度,Li/Mn一般不会低于13(见参考文献:HeY,FengQ,ZhangSQ,etal.StrategyforloweringLisourcedosagewhilekeepinghighreactivityinsolvothermalsynthesisofLiMnO2nanocyrstals,SustainableChemistry&Engineering,2013,Doi:10.1021/sc400056w),也就是说,在合成LiMnO2的过程中需要消耗较多量的Li。现有技术反应步骤多、高能耗和高成本。
技术实现要素:
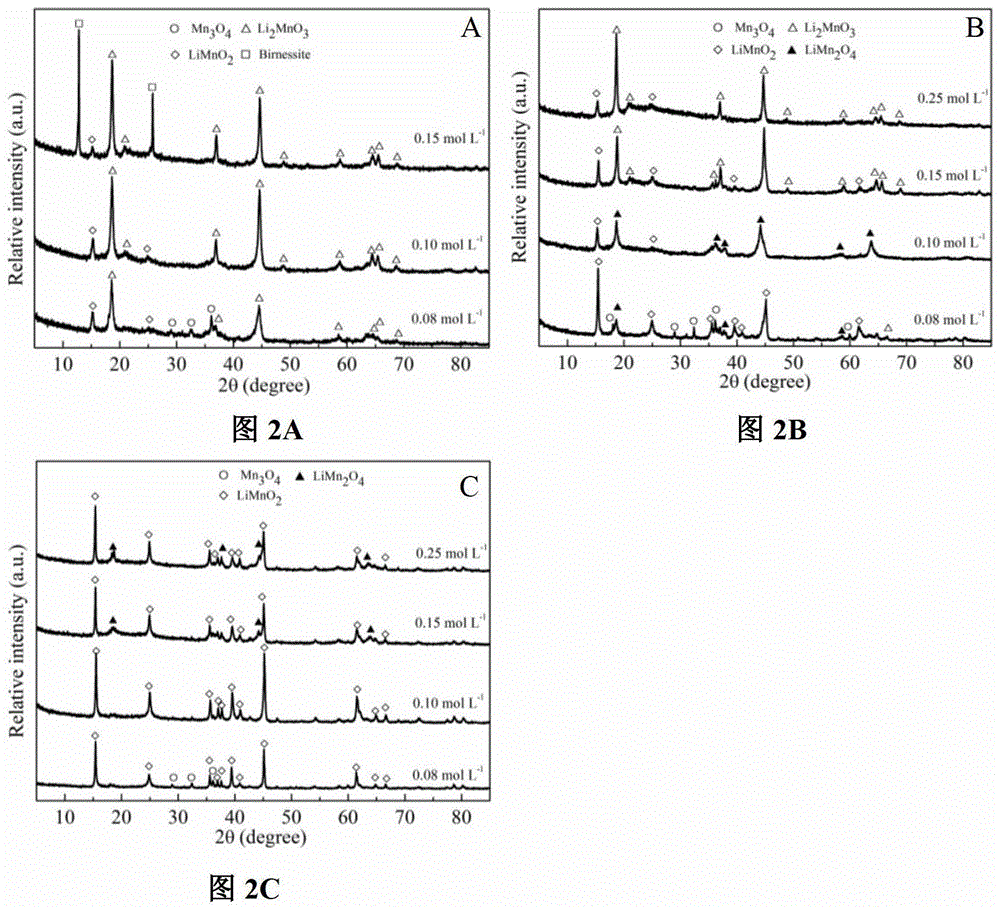
本发明的主要目的在于克服现有LiMnO2在合成过程中,反应步骤多、时间长和需要较高能量以及需要消耗大量Li的缺陷,本发明的目的是在于提供了一种锂二次电池正极材料LiMnO2的制备方法,方法易行,操作简便,能减少反应步骤、降低能耗,有利于清洁的生产,有利于形貌的控制,有效的节约了Li资源并能够改善LiMnO2的储锂性能。为了实用上述的目的,本发明采用以下技术措施:一种锂二次电池正极材料LiMnO2的制备方法,其步骤是:第一步:将二价锰盐和乙二胺四乙酸四钠(EDTA-4Na)加入水中,搅拌溶解,倒入高压釜(河南巩义予华设备有限公司,100mL)中,其中,所述二价锰盐和EDTA-4Na的摩尔比在0.5~1之间;在水中还需要加入氯化铝,所述的氯化铝和二价锰盐的摩尔比在0.05~0.2之间;在水中还需要加入碳纳米管(中国科学院成都有机有限公司、管径10nm~50nm);所述的碳纳米管为多壁碳纳米管(CNT)(中国科学院成都有机有限公司、管径10nm~50nm)、羧基化碳纳米管(CNT-C或CNT-C-C)(中国科学院成都有机有限公司、管径10nm~50nm;另外在已购多壁碳纳米管基础上可自己制备羧基化碳纳米管(见参考文献:GaoC.,DuanVoC.,JinYZetal.Multihydroxypolymer-functionalizedcarbonnanotubes:synthesis,derivatization,andmetalloading,Macromolecules,2005,38,8634-8648))。第二步:将氢氧化锂和氧化剂混合,倒入高压釜中,其中,氢氧化锂与二价锰盐的摩尔比在6~8之间;所述的二价锰盐设为MnCl2、MnSO4、Mn(CH3COO)2或Mn(NO3)2;所述的氧化剂设为NaClO或H2O2。第三步:将上述溶液在高压釜中水热反应12~24h,水热反应温度为120℃~180℃;第四步:将第三步反应所得的反应产物冷却至室温(20-40℃),离心后取沉淀物;第五步:将上述沉淀物用洗涤后烘干,将沉淀物使用水或乙醇至少一次洗涤,直至上清液的电导为≤30μS/cm。进一步地,所述的最后一次洗涤使用酒精洗涤;进一步地第一步至第三步:所述的水为二次水;所述的乙醇为无水乙醇。所述的第五步中的烘干条件为:温度60~110℃,时间12~24h。借由上述技术方案,本发明合成LiMnO2的方法至少具有下列优点:1、本发明的优选的实施方式,能够减少反应步骤。2、本发明的优选的实施方式,更节约能源。3、本发明的优选的实施方式,有利于清洁生产。4、本发明的优选的实施方式,有利于形貌的控制。5、本发明的优选的实施方式,能够有效的节约了Li资源。6、本发明的优选的实施方式,能够影响电池性能。上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例详细给出。在水热氧化Mn2+生成正交LiMnO2(o-LiMnO2)过程中,有Li2MnO3等杂质生成。目前主要合成多为先合成前驱体,然后在惰性氛围中高温煅烧,或着前驱体与高浓度的LiOH通过水热反应制备。本发明减少了反应步骤,水热法也比高温煅烧更能降低能耗和对设备材质的要求,且能有效控制目标产物的形貌。进一步通过水热法成功的合成了掺杂Al和碳纳米管改性的o-LiMnO2,其循环稳定性得以显著提高。其中Al掺杂改性的o-LiMnO2可高达158mAhg-1,100周期后还能维持为155mAhg-1,而碳纳米管负载的o-LiMnO2容量可高达181mAhg-1。上述案例具有很高的工业实际生产应用价值。附图说明图1a为一种不同浓度的LiOH,其反应产物的XRD图;图1b为一种EDTA-4Na对反应产物影响的XRD图;图2a为一种在180℃条件下,不同浓度的NaClO,其反应产物的XRD图;图2b为一种在150℃条件下,不同浓度的NaClO,其反应产物的XRD图;图2c为一种在120℃条件下,不同浓度的NaClO,其反应产物的XRD图;图3为一种实施例1中反应产物的SEM图;图4为一种实施例1锂离子二次电池正极材料循环性能图;图5a为一种掺杂不同量的AlCl3,在180℃条件下,其反应产物的XRD图;图5b为一种掺杂AlCl3为20%,不同LiOH和NaClO的量,在180℃条件下,其反应产物的XRD图;图5c为NaClO和LiOH量调节后的反应产物的XRD图;图6为一种实施例2中反应产物的SEM图;图7为一种实施例2,反应中Al的浓度和掺杂的量的比例;图8为一种实施例2的反应产物的锂离子二次电池正极材料循环性能图;图9为一种实施例3的反应产物的XRD图;图10为一种实施例3中反应产物的SEM图;图11为一种实施例3中反应产物的锂离子二次电池正极材料循环性能图。具体实施方式为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明提出的合成LiMnO2的方法具体实施方式、结构、特征及其功效,详细说明如后。实施例1一种锂二次电池正极材料LiMnO2的制备方法,包括以下步骤:第一步:称取0.989gMnCl2·4H2O,2.262gEDTA-4Na,加入45mL的二次水中,搅拌溶解,倒入高压釜的内衬中;第二步:称取1.253g的LiOH和6.71g的NaClO溶液,将两者迅速混合,倒入内衬中,溶液约50mL,上述混合溶液立即出现黑色;第三步:放入高压釜中在180℃条件下水热24h;第四步:室温(20-40℃,以下相同)下冷却后,取出内衬,将所得的溶液冷却至室温,离心;第五步:溶液上部无色透明,底部是灰色的沉淀,将上述沉淀倒入离心管中,离心后固液分离,再用无水乙醇超声分散,离心,直至上清液电导为30μS/cm左右;将洗涤后所得沉淀物在烘箱中烘干24h,其中,控制烘干温度为60℃。本发明的离子反应方程式为:2Mn2++ClO-+6LiOH→2LiMnO2+3H2O+Cl-+4Li+本发明所公开的LiMnO2的合成方法能够减少反应步骤,且水热法也比高温煅烧更节约能源,有利于清洁生产,而且水热法也非常有利于形貌的控制。且在本发明的水热法中成功的控制到Li/Mn的比例为6,有效的节约了Li资源。本反应中,MnCl2的浓度为0.1mol/L,EDTA-4Na的浓度为0.1mol/L,LiOH的浓度为0.6mol/L,NaClO的浓度为0.1mol/L。其中,在第二步中,1.253g的LiOH相当于0.6mol/L,即与所述二价锰盐的摩尔比为6:1,NaClO(有效氯≥5.2%)是一种溶剂,所以6.71g=0.1mol/L。在上述反应中,加入NaClO的体积为5mL,加入水的量为45mL,进行反应的溶液的体积为50mL。本发明中,所用试剂规格如下:不同的温度、NaClO的量、LiOH的量和EDTA-4Na都对LiMnO2的形成有重要的作用,这正是由于LiMnO2是一个亚稳定相,所以对反应的条件要求很苛刻。在水热氧化Mn2+合成过程中易生成Li2MnO3等杂质。为了得到单一的LiMnO2,就必须控制好氧化反应的速率。所以本发明采用EDTA-4Na来螯合Mn2+离子,并用稀浓度氧化剂NaClO来氧化可以有效的减小反应速率而得到单一相的LiMnO2。从图1a中可知,当LiOH浓度为0.1mol/L和0.2mol/L时,产物为Mn3O4的纯相,当LiOH浓度提升至0.4mol/L时,反应产物是LiMnO2和Mn3O4的混合相,当LiOH浓度继续提升至0.6mol/L和0.8mol/L时,就能够得到LiMnO2的纯相。这说明LiOH的量对反应产生了重要的影响。图1b为在LiOH浓度为0.6mol/L中,EDTA-4Na的添加对反应产物影响XRD图。在没有加入EDTA-4Na时,NaClO氧化Mn2+的反应是一个剧烈的过程,生成了Li2MnO3,还有Mn3O4等杂相。而当加入0.1mol/L的EDTA-4Na时则生成了纯相的LiMnO2。这是因为反应中EDTA-4Na在初始络合了Mn2+,使得Mn2+被NaClO氧化速率减缓,所以在反应过程中,使得其向缓慢的向亚稳定相LiMnO2转变。这说明在反应中,LiOH的量和EDTA-4Na都会影响亚稳定相LiMnO2的生成。图2a、2b和2c分别示出了在不同温度120℃、150℃和180℃条件下,不同浓度的NaClO水热产物XRD图谱,此时在LiOH的浓度为0.6mol/L。在0.08mol/LNaClO时,由于氧化剂的量不足,三个水热温度下都有低价态的Mn3O4生成。在180℃温度下时,随着NaClO的量增加,产物中逐渐含有高价态的LiMn2O4和Li2MnO3,在150℃和120℃中都出现了相似的现象。这说明在相同温度下,随着NaClO的量增加产物中Mn的价态也都升高了。在120℃时,0.15mol/LNaClO时生成了MnO2。当加入相同量的NaClO时,温度对反应起到了重要的作用:温度越低,越易生成高价态的锰如Li2MnO3和MnO2。温度、NaClO的量、LiOH的量和EDTA-4Na都对LiMnO2的形成有重要的作用,这正是由于LiMnO2是一个亚稳定相,所以对反应的条件要求很苛刻。所述MnCl2·4H2O可以为由MnCl2、MnSO4、Mn(CH3COO)2或Mn(NO3)2等能够提供Mn2+的化合物所替代,只要能保证Mn2+和EDTA-4Na的摩尔比在0.5~1之间即能实现本发明。所述LiOH与Mn2+的摩尔比可以为6~8之间的任意值;本实施例中的氧化剂为NaClO,所述的NaClO也可以由H2O2替代(氧化剂与二价锰离子的摩尔比为1.2~1.5)。可选择地,在对所述沉淀物进行清洗的过程中,可以只在最后一步采用无水乙醇进行清洗,前几步采用水进行清洗。可选择地,洗涤后所得沉淀物在烘箱中控制烘干温度为60~110℃之间的任意温度,烘干12~24h之间的任意时间,以确保能将沉淀物烘干即可。在150℃,在取6.71g(0.1mol/L)NaClO时,得到的质量比LiMnO2:LiMn2O4=70.9%:29.1%,产物命名Mm。在180℃,在取6.71g(0.1mol/L)NaClO时,合成的LiMnO2产物命名为M0。图3中a和b分别为混合相Mm和纯相M0的扫描电镜(SEM)照片。Mm的颗粒较小,结晶度较弱;M0的颗粒相对较大,结晶度也较高。图4为实施方案一,不同温度和NaClO量的反应产物,纯相的M0的初始容量最低76mAh·g-1,且在初始周期有一个活化的过程,到20周期后达到最大,但是随后又发生缓慢的衰减,在100周期后还有124mAh·g-1。混合相样品Mm的初始容量最高139mAh·g-1,随后活化,容量缓慢升高,在15周期时达到最高176mAh·g-1,然后容量缓慢衰减,在100周期后为143mAh·g-1。整体性能看,混合相Mm表现出最好的电化学活性和稳定性。实施例2:其与实施例1的区别在于,在第一步中,加入NaClO的量为7.67g(0.12mol/L),在水中还需要加入0.241gAlCl3·6H2O(Al/Mn=20%),在第二步中,LiOH的浓度为0.6mol/L,然后在180℃条件下,水热反应24h得到产物的XRD图谱如图5a和5b所示。可选择地,所述AlCl3和二价锰盐的摩尔比在0.05~0.2之间的任意值。在上述反应中生成了LiMn2O4杂质,且其量是随着加入AlCl3的量逐渐减小的,加入0.241gAlCl3·6H2O时出现了Mn3O4,这说明加入的AlCl3会影响原来反应溶液的环境。在加入0.241gAlCl3·6H2O时,分别加入过量的NaClO或LiOH,发现加入过量的NaClO时,还是有Mn3O4生成,说明氧化剂的不足并不是导致生成的Mn3O4的原因;当加入足量的LiOH时则生成了纯相。对比图5a和5b可知,LiMn2O4的峰强逐渐降低是因为加入的AlCl3,其中的Cl-会使得ClO-的氧化降低,Cl-+ClO-+2H+→Cl2+H2O,Cl2的氧化性是低于ClO-;同时加入的Al3+会消耗OH-的量,当AlCl3·6H2O的掺杂量超过0.241g时,会导致LiOH的量不足而生成了Mn3O4。所以要合成Al掺杂的纯相LiMnO2,NaClO和LiOH的量都要进行调控。不同浓度的AlCl3、NaClO、和LiOH对反应产物的影响,如下表所示:从上表可以看出,通过调控NaClO和LiOH的量,合成了纯相的Al掺杂LiMnO2。图5上述反应产物的XRD图,其中图5a和5b为NaClO和LiOH量调节前的反应产物的XRD图,图5c为NaClO和LiOH量调节后的反应产物的XRD图(其中,图中M0、M5、M10、M15和M20分别代表AlCl3的掺杂量为0M、0.005M、0.01M、0.015M和0.020M的反应产物。如图6所示,图a、b、c和d分别为样品M5、M10、M15和M20的SEM照片,Al掺杂对形貌影响很大,由原来小块状显著的改变为片状,且颗粒粒径有减小的趋势。通过对不同Al掺杂量进行合成LiMnO2,对反应产物进行结构精修拟合,和BET测试,结果如下:随着Al的掺杂量越多,其晶胞体积是逐渐减小的。这是因为Al3+同晶替代了LiMnO2中的Mn3+晶胞体积减小。a轴逐渐减小(锰氧八面体上下两个Mn-O键相关)b轴逐渐增大(锰氧八面体上平面四个Mn-O键相关),而c轴无规律变化,晶胞体积逐渐减小。根据XRD精修计算晶体颗粒也是逐渐减小的,BET测量比表面积也是逐渐减小的,但是整体差异不显著。采用ICP-OES法测量晶体中Al的含量。根据Al含量值,进行线性拟合,其线性拟合结果如图7,可知掺杂量是与浓度呈线性关系的。而掺杂产物Al/Mn为溶液中Al3+/Mn2+量的6.02%。图8中,在掺杂产物系列中,电化学性能最好的是M10。在初始周期时为82mAh·g-1,然后有一个活化的过程,到20周期时趋于稳定158mAh·g-1,在充放电到100周期后也没有发生明显的衰减,为155mAh·g-1。而M5、M15、M20电池性能在初始周期与M10没有较大的差异,但是在循环80周期后,容量都有一个缓慢衰减的过程。Al掺杂的LiMnO2的晶胞参数发生了明显的变化,继而影响了电池性能。本发明所提供的水热法合成Al掺杂LiMnO2,可以显著的改善LiMnO2在充放电过程中结构的稳定性。实施例3:其与实施例1的区别在于:在第一步前,还包括羧基化碳纳米管CNT-C-C的制备步骤:称取购买的羧基化碳纳米管(CNT-C,羧基化比例3%)0.5g至于聚四氟乙烯的内衬中,加入35mL水和15mL的浓硝酸(30%)。密封,置于高压釜中,在180℃下水热48h。冷却,离心洗涤至固液不能分离。将黑色的混合液置于烧杯中,在电炉上烘干,制备得到出羧基化比例增加的碳纳米管,命名为CNT-C-C。在第一步中,称取0.98gMnCl2·4H2O,2.26gEDTA-4Na,0.1gCNT(CNT-C、CNT-C-C)加入一定量的二次水中,搅拌溶解,倒入聚四氟乙烯内衬中。经过羧基化处理的CNT会更好与Mn2+络合,可能会使得LiMnO2更稳定,从而表现出更好的电化学性能。不同的NaClO的量对水热合成CNT掺杂LiMnO2有很大影响,图9中示出了添加不同的NaClO量的反应产物的XRD图。从上表中可以看出,在反应过程中,碳纳米管会消耗部分NaClO。而且根据图9曲线b和c的反应条件认为,碳纳米管上-COOH会消耗更多的NaClO。根据图9曲线e和f的反应条件可推断,碳纳米管上-COOH也会消耗部分的OH-。当不加入EDTA-4Na时,生成的还是混合相,碳纳米管上的-COOH并没有取代掉EDTA-4Na中-COO-的作用,这可能是碳纳米管上-COOH量不足的原因。要想合成纯相CNT负载的LiMnO2,需要调节LiOH和NaClO的量。将上述三类碳纳米管负载的纯相LiMnO2样品分别命名为MCNT、MCNT-C、MCNT-C-C。由图10可知,M0、MCNT、MCNT-C和MCNT-C-C四种样品都是无规则的小颗粒块状,这说明碳纳米管不会对LiMnO2的形貌产生影响。但是MCNT(b)和MCNT-C(c)中出现了明显的碳纳米管团聚,而MCNT-C-C(d)却没有明显的碳纳米管团聚。这是因为经过硝酸处理得到的CNT-C-C发生了明显的断裂,使得碳纳米管的长度变短,在反应过程中碳纳米管没有发生明显的团聚。这将会直接影响LiMnO2的储锂性能(见图11)。以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1