一种均相检测SCCA1的免疫荧光法的利记博彩app
本发明公开了一种均相检测scca1的免疫荧光法,属于纳米免疫分析技术领域。。
背景技术:
荧光共振能量转移(fret)是指在两个不同的荧光基团中,若一个荧光基团(供体donor)的发射光谱与另一个基团(受体acceptor)的吸收光谱有一定的重叠,两个荧光基团间的距离合适时(一般小于10nm),即可观察到荧光能量由供体向受体转移的现象。
量子点(qds)是直径约为2~20nm,能够接受激发光产生荧光的半导体纳米颗粒。传统的fret研究的主要集中于有机荧光分子数,作为一种新型fret试剂,qds具有许多有机荧光分子不具备的优点,如有可调谐的激发波、抗漂白性、多个染料分子同时连接、狭窄的发射波长和远离发射峰激发等优良的光学性质。因此,qds可以成为比有机荧光分子更好的fret的供体或受体。
荧光能量转移体系发光强度大,灵敏度高,方法简单。
技术实现要素:
本发明的目的在于提供一种均相检测scca1的免疫荧光法,利用荧光配对染料之间荧光共振能量转移快速均相检测广谱肿瘤标记物scca1。该方法可以在均相中实现对scca1的检测,且对scca1的检测具有灵敏度高和选择性好的特点。
本发明采用以下技术方案:
一种基于荧光共振能量转移的scca1检测法,包括以下步骤:
一、探针1和探针2的制备
a、cds的制备
在合成过程保持搅拌状态的体系中,将0.1mol/l的cdcl2溶液2~8ml注入到100ml去离子水中,加入0.2~2.0mmol的巯基乙酸作为修饰剂,2~5min后用1mol/l的氢氧化钠溶液调节体系ph值至9~11,溶液体系呈无色透明,随后加入0.5~4ml浓度为0.1mol/l的na2s水溶液,即得cds量子点。
b、取cds量子点分别用0.05m的mes缓冲溶液稀释后,加入edc和nhs(qds:edc的摩尔比为1:50~1:200;edc:nhs的摩尔比为1:1~1:5),涡旋振荡均匀,室温活化15~60min;将活化的量子点用30kd超滤管在8000r/min,4℃条件下离心10min,超滤纯化后,加入pbs7.4稀释,加入相对应单克隆scca1抗体溶液(qds和抗体的摩尔比为1:1~10:1),4℃反应过夜,即得探针1。
c、取荧光物质(罗丹明b或红色荧光微球)分别用0.05m的mes缓冲溶液稀释后,加入edc和nhs(荧光物质:edc的质量比为1:50~1:200;edc:nhs的摩尔比为1:1~1:5),涡旋振荡均匀,室温活化15~60min;将活化的荧光物质用30kd超滤管在8000r/min,4℃条件下离心10min,超滤纯化后,加入pbs7.4稀释,加入相对应单克隆scca1抗体溶液(荧光物质和抗体的质量比为100:1~10:1),4℃反应过夜,即得探针2。
其中,罗丹明激发波长525-550nm,发射波长580nm;红色荧光微球激发波长520~535nm,发射波长600nm。罗丹明b购于sigma;红色荧光微球购于苏州为度生物。
二、探针1-scca1-探针2荧光共振能量转移体系制备
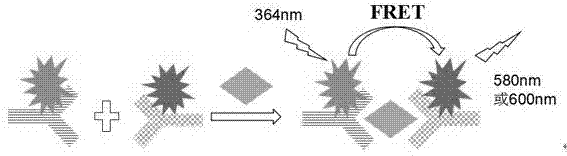
探针1-scca1-探针2荧光共振能量转移体系的原理如图1所述,通过探针1、探针2与scca1形成三明治结构,使探针1、2的标记荧光物质发生能量荧光转移,而这种荧光变化量的大小与scca1的含量呈一定的线性关系。
探针1-scca1-探针2荧光共振能量转移体系为:
样本(标准品或待测样本)2μl
0.05mg/ml探针120μl
0.05mg/ml探针210μl
pbs7.4缓冲液50μl
ddh2o补足至100μl。
三、scca1工作曲线
先将浓度为0.05~40ng/ml的不同浓度的标准品样本分别与探针1、pbs缓冲液接触混匀后,分别加入探针2,超纯水定容到100μl。然后常温旋转30~60min后,将该体系置于多功能酶标仪上检测荧光强度。记录混合液在探针2最大发射波长(580nm或600nm处)的荧光强度,存在scca1时f,不存在scca1时f0,以(f-f0)对scca1浓度绘制标准曲线。
通过探针1-scca1-探针2荧光共振能量转移体系检测待测样本的荧光信号,将待测样品的荧光信号值代入scca1标准曲线,得出待测样品中scca1的含量。
该方法操作简单,不需要对杂交体系中未连接的抗体进行分离,实现均相检测;由于罗丹明b、红色荧光微球在364nm光激发下不会直接产生荧光信号,因此背景干扰小,信号强。该方法还具有特异、快速、高选择性和高通量的特点,可用于临床医学中肿瘤的广谱筛查。
附图说明
图1为荧光共振能量转移(fret)检测scca1的原理示意图。
图2为不同体系的scca1(0,0.05,0.1,0.5,1,2,5,10,20,40)对fret体系荧光强度的影响(量子点-罗丹明b配对荧光染料)。
图3为cea的标准曲线图,以(f-f0)与cea的浓度建立标准曲线。
具体实施方式
下面给出实施例以对本发明作更详细的说明,有必要指出的是以下实施例不能理解为对本发明保护范围的限制,该领域的技术熟练人员根据上述本发明内容对本发明作出的一些非本质的改进和调整仍属本发明的保护范围。
实施例
实施例1探针1、探针2的制备
以cds和罗丹明b为配对染料,分别标记scca1配对抗体,制备探针1和探针2,用于scca1检测。
一、探针1的制备
在合成过程保持搅拌状态的体系中,将0.1mol/l的cdcl2溶液2~8ml注入到100ml去离子水中,加入0.2~2.0mmol的巯基乙酸作为修饰剂,2~5min后用1mol/l的氢氧化钠溶液调节体系ph值至9~11,溶液体系呈无色透明,随后加入0.5~4ml浓度为0.1mol/l的na2s水溶液,即得cds量子点(其激发波长364nm,发射波长530nm)。
取cds量子点分别用0.05m的mes缓冲溶液稀释后,加入edc和nhs(qds:edc的摩尔比为1:50;edc:nhs的摩尔比为1:2.5),涡旋振荡均匀,室温活化20min;将活化的量子点用30kd超滤管在8000r/min,4℃条件下离心10min,超滤纯化后,加入pbs7.4稀释,加入相对应单克隆scca1抗体溶液(qds和抗体的摩尔比为4:1),4℃反应过夜,即得探针1。
二、探针2的制备
取罗丹明b分别用0.05m的mes缓冲溶液稀释后,加入edc和nhs(罗丹明b:edc的质量比为1:50;edc:nhs的摩尔比为1:2.5),涡旋振荡均匀,室温活化15min;将活化的罗丹明b用30kd超滤管在8000r/min,4℃条件下离心10min,超滤纯化后,加入pbs7.4稀释,加入相对应单克隆scca1抗体溶液(罗丹明b和抗体的质量比为10:1),4℃反应过夜,即得探针2。
其中,罗丹明激发波长525~550nm,发射波长580nm。
实施例2均相检测scca1的免疫荧光法
标准曲线绘制:先将浓度为0.05~40ng/ml的不同浓度的标准品样本各2μl分别与20μl浓度为0.05mg/ml探针1、50μlpbs7.4缓冲液接触混匀后,分别加入10μl浓度为0.05mg/ml探针2,超纯水定容到100μl,然后常温旋转30~60min后,最后将该体系置于多功能酶标仪上检测荧光强度。记录混合液在探针2最大发射波长(580nm或600nm处)的荧光强度,存在scca1时f,不存在scca1时f0,以(f-f0)对scca1浓度绘制标准曲线(见图3)。
样本检测:通过探针1-scca1-探针2荧光共振能量转移体系检测待测样本的荧光信号,将待测样品的荧光信号值代入scca1标准曲线,得出待测样品中scca1的含量。
- 还没有人留言评论。精彩留言会获得点赞!