一种二维液相比色免仪器定量分析方法与流程
本发明属于生化分析与生物传感技术领域,具体涉及一种二维液相比色免仪器定量分析方法。
背景技术:
液相比色分析法具有操作简单、成本经济、可实现目视定性或半定量检测等突出优点,长期以来备受分析工作者的青睐。目前绝大多数文献报道的液相比色分析法通常使用有机染料、酶底物、贵金属纳米颗粒等作为比色探针,将目标物的浓度转换成均相反应溶液的颜色强度进行分析。由于颜色强度仅是最终反应溶液的一维信息,现有的绝大多数液相比色分析方法可统称为一维液相比色分析法。尽管一维液相比色分析法具有前述诸多优点,它们的美中不足之处主要在于必须借助紫外-可见分光光度计等光学仪器才能进行分析物的定量检测。
技术实现要素:
本发明的目的是针对现有技术中绝大多数液相比色分析方法的不足,提供一种二维液相比色免仪器定量分析方法。
本发明的思路:利用糖化酶可催化水解水溶性较低的淀粉分子生成葡萄糖等水溶性良好的产物,结合具有优异水溶性或水中分散性的彩色检测试剂在不同水溶性的反应溶液中可扩散不同距离的简单机制,提出一种二维液相比色免仪器定量分析新方法。“二维”是指在利用该彩色检测试剂在反应溶液里的颜色强度作为“第一维”定性信息的同时,引入其在反应溶液中扩散的彩色长度作为“第二维”定量信息。换言之,与现有的绝大多数液相比色分析方法中最后得到颜色均一的反应溶液不同的是,新方法最后得到的是双色反应溶液——溶液的上部和下部分别呈现彩色和无色。反应溶液中彩色部分的长度随着糖化酶浓度的增高而增大。因此,仅凭肉眼观察,通过使用价格极低的直尺代替紫外-可见分光光度计等光学仪器简单量测反应溶液中彩色溶液的扩散长度,或直接读取所使用的透明容器自身与该彩色扩散长度相关的刻度,即可实现糖化酶分析物或与糖化酶浓度相关的目标分析物(即以糖化酶为酶标记探针)的定量检测,从而显著降低分析成本。
具体步骤为:
步骤一,在透明容器中将淀粉溶液与含有糖化酶的溶液充分混合,进行糖化酶催化水解淀粉的反应,制得具有良好水溶性的二级产物反应溶液。
步骤二,在步骤一制得的反应溶液的液面位置加入彩色检测试剂溶液,量测反应溶液中彩色检测试剂溶液的扩散长度,该扩散长度与溶液中糖化酶的浓度呈正相关,即完成目标分析物的二维液相比色免仪器定量分析。
所述透明容器为玻璃材质和塑料材质中的一种,且透明容器本身没有刻度或本身自带刻度,当透明容器本身没有刻度时,使用直尺在透明容器外壁量测反应溶液中彩色检测试剂溶液的扩散长度,当透明容器本身自带刻度时,直接读取透明容器自身刻度量测反应溶液中彩色检测试剂溶液的扩散长度。
所述淀粉为低水溶性的直链淀粉和支链淀粉中的一种。
所述目标分析物为糖化酶自身或者与糖化酶浓度相关的物质即以糖化酶为酶标记探针。
所述彩色检测试剂为具有良好水溶性的彩色墨水、染料、色素及具有良好水中分散性的彩色纳米材料和微米材料中的一种。
与现有的绝大多数液相比色分析方法相比,本发明的突出优点在于:1)检测过程极为简单,未经专业技能培训的操作人员也能开展实验;2)仅凭肉眼观察或简单使用价格低廉的直尺代替紫外-可见分光光度计等光学仪器进行定量信号读取,显著降低了分析成本;3)可直接推广应用于临床诊断、医学研究、食品安全、环境监测等领域中各种样本中糖化酶分析物或使用糖化酶为酶标记探针的目标物的简单低成本二维液相比色免仪器定量检测,具有广阔的应用前景。
附图说明
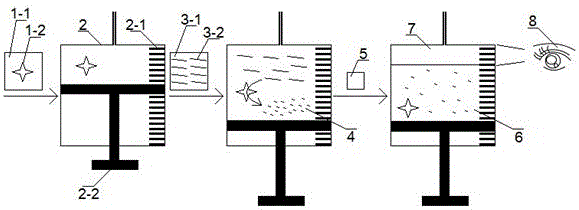
图1为本发明实施例1和实施例2中二维液相比色免仪器定量分析方法的原理示意图。图中标记:1-1—无色缓冲溶液;1-2—糖化酶;2—外壁有刻度的透明塑料检测容器(微量注射器);2-1—检测容器外壁刻度;2-2—检测容器内部活塞;3-1—超纯水;3-2—直链淀粉;4—糖化酶催化水解淀粉的产物(葡萄糖);5—彩色检测试剂(红墨水);6—主要含甲酰胺的下层溶液;7—主要含彩色检测试剂(红墨水)的上层溶液;8—肉眼。
图2为本发明实施例1中使用二维液相比色免仪器定量分析方法分别检测0.64 U/mL糖化酶样本溶液和空白样(不含分析物的缓冲溶液)所得的与红墨水流动长度相关的刻度值的比较。
图3为本发明实施例2中使用二维液相比色免仪器定量分析方法检测一系列不同活性浓度的糖化酶样本溶液所得的与红墨水流动长度相关的刻度值与糖化酶活性浓度的Log值(LogC糖化酶)之间的工作曲线。
具体实施方式
以下实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
实施例1:
使用二维液相比色免仪器定量分析方法分别检测0.64 U/mL糖化酶样本溶液和空白样(不含分析物的缓冲溶液)。
如图1所示,本实施例的具体步骤为:步骤一,在50 μL透明塑料微量注射器中依次吸入15 μL糖化酶溶液(由20 mM的乙酸-乙酸钠缓冲溶液配制,pH 6.0)和15 μL直链淀粉溶液(由电阻率为18.2 MΩ·cm的超纯水加热配制,冷却到室温后使用),充分混合后置于37℃下反应40 min,制得反应溶液;步骤二,在上述反应溶液的液面位置继续抽吸加入3 μL红墨水溶液(将墨水原液用电阻率为18.2 MΩ·cm的超纯水稀释20倍后制得),红墨水溶液在反应溶液中流动5 min后,肉眼直接读取注射器外壁表面与溶液中红色流动长度相关的刻度值,即完成目标分析物的二维液相比色免仪器定量分析。
根据相同的步骤,分析空白样,即20 mM的乙酸-乙酸钠缓冲溶液(pH 6.0),并使用肉眼直接读取注射器外壁表面与溶液中红色流动长度相关的刻度值。从图2可以看出,与检测空白样所得的刻度值相比,检测0.64 U/mL糖化酶样本溶液所得的刻度值有了显著增长。这是因为糖化酶分析物可以高效率地催化水解低水溶性淀粉分子生成具有良好水溶性的葡萄糖产物,整个反应溶液的疏水性因此降低,导致水溶性红墨水溶液在设定的时间内可以流动较长的距离。图2中的对比实验结果表明,基于二维液相比色法的糖化酶活性免仪器定量检测切实可行。
实施例2:
使用二维液相比色免仪器定量分析方法检测活性浓度范围为0.01~0.64 U/mL的糖化酶样本溶液。
如图1所示,本实施例中分析每个糖化酶样本溶液的具体步骤为:在50 μL透明塑料微量注射器中依次吸入15 μL糖化酶溶液(由20 mM的乙酸-乙酸钠缓冲溶液配制,pH 6.0)和15 μL直链淀粉溶液(由电阻率为18.2 MΩ·cm的超纯水加热配制,冷却到室温后使用),充分混合后置于37℃下反应40 min,制得反应溶液;步骤二,在上述反应溶液的液面位置继续抽吸加入3 μL红墨水溶液(将墨水原液用电阻率为18.2 MΩ·cm的超纯水稀释20倍后制得),红墨水溶液在反应溶液中流动5 min后,肉眼直接读取注射器外壁表面与溶液中红色流动长度相关的刻度值。最后并将从所有样本得到的刻度值对糖化酶活性浓度的Log值(LogC糖化酶)作图(图3),即完成糖化酶活性的二维液相比色法定量检测。
由图3可知,随着糖化酶活性浓度的增加,相应的刻度值逐渐增大。这是因为,当样本中糖化酶活性浓度较大时,被水解的低水溶性的直链淀粉也会越多。此时,水溶性良好的葡萄糖产物的数量也越多,使得红墨水检测试剂溶液在其中的流动长度(刻度值)也更大。此外,图3显示,利用本发明量测所得的刻度值与糖化酶活性浓度的Log值在0.01~0.64 U/mL范围内呈现良好的线性关系。
- 还没有人留言评论。精彩留言会获得点赞!