一种同时测定动物源食品中杀线威和杀线威肟的方法与流程
本发明涉及食品残留物的
技术领域:
,尤其涉及一种同时测定动物源食品中杀线威和杀线威肟的方法。
背景技术:
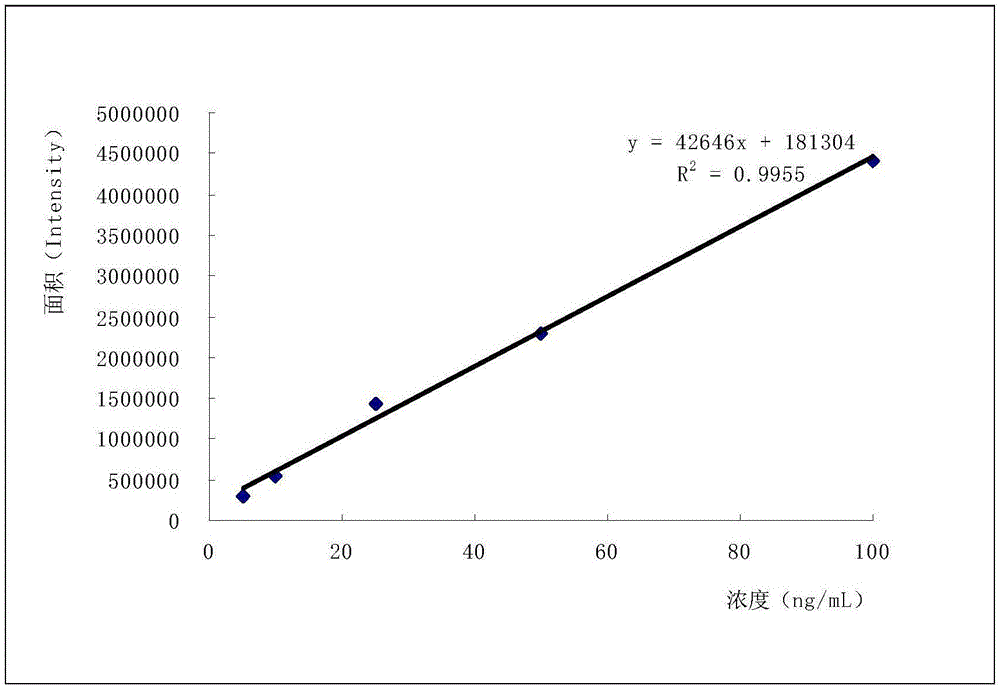
:杀线威(CAS﹟:23135-22-0),又名草肟威,英文名Oxamyl,化学名N,N-二甲基-α-甲基氨基甲酰基氧代亚氨-α-甲硫基乙酰胺,属于氨基甲酸酯类农药,主要用作广谱性杀虫剂,兼有杀螨和杀线虫等活性。杀线威已登记作物有柑橘、甜瓜、番茄、甜椒、黄瓜、胡萝卜、马铃薯、花生和棉花等。杀线威为剧毒农药,对人体有神经毒性。杀线威及其代谢物可残留于农产品、食物或环境中,对人体具有潜在的健康风险。GB2763-2014规定杀线威在花生仁等食品中最大残留限量(MRL)为0.05-2mg/kg。中国(GB2763-2014)及联合国食品法典委员会(CAC)均定义杀线威残留物为杀线威及其代谢物杀线威肟之和,以杀线威表示。我国已制定了果蔬、乳品等几种食品中杀线威残留量测定的标准,现行标准多采用LC-MS/MS法以多反应监测(MRM)方式对杀线威进行测定。SN/T0697-2014《出口肉及肉制品中杀线威残留量的测定》采用乙腈进行提取,N-丙基乙二胺(PSA)小柱净化。SN/T0134-2010《进出口食品中杀线威等12种氨基甲酸酯类农药残留量的检测方法液相色谱-质谱/质谱法》采用乙腈进行提取,活性炭和弗罗里硅土串联小柱净化。SN/T3156-2012《乳及乳制品中多种氨基甲酸酯类农药残留量的检测方法液相色谱-串联质谱法》采用乙腈进行提取,C18小柱净化。GB/T20772-2008《动物肌肉中461种农药及相关化学品残留量的测定液相色谱-串联质谱法》采用乙酸乙酯-环己烷进行提取,凝胶渗透色谱净化。然而所有现行标准中仅制定了杀线威的测定方法,并未涉及杀线威肟。专利CN105548431A《同时检测蔬菜/水果中杀线威和杀线威肟残留量的方法》采用乙腈进行提取及基质分散固相萃取法进行净化,然后采用液相色谱质谱法(LC-MS/MS)以多反应监测(MRM)方式测定杀线威,以选择性离子监测(SIM)方式测定杀线威肟。该专利方法适用于果蔬类,但基质分散固相萃取法不适用于基质复杂的动物源食品,此外SIM方式获得的定性结果假阳性率高于MRM方式。鉴于杀线威在农业生产中的广泛应用及其残留毒性风险,以及我国标准(GB2763-2014)和联合国食品法典委员会(CAC)均定义杀线威残留物为杀线威及其代谢物杀线威肟之和,因而,建立适用于动物源食品、灵敏度高(定量限低于MRL)的杀线威与杀线威肟残留量的测定方法十分必要。技术实现要素:有鉴于此,本发明提供了一种同时测定动物源食品中杀线威和杀线威肟的方法,有效测定动物源食品中杀线威和杀线威肟残留量。本发明采用的技术手段如下:一种同时测定动物源食品中杀线威和杀线威肟的方法,取待测样品制备供试品溶液,并配制基质匹配标准溶液,利用液相色谱-质谱/质谱仪测定杀线威和杀线威肟;其中色谱条件为:色谱柱:C18柱,长50mm,内径2.1mm,填充料粒径1.7um,柱温:25~35℃,进样量:2~4μL,流速:0.25~0.35mL/min,流动相梯度洗脱方式见表3:表3流动相梯度洗脱方式表3中的甲酸水溶液体积浓度为0.1%。进一步的,所述质谱条件为:电离方式:电喷雾电离,正离子扫描(ESI+),检测方式:多反应监测(MRM),电喷雾电压(IS):4950~5050V,离子源温度(TEM):500~600℃,碰撞气(CAD):medium,气帘气压力(CUR):25psi,雾化器(GS1):55psi,辅助加热器(GS2):55psi。进一步的,所述多反应监测(MRM)的条件见表4:表4多反应监测的条件表4中带*的离子为定量离子。进一步的,配制所述供试品溶液的步骤为:(1)制样:取待检测的样品,切成小块,捣碎混匀,制成匀浆;(2)提取:称取步骤(1)的样品至离心管中,加入乙腈、无水硫酸钠进行匀浆,再用乙腈洗涤刀头,获得匀浆后混合物和洗涤液;将匀浆后混合物进行第一次离心,收集第一次上清液至蒸馏瓶,并于剩下的残留物中加入洗涤刀头的洗涤液,涡旋提取,并进行第二次离心,收集第二次上清液,合并两次上清液至蒸馏瓶,旋转蒸发至近干;加甲醇-二氯甲烷溶液至蒸馏瓶中,涡旋溶解残留物,待净化;(3)净化:用甲醇-二氯甲烷溶液淋洗活化乙二胺-N-丙基小柱,弃去淋洗液;将步骤(2)中待净化的样品溶液加到小柱中过柱,用甲醇-二氯甲烷溶液润洗残留有样品溶液的蒸馏瓶并将润洗液过柱,用干净的用蒸馏瓶收集所有流出的样品溶液和洗脱液,旋转蒸发至蒸干;加入甲醇-水溶液,涡旋溶解残渣;将混合溶液转移至离心管中,离心后过滤至样品瓶中,供测定。进一步的,配制所述基质匹配标准溶液的步骤为:称取杀线威、杀线威肟标准品,分别用甲醇溶解定容至不同的容量瓶,得到单标储备溶液;取各单标储备溶液至同一容量瓶中,用甲醇进行稀释,得到中间标准混合溶液;用甲醇对中间标准混合溶液进行稀释,以甲醇-水溶液为溶剂配制成系列浓度的标准工作液;称取不含有杀线威与杀线威肟的样品,进行制样、提取与净化,旋转蒸发至蒸干,分别加入各浓度的标准工作液,涡旋充分溶解残渣;将各混合溶液转移至不同的离心管中,离心后过滤至样品瓶中,得到系列浓度的基质匹配标准溶液。进一步的,所述柱温为30℃,所述进样量为3μL,所述流速为0.30mL/min。进一步的,所述电喷雾电压为5000V,所述离子源温度为550℃。进一步的,所述提取步骤(2)中具体操作为:称取制得的样品5g至50mL离心管中,加入20mL乙腈和5g无水硫酸钠,以15000rpm进行匀浆2min,再用10mL乙腈洗涤刀头1min,获得匀浆后混合物和洗涤液;将匀浆后混合物于4000rpm进行第一次离心10min,收集第一次上清液至蒸馏瓶,并于剩下的残留物中加入洗涤刀头的洗涤液,涡旋提取2min,并以4000rpm进行第二次离心10min,收集第二次上清液,合并两次上清液至100mL蒸馏瓶,于40℃旋转蒸发至近干;加3mL体积比为5:95的甲醇-二氯甲烷至蒸馏瓶中,涡旋溶解残留物,待净化。进一步的,所述净化步骤(3)中具体操作为:用5mL体积比为5:95的甲醇-二氯甲烷淋洗活化乙二胺-N-丙基小柱,弃去淋洗液;将步骤(2)中待净化的样品溶液加到小柱中过柱,分别用4mL体积比为5:95的甲醇-二氯甲烷润洗残留有样品溶液的蒸馏瓶两次,并将两次润洗液过柱,控制流速不超过1mL/min;用干净的蒸馏瓶收集所有流出的样品溶液和洗脱液,于35℃旋转蒸发至蒸干;加入1mL体积比为20:80的甲醇-水溶液,涡旋,溶解残渣;将混合溶液转移至1mL离心管中,于4℃以13000rpm离心10min,取上清液过0.22μm滤膜至样品瓶中,供测定。进一步的,配制所述基质匹配标准溶液的具体步骤为:称取杀线威、杀线威肟标准品各0.01g,分别用甲醇溶解定容至不同的10mL容量瓶,得到杀线威、杀线威肟的浓度均为1.0mg/mL的单标储备溶液;取各单标储备溶液至同一容量瓶中,用甲醇进行稀释,配制为杀线威、杀线威肟的浓度均为10μg/mL的中间标准混合溶液;用甲醇对中间标准混合溶液进行稀释,再以体积比为20:80的甲醇-水溶液为溶剂配制成5ng/mL、10ng/mL、25ng/mL、50ng/mL和100ng/mL的标准工作液;称取不含有杀线威与杀线威肟的样品5份,进行制样、提取与净化,于35℃旋转蒸发至蒸干,分别加入不同浓度的标准工作液各1mL,涡旋充分溶解残渣;将各混合溶液转移至不同的离心管中,于4℃以13000rpm离心10min,取上清液过0.22μm滤膜至样品瓶中,得到5ng/mL、10ng/mL、25ng/mL、50ng/mL和100ng/mL的基质匹配标准溶液。本发明的有益效果:本发明提供了一种同时测定动物源食品中杀线威和杀线威肟的方法,而且本发明首次报道用液相色谱-串联质谱法MRM方式测定杀线威肟。针对基质复杂的动物源样品,采用乙腈对动物源样品进行提取及固相萃取小柱净化提取物,并利用低温高速离心去除小颗粒杂质,对基质复杂的动物源食品进行高效的净化,从而减少杂质的干扰,制得供试品溶液,并配制基质匹配标准溶液,利用液相色谱-串联质谱法MRM方式同时测定样品中的杀线威和杀线威肟。FAOCAC规定杀线威与杀线威肟(以杀线威计)在猪肉、鸡肉、动物内脏、鸡蛋等动物源食品中最大残留限量(MRL)为0.02mg/kg,本发明方法杀线威与杀线威肟的定量限均为0.001mg/kg,远低于CAC规定的MRL,具有灵敏度高等优点,且其回收率和重复性也符合要求,即本发明的测定方法是适用于动物源食品中杀线威和杀线威肟残留量同时测定的有效方法,且简单易行,在实际生产中具有广泛的应用性。附图说明图1:猪肉杀线威定量标准曲线;图2:猪肉杀线威肟定量标准曲线;图3:鸡肉杀线威定量标准曲线;图4:鸡肉杀线威肟定量标准曲线;图5猪肝杀线威定量标准曲线;图6:猪肝杀威肟定量标准曲线;图7中a-b为10ng/mL标准溶液中杀线威MRM色谱图;图8中a-b为10ng/mL标准溶液中杀线威肟MRM色谱图;图9中a-b为猪肉基质空白杀线威MRM色谱图;图10中a-b为猪肉基质空白杀线威肟MRM色谱图;图11中a-b为猪肉添加0.005mg/kg杀线威MRM色谱图;图12中a-b为猪肉添加0.005mg/kg杀线威肟MRM色谱图;图13中a-b为鸡肉基质空白杀线威MRM色谱图;图14中a-b为鸡肉基质空白杀线威肟MRM色谱图;图15中a-b为鸡肉添加0.005mg/kg杀线威MRM色谱图;图16中a-b为鸡肉添加0.005mg/kg杀线威肟MRM色谱图;图17中a-b为猪肝基质空白杀线威MRM色谱图;图18中a-b为猪肝基质空白杀线威肟MRM色谱图;图19中a-b为猪肝添加0.005mg/kg杀线威MRM色谱图;图20中a-b为猪肝添加0.005mg/kg杀线威肟MRM色谱图。具体实施方式以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。实施例1猪肉中杀线威和杀线威肟残留量的测定(1)样品前处理①制样:取待检测的猪肉样品约1kg,切成小块,用捣碎机将样品充分捣碎混匀,制成匀浆,装入洁净容器,密封,标明标记。将试样保存在-18℃。②提取:样品充分解冻,称取猪肉样品5g(精确至0.01g)至50mL离心管中,加入20mL乙腈,5g无水硫酸钠,15000rpm高速匀浆2min,再用10mL乙腈洗涤刀头1min,获得匀浆后混合物和洗涤液;将匀浆后混合物于4000rpm离心10min,收集上清液至100mL蒸馏瓶,残留物中加入洗涤刀头的洗涤液,涡旋混合提取2min,4000rpm离心10min,收集上清液,合并两次上清液至100mL蒸馏瓶,于40℃旋转蒸发至近干;加3mL甲醇-二氯甲烷溶液(体积比为5/95)至蒸馏瓶中,涡旋溶解残留物,待净化。③净化:用5mL甲醇-二氯甲烷溶液(体积比为5/95)淋洗活化PSA(乙二胺-N-丙基)SPE小柱,弃去淋洗液;将待净化的样品溶液加到小柱中过柱,用4mL甲醇-二氯甲烷溶液(体积比为5/95)润洗蒸馏瓶并将润洗液过柱,再用4mL甲醇-二氯甲烷溶液(体积比为5/95)重复润洗一次并将第二次的润洗液过柱,控制流速不超过1mL/min;用50mL蒸馏瓶收集所有流出的样品溶液和洗脱液,于35℃旋转蒸发至蒸干;加入1mL甲醇-水(体积比为20/80)溶液,涡旋,充分溶解残渣;将混合溶液转移至1mL离心管中,于4℃以13000rpm离心10min,取上清液过0.22μm聚四氟乙烯(PTFE)滤膜至样品瓶中,供液相色谱-质谱/质谱仪测定。(2)标准溶液及空白溶液的配制①标准储备液配制:称取杀线威、杀线威肟标准品各0.01g(精确至0.0001g),分别用甲醇溶解定容至不同的10mL容量瓶中,得到浓度为1.0mg/mL的单标储备溶液,保存于-18℃。②中间标准混合溶液配制:取单标储备溶液适量,用甲醇配制成10μg/mL的中间标准混合溶液。③标准工作溶液配置:用甲醇将10μg/mL的中间标准混合溶液稀释至适当浓度,再以甲醇-水(体积比为20/80)溶液为溶剂配制成5ng/mL、10ng/mL、25ng/mL、50ng/mL和100ng/mL的标准工作液。10ng/mL杀线威与杀线威肟标准溶液MRM色谱图见图7~8。④基质匹配标准溶液的配制:称取5份样品(样品已预先确认不含有杀线威与杀线威肟),按照步骤(1)进行前处理与净化,于35℃旋转蒸发至蒸干,加入配制好的系列标准工作液各1mL,涡旋充分溶解残渣;将混合溶液转移至1mL离心管中,于4℃以13000rpm离心10min,取上清液过0.22μm滤膜至样品瓶中,得到5ng/mL、10ng/mL、25ng/mL、50ng/mL和100ng/mL的基质匹配标准溶液。⑤猪肉基质空白溶液:取不含杀线威和杀线威肟的猪肉样品,按照步骤(1)进行前处理与净化得到猪肉基质空白溶液。猪肉基质空白溶液MRM色谱图见图9~10。(3)液相色谱-质谱/质谱法(HPLC-MS/MS)测定将系列猪肉基质匹配标准溶液、猪肉基质空白溶液和样品溶液分别注入HPLC-MS/MS进行测定,建立基质匹配校正曲线,外标法定量。色谱条件为:色谱柱:ACQUITY_UPLCTMBEH,C18柱,2.1*50mm,1.7um;柱温:30℃;进样量:3μL;流动相采用梯度洗脱方式,见表5:表5流动相梯度洗脱方式表5中的甲酸水溶液体积浓度为0.1%;质谱条件为:电离方式:电喷雾电离,正离子扫描(ESI+);检测方式:多反应检测(MRM),MRM监测离子见表6;电喷雾电压(IS):5000V,离子源温度(TEM):550℃,碰撞气(CAD):medium,帘气压力(CUR):25psi,雾化器(GS1):55psi,辅助加热器(GS2):55psi;表6MRM监测离子注:带*离子表示定量离子得到的校正曲线如表7、图1、图2所示:表7杀线威和杀线威肟在猪肉中的基质匹配校正曲线(4)加标回收率和重复性在不含杀线威和杀线威肟的猪肉中加入0.001mg/kg、0.005mg/kg和0.02mg/kg三个水平的杀线威与杀线威标准溶液,室温静置30min后按照步骤(1)进行前处理。其中,猪肉中添加0.005mg/kg杀线威的MRM色谱图见图11,猪肉中添加0.005mg/kg杀线威肟的MRM色谱图见图12;每个添加水平重复5次,结果见表8:表8杀线威和杀线威肟在猪肉中添加回收结果(n=5)表8表明,0.001mg/kg、0.005mg/kg和0.02mg/kg三个加标水平,杀线威的平均回收率范围为76.8%~90.4%,平均相对标准偏差(RSD)范围为4.61%~6.48%;杀线威肟的平均回收率范围为80.6%~89.7%,平均相对标准偏差(RSD)范围为3.30%~3.70%;表明本实施例方法回收率与重复性均符合要求。(5)灵敏度以实际添加样品的最低检测限为检出限,本实施例中,杀线威和杀线威肟在猪肉中的检出限均为0.3μg/kg。实施例2鸡肉中杀线威和杀线威肟残留量测定(1)取待检测鸡肉样品,鸡肉样品前处理方法、标准溶液及空白溶液的配制方法以及测定方法与实施例1一致。鸡肉基质空白溶液MRM色谱图见图13~14。得到的标准工作曲线如表9、图3、图4所示:表9杀线威和杀线威肟在鸡肉中的基质匹配校正曲线农药保留时间/min基质匹配校正曲线相关系数杀线威1.53y=68255x+2534280.9954杀线威肟1.35y=71492x+711540.9995(4)加标回收率和重复性在不含杀线威和杀线威肟的鸡肉中加入0.001mg/kg、0.005mg/kg和0.02mg/kg三个水平的杀线威与杀线威标准溶液,室温静置30min后按照步骤(1)进行前处理。其中,鸡肉添加0.005mg/kg杀线威MRM色谱图见图15,鸡肉添加0.005mg/kg杀线威肟MRM色谱图见图16;每个添加水平重复5次,结果见表10:表10杀线威和杀线威肟在鸡肉中添加回收结果(n=5)表10表明,0.001mg/kg、0.005mg/kg和0.02mg/kg三个加标水平,杀线威的平均回收率范围为84.0%~104%,平均相对标准偏差(RSD)范围为2.04%~3.35%;杀线威肟的平均回收率范围为91.1%~94.1%,平均相对标准偏差(RSD)范围为0.83%~1.80%;表明本实施例方法的回收率与重复性均符合要求。(5)灵敏度以实际添加样品的最低检测限为检出限,本实施例中,杀线威和杀线威肟在鸡肉中的检出限均为0.3μg/kg。实施例3猪肝中杀线威和杀线威肟残留量的测定(1)猪肝样品前处理与测定方法与实施例1一致。猪肝基质空白溶液MRM色谱图见图17~18,得到的杀线威和杀线威肟在猪肝中的基质匹配标准工作曲线如表11、图5、图6所示:表11杀线威和杀线威肟在猪肝中的基质匹配校正曲线(2)加标回收率和重复性在5g不含杀线威和杀线威肟的猪肝样品中中加入0.001mg/kg、0.005mg/kg和0.02mg/kg三个水平的杀线威与杀线威标准溶液,室温静置30min后按照步骤(1)进行前处理。其中,猪肝添加0.005mg/kg杀线威MRM色谱图见图19,猪肝添加0.005mg/kg杀线威肟MRM色谱图见图20;每个添加水平重复5次,结果见表12:表12杀线威和杀线威肟在猪肝中添加回收结果(n=5)表12表明,0.001mg/kg、0.005mg/kg和0.02mg/kg三个加标水平,猪肝中杀线威的平均回收率范围为82.1%~90.5%,平均相对标准偏差(RSD)范围为3.67%~7.21%;杀线威肟的平均回收率范围为88.7%~93.0%,平均相对标准偏差(RSD)范围为0.49%~7.22%。上述结果表明本实施例方法的回收率与重复性均符合要求。(3)灵敏度以实际添加样品的最低检测限为检出限,本实施例中,杀线威和杀线威肟在猪肝中的检出限均为0.3μg/kg。对比实例SN/T3156-2012方法对猪肉中杀线威和杀线威肟残留量的测定采用SN/T3156-2012《乳及乳制品中多种氨基甲酸酯类农药残留量测定方法液相色谱-串联质谱法》的方法对猪肉样品进行前处理和测定。其结果与实施例1对比见表13:表13杀线威和杀线威肟在猪肉中添加回收结果(n=5)和定量限表13结果表明,实施例1中杀线威和杀线威肟在猪肉中的定量限均为0.001mg/kg,而对比实例中杀线威在猪肉中的定量限为0.01mg/kg,且对比实例中未建立杀线威肟的测定方法。实施例1杀线威在猪肉中添加浓度为0.02mg/kg时,平均回收率为80.7%,相对标准偏差(RSD)为4.61%;对比实例中杀线威在猪肉中添加浓度为0.02mg/kg时,平均回收率为100%,相对标准偏差(RSD)为2.80%。实施例1杀线威在猪肉中添加浓度为0.001mg/kg时,平均回收率为76.8%,相对标准偏差(RSD)为4.62%;对比实例中杀线威在猪肉中添加浓度为0.001mg/kg时,杀线威为未检出。实施例1杀线威肟在猪肉中添加浓度为0.01mg/kg和0.02mg/kg时,平均回收率分别为80.6%和86.9%,相对标准偏差(RSD)分别为3.70%和3.30%;对比实例则未建立杀线威肟的测定方法。相对于对比实例,实施例1能进行杀线威和杀线威肟的同时测定,能对基质复杂的动物源食品进行高效的净化从而减少杂质的干扰,而且具有更低的定量限,回收率和重复性也符合要求,表明本发明所建立的方法是适用于动物性食品中杀线威和杀线威肟残留量同时测定的有效方法。综上所述,本发明是采用乙腈对动物源样品进行提取及固相萃取小柱净化提取物,液相色谱-串联质谱法MRM方式同时测定杀线威和杀线威肟,从而达到净化效果良好、方法灵敏度高的目的。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1