基于移动反应界面电泳滴定的定量酶联免疫吸附检测方法与流程
本发明涉及的是一种酶联免疫吸附检测领域的技术,具体是一种基于移动反应界面电泳滴定(moving reaction boundary‐electrophoresis titration,MRB‐ET)的定量酶联免疫吸附检测方法。
背景技术:
1971年Engvall和Perlmann介绍了一种酶联免疫吸附测定(enzyme‐linked immune sorbentassay,ELISA)用于IgG定量检测的方法,将之前用于抗原定位的酶标抗体技术发展成液体标本中微量物质的检测方法(E.Engvall,P.Perlmann,1971,Immunochemistry,8,871‐874.)。该方法的基本原理是:将一抗结合到某种固相载体表面;将酶与二抗连接成为酶标抗体;检测时,把受检样品和酶标抗体按不同步骤与固相载体表面进行反应,最后结合在固相载体上的酶量与样品中待检测抗原的量成一定比例;加入反应底物后,底物在酶催化作用下变成显色产物,其浓度与样品中待测抗原浓度直接相关,故可通过颜色反应的深浅程度进行定性和定量分析(李志勇,2009,食品安全ELISA快速检测技术,中国标准出版社,P2‐3)。
ELISA中酶的催化频率很高,可以极大地放大反应效果,使该方法具有很高的灵敏度(C.M.Maragos,R.D.Plattner,S.D.Miklasz,1996,Food Additives&Contaminants,13,105‐113.)。但该方法对检测装置和检测环境有一定要求,通常需要洗板机、酶标仪、荧光检测或化学发光检测等较为复杂的仪器完成检测。同时为了消除各种干扰,ELISA需要在稳定的实验室环境中进行检测。上述因素使该方法无法实现现场检测、床边诊断和野外分析。针对这些问题,已发展了ELISA分析新技术,包括:荧光探针微量显色技术(G.C.Visor,S.G.Schulman,1981,Journal of Pharmaceutical Sciences,70,469‐475)和微流控芯片技术(N.N.Ye,J.H.Qin,W.W.Shi,X.Liu,B.C.Lin,2007,Lab onaChip,7,1696‐1704)等。以上技术能明显减少酶反应体系体积,向小型化迈出了重要一步。但上述方法仍基于传统比色、荧光或化学发光仪器分析模式,检测设备体积仍然庞大,限制了其在现场、床边检测和野外检测分析中的应用。
胶体金免疫层析法能够实现便携式现场检测分析(W.Faulk,G.M.Taylorn,1971,Immunochemistry,8,1081‐1087)。胶体金是由氯金酸在还原剂(如抗坏血酸、枸橼酸钠等)作用下聚合成一定大小的金纳米颗粒,因静电作用形成稳定的带负电的疏水胶体。胶体金在弱碱环境下带负电荷,可与蛋白质、酶、毒素、激素、抗生素等正电荷基团形成牢固的结合。根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域的免疫学分析。但胶体金免疫层析法只能实现定性或半定量检测,不能实现准确定量检测。
因此,亟待发展微型便携式定量免疫学检测技术。有关移动反应界面电泳滴定的研究为上述问题的解决提供了新原理和新途径(H.Y.Wang,Y.T.Shi,J.Yan,J.Y.Dong,S.Li,H.Y.Xie,L.Y.Fan,C.X.Cao,2014,Analytical Chemistry,86,2888‐2894)。MRB‐ET是指碱性(酸性)待测物质在电场作用下与电泳通道内的酸性(碱性)溶液发生持续的中和反应形成移动反应界面(MRB),通过MRB移动速度与待测物质浓度之间的关系检测待测物浓度的技术。MRB‐ET已用于乳品食品蛋白含量测定,解决了长期困扰凯氏定氮技术的非蛋白氮(NPN)干扰的问题(CN102680556,CN201310089084)以及乳品食品以次掺好定量分析的问题(CN201510542254,CN105136953)。此外,MRB‐ET还成功的用于测定过氧化物酶活性,有效地对各项酶学指标进行快速测定(CN201610021350)。MRB‐ET最显著的优点是形成的MRB能够用裸眼直接观测,极大简化了检测装置,无需信号检测仪器,为微型化免疫学定量分析创造了条件。目前为止,MRB‐ET技术尚未应用到酶联免疫吸附检测分析中,因此有必要开发一种通过MRB‐ET定量检测酶催化产物浓度进而定量检测目标抗体、抗原、或半抗原的新技术。
技术实现要素:
本发明针对现有技术存在的上述不足,提出一种基于移动反应界面电泳滴定的定量酶联免疫吸附检测方法,通过对已知浓度的标准样品进行酶联免疫吸附‐移动反应界面电泳滴定(ELISA‐MRB‐ET)检测,得到MRB移动距离与抗原浓度的数学模型并进行校正,对样品可根据其MRB移动距离直接读出其待测抗原浓度。
本发明是通过以下技术方案实现的:
本发明通过在相同条件下分别对抗原浓度不同且已知的标准样品进行ELISA‐MRB‐ET,从而建立移动反应界面的移动距离与抗原浓度的数学模型,并沿电泳通道标注抗原浓度标尺;在测试阶段通过对待测样品在相同条件下进行ELISA‐MRB‐ET,测得的移动反应界面的停留位置所应的浓度刻度即为样品中的抗原浓度。
所述的ELISA‐MRB‐ET包括:ELISA测定和移动反应界面电泳滴定(MRB‐ET),其中:MRB‐ET滴定通过滴定ELISA酶催化产物间接实现抗原浓度检测,ELISA测定通过抗原与固相一抗结合,洗去未结合物质后加入酶标二抗进行孵育,洗去未结合的酶标二抗,形成的抗原抗体复合物,滴加底物后在酶的催化作用下形成带有颜色的弱碱性/弱酸性的酶催化产物,酶催化产物生成发光或吸光产物。
所述的ELISA测定中的酶标二抗的酶为辣根过氧化物酶;底物为鲁米诺和过氧化氢组合。
所述的移动反应界面电泳滴定通过以下方式实现:弱碱性/弱酸性的酶催化产物在两端施加电场的电泳通道内向阳极/阴极移动,与电泳通道内的填充介质中的缓冲溶液相遇并发生中和反应,发生明显的颜色变化。
所述的电泳通道两端分别设有阴极室和阳极室。
所述的填充介质为凝胶支持介质或全液相介质。
所述的凝胶支持介质采用但不限于:琼脂糖或聚丙烯酰胺。
所述的背景缓冲溶液为与弱碱性/弱酸性的酶催化产物相对应的弱酸性/弱碱性溶液。
所述的移动反应界面还包括:移动络合界面、移动氧化还原界面、移动沉淀界面和移动亲和界面。
所述的数学模型具体为:其中:Cantigen为抗原浓度,dMRB为MRB的移动距离,t1为电泳时间,在实验条件一致的情况下h、k和i为常数,通过标准样品浓度与对应的MRB移动距离拟合得到。
技术效果
与现有技术相比,本发明省去了光密度、荧光、或化学发光检测器,将各种光信号转化成简单的可视化长度度量,由裸眼或成像直接读出,极大地简化了酶联免疫吸附检测,降低成本;并且由于电泳能够实行并行阵列技术,可实现高通量检测。
附图说明
图1为阴极室内酶联免疫吸附的原理图;
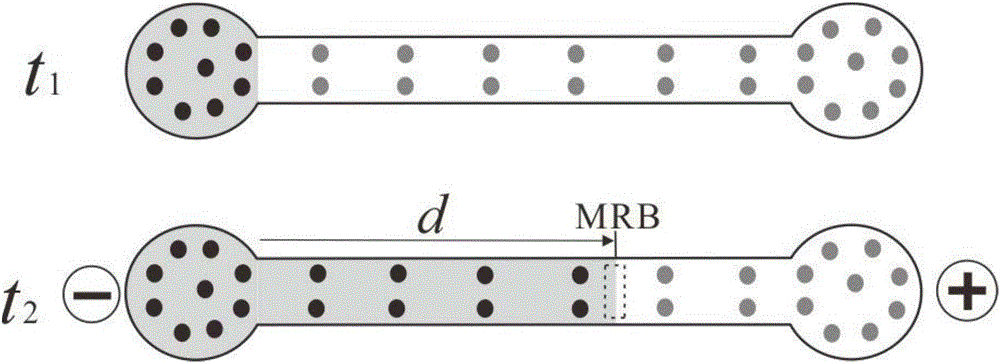
图2为MRB‐ET滴定原理示意图,t1时未施加电场,施加电场t2后MRB移动距离为d;
图3为SEB型肠毒素于标有待浓度刻度的电泳通道阵列中的检测示意图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
如图1~3所示,本实施例通过在相同条件下,对浓度不同且已知的SEB型肠毒素的标准样品进行ELISA‐MRB‐ET检测,并建立MRB移动距离与底物浓度的函数关系、沿电泳通道标注浓度标尺;在样品检测中,使用相同的条件进行ELISA‐MRB‐ET检测,形成的MRB的停留位置所应的浓度刻度即为样品中底物浓度;具体包括以下步骤:
步骤1、在电泳通道内填充凝胶并进行一抗包被和封闭。
所述的电泳通道为直型电泳通道,其长宽高分别为20mm、1.0mm和0.5mm。
所述的电泳通道两端分别设有阴极室和阳极室。
所述的填充凝胶是指:将电泳通道依次使用100mM的氢氧化钠溶液和去离子水各冲洗10min后在分离通道内快速注入加热融化的琼脂糖,冷却凝固。
所述的琼脂糖凝胶内含有100mM KCl,100mM Tris-HCl(pH 6.0)背景缓冲溶液。
所述的背景缓冲溶液在MRB‐ET过程中对酶催化产物能够起到电迁移阻滞效应。
所述的一抗包被是指:将10mg/L的200μL单抗1D2作为一抗在42℃的条件下孵育5h后包被阴极室,并用磷酸缓冲液清洗3次。
所述的封闭是指:使用200μL,1%的牛血清白蛋白(bovine serum albumin,BSA)封闭板上的空白位点,并在37℃的条件下孵育30min,用磷酸缓冲溶液清洗3次,洗净未吸附物质。
步骤2、配制标准样品,在阴极室内进行酶联免疫吸附,并在电泳通道内进行MRB‐ET检测。
所述的标准样品通过以下方法配制:采用磷酸盐缓冲液将SEB标准品倍比稀释为10μg/L、5μg/L、2.5μg/L、1.25μg/L、0.625μg/L和0μg/L六个浓度。
所述的酶联免疫吸附包括以下步骤:
S1:五个稀释浓度的标准样品中的抗原(SEB)分别与阴极室内的固相一抗结合,100μL标准样品和固相一抗的混合物在37℃的条件下孵育30min后用磷酸缓液清洗3次,洗去未结合物质后加入1μg/mL、100μL辣根过氧化物酶结合的二抗2D1在37℃的条件下孵育15min后,用磷酸缓冲液清洗3次,形成抗原抗体复合物。
S2:各阴极室分别加入浓度为80mM的鲁米诺和过氧化氢各50μL,反应30min,形成弱碱性的酶催化产物。
所述的MRB‐ET检测是指:对各标准样品的酶催化产物施加12V的分离电压,持续30s后停止电泳,读取MRB移动距离。
所述的MRB通过以下方式形成:带有负电荷的酶催化产物(激发态鲁米诺)在电泳通道内向阳极室移动,与琼脂糖凝胶中的酸性缓冲溶液相遇并发生中和反应,激发态鲁米诺猝灭发生颜色变化。
步骤3、根据标准样品的抗原浓度和对应的MRB移动距离,得到MRB的移动距离与抗原浓度的散点图,对散点图按照MRB移动距离与抗原浓度之间的函数公式进行拟合,得到MRB移动距离和抗原浓度的校正数学模型。
所述的MRB移动距离与抗原浓度的数学模型为:其中:Cantigen为抗原浓度,dMRB为MRB的移动距离,t1为电泳时间,相同的ELISA‐MRB‐ET的实验条件下h、k和i为常数。
所述的MRB移动距离与抗原浓度的数学模型根据以下关系得到:在MRB‐ET检测时,MRB以一定速度向阳极移动,其移动速度(vMRB)受到酶催化产物的浓度(Cprodcut)和电泳速度(vprodcut),以及氢离子成分浓度和成分速度的共同影响,即而电泳通道中的缓冲溶液恒定不变,且缓冲溶液中酸的浓度远远大于酶催化产物浓度,即存在:而在标准样品和样品检测中均采用相同的实验条件,因此电场恒定不变,存在:vproduct=constant 3;结合上述方程,可得:Cproduct=avMRB+b,其中:a和b为常数。
在ELISA中,抗原浓度(Cantigen)与酶标抗体浓度(即酶浓度Cenzyme)成正比,即存在:Cantigen∝Cenzyme;在酶催化中,底物浓度远大于酶催化能力;因此,在给定时间内产物浓度(Cprodcut)与酶浓度成正比关系,即存在:Cproduct∝Cenzyme;结合两个公式,可得:Cantigen∝Cproduct。出于稳妥考虑,采用二阶方程表示Cantigen和Cproduct之间关系:其中:e、f和g为常数。
结合上述公式,可得:其中:h、k和i均为常数,由于MRB‐ET检测采用相同的电泳时间,则t1同样可视为常数。
所述的标注浓度标尺是指按照校正后的公式对电泳通道上的所有刻度一一进行标注。
步骤4、在与标准样品相同条件下通过ELISA‐MRB‐ET检测样品中的抗原浓度,电泳结束时,MRB的停留位置所对应的浓度刻度即为样品中待测抗原浓度。
所述的MRB还包括:移动络合界面、移动氧化还原界面、移动沉淀界面和移动亲和界面。
所述的样品通过对金黄葡萄球菌污染的牛奶进行培养,10000r/min离心15min取上清获得。
所述的SEB型肠毒素为金黄葡萄糖球菌肠毒素的一种,金黄葡萄糖球菌肠毒素是引起食物中毒的致病因子之一,占细菌性食物中毒的第二位。
本实施例采用SEB双克隆抗体免疫检测。
实施例2
本实施例的标准样品为糖化血红蛋白,采用双抗体夹心法测定人全血中的HbA1C。
本实施例的一抗为10mg/L、200μL的触珠蛋白,在4℃的条件包被阴极室过夜,并用磷酸缓冲液清洗3次。
本实施例的封闭是指:使用200μL、3%的BSA封闭板上的空白位点,并在37℃的条件下孵育1h,用磷酸缓冲溶液清洗3次,除去多余液体。
与实施例1相比的区别在于:本实施例的标准样品的倍比稀释浓度分别为5μg/L、2.5μg/L、1.5μg/L、0.625μg/L、0.3125μg/L和0μg/L。
所述的糖化血红蛋白可反映患者近8~12周的血糖控制情况,是糖尿病诊断新标准和治疗监测的”金标准”。
实施例3
本实施例的标准样品为生菜上残留的硫磷。
所述的硫磷为一种广谱杀虫剂,我国要求农产品的最大残留量应小于0.1mg/kg,而蔬菜和水果上不得检出。
本实施例的一抗为羊抗兔抗体,按2000倍数稀释,在200μL和4℃的条件下包被阴极室过夜,并用磷酸缓冲液清洗3次。
与实施例1相比的区别在于:本实施例的硫磷标准样品的稀释浓度分别为500ng/mL、100ng/mL、25ng/mL、12.5ng/mL、6.5ng/mL和0ng/mL。
本实施例的酶联免疫吸附的实验条件为:10μL的标准样品,45mL的酶标物和45mL的抗体在阴极室内37℃孵育30min,用磷酸缓液清洗3次。
本实施例检测的样品通过以下方法获得:取2g的生菜样品,剪碎后用5mL的甲醇提取过夜,4000r/min离心20min,取上清,用氮气吹干后用含10%的甲醇的磷酸盐缓冲液重新溶解。
- 还没有人留言评论。精彩留言会获得点赞!