一种中草药黄嘌呤氧化酶抑制剂筛选新方法与流程
本发明属于中草药药物筛选领域,具体涉及一种中草药黄嘌呤氧化酶抑制剂筛选新方法。
背景技术:
许多中草药提取物含有黄嘌呤氧化酶(XOD)抑制剂且疗效显著,毒副作用低,安全性高。因此,从中草药中筛选XOD抑制剂已成为当前研究热点。
目前,中草药XOD抑制剂筛选方法主要有紫外分光光度计法、HPLC法、质谱法等。这些方法都是通过对XOD的催化产物尿酸或超氧阴离子进行测定,因而都存在一定的缺陷:如紫外分光光度法需要大量的酶及待筛选成分;HPLC及质谱法需要复杂的样品预处理过程;此外还有可能产生假阳性或假阴性结果。因此,迫切需要开发更为简单、精确、灵敏的XOD抑制剂的筛选新方法。
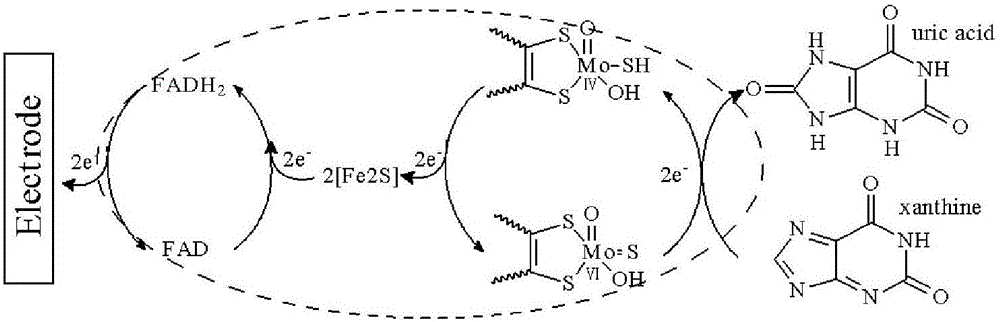
酶催化反应的本质是电子按一定电子转移通道进行转移。XOD催化反应的电子转移通道包含四个活性中心:一个Mo活性位点,两个[2Fe–2S]簇,一个FAD辅酶因子。当XOD与底物结合,Mo接受来自黄嘌呤的两个电子,并经[2Fe–2S]簇传递给FAD产生FADH2。当有抑制剂如别嘌呤醇存在时,抑制剂可与Mo活性位点结合;而非布索坦可阻碍底物与Mo活性位点结合,此时酶催化反应电子转移被阻抑。得益于纳米功能材料的发展,这种电子转移信号可以用电化学方法进行监测,因而黄嘌呤氧化酶催化黄嘌呤(XAN)氧化反应过程中的电子转移信号可用于构建中草药黄嘌呤氧化酶抑制剂的筛选。
技术实现要素:
本发明的原理是基于酶的催化反应本质为电子转移,其目的是提供一种新的中草药黄嘌呤氧化酶抑制剂筛选方法。
本发明是通过以下技术方案实现的:
(1)先将碳纳米材料修饰到电极表面,再将黄嘌呤氧化酶修饰到碳纳米材料修饰的电极表面;或将碳纳米材料与黄嘌呤氧化酶一起修饰到电极表面;
(2)修饰电极干燥后在通氮除氧的缓冲溶液中,采用电化学方法测定修饰电极对黄嘌呤的响应;
(3)基于黄嘌呤的信号变化筛选中草药黄嘌呤氧化酶抑制剂。
进一步地,具体操作步骤如下:
(1)将碳纳米材料用浓硫酸与浓硝酸进行超声处理,洗涤干燥后用水分散,再将碳纳米材料修饰到电极表面,之后干燥,将黄嘌呤氧化酶用水分散,再修饰到经碳纳米材料修饰后的电极表面;或将碳纳米材料与黄嘌呤氧化酶配成溶液一起修饰到电极表面,之后干燥,得到修饰后的电极;
(2)将步骤(1)得到的修饰后的电极放入通氮除氧的缓冲溶液中,加入黄嘌呤,静置吸附5分钟,采用电化学方法测定修饰电极对黄嘌呤的响应;
(3)将修饰电极冲洗干净后放入另一通氮除氧的缓冲溶液中,加入中草药化学成分,静置吸附5分钟,再加入黄嘌呤,静置吸附5分钟,采用电化学方法测定修饰电极对黄嘌呤的响应;
(4)同时,分别测定(2)、(3)中不加黄嘌呤与中草药化学成分时各实验的电化学背景信号;
(5)加入不同量的中草药化学成分,重复(3)、(4)操作;
(6)根据公式筛选中草药黄嘌呤氧化酶抑制剂:计算化学成分对黄嘌呤氧化酶的抑制活性:其中ΔI0是不加样品的峰电流与其背景的电流差,ΔI1是加样品的峰电流与其背景的电流差。
其中步骤(1)所述的碳纳米材料为碳纳米管或石墨烯,还可用碳纳米管或石墨烯与壳聚糖、聚苯胺等高分子材料的混合物代替碳纳米材料。
其中步骤(2)和(3)所述的电化学方法为循环伏安法或计时电流法。
本发明的筛选机理如说明书附图中图1所示。XOD催化XAN氧化电子转移机制见图1,图中圆圈代表XOD。首先,XAN与XOD的Mo位点结合,生成尿酸产物,Mo得到两个电子,然后将这两个电子通过[Fe2-S2]快速传递到FAD,FAD被还原成FADH2。FADH2的电子在特定的电位下可传递到电极,从而在电极上产生灵敏的电流信号。当有抑制剂存在时,抑制剂可与Mo结合或阻止XAN与Mo接近,从而使XOD电子转移通道被阻抑,XOD对XAN的响应电流信号降低。因此,通过观测XOD电子转移阻抑信号可以应用于XOD抑制剂的筛选。
本发明碳纳米材料的信号放大效应机理见说明书附图中图2。XOD的辅酶因子FAD位于酶分子内部,FADH2的电子在一般情况下很难传递到电极表面。但随着纳米材料的引入,其优良的导电性使得FADH2上的电子能够快速到达电极表面产生强烈的电流信号。因此,本文引入纳米材料来实现这一目的,其结果见图2。
本发明具有如下优越性:
这种方法完全不同于其它基于酶催化产物的筛选方法,其信号来源具有唯一性,而且不仅可提供待测物对XOD的抑制活性信息,还可以直观观测待测物电化学信息,二者信息关联即可排除假阳性与假阴性筛选结果;此外,得益于纳米材料的信号放大功能,获得的酶催化电子转移阻抑信号非常灵敏,样品筛选用量少;最后,筛选方法简单快速。
附图说明
图1为本发明中草药XOD抑制剂的筛选原理图。
图2为本发明碳纳米材料的信号放大效应机理图,其中图2A为碳纳米材料修饰电极(1)、XOD+碳纳米材料修饰电极(2)的循环伏安图;图2B为XOD+碳纳米材料修饰电极(1)与XOD+碳纳米材料修饰电极+XAN(2)的循环伏安图。
图3为筛选车前子中四个化合物抑制剂活性的结果图,其中图3A为毛蕊花糖苷的循环伏安图;图3B为异毛蕊花糖苷的循环伏安图、图3C为去咖啡酰基毛蕊花糖苷的循环伏安图;图3D为bis(2-ethythexyl)-benzene-1,2-dicarboxylate(D)的循环伏安图。
具体实施例
实施例1:
一种新的中草药黄嘌呤氧化酶抑制剂筛选方法,包括如下步骤:
(1)将碳纳米材料用浓硫酸与浓硝酸组成的混合酸超声处理2~10h,混合酸中浓硫酸与浓硝酸的体积比为3:1,然后将碳纳米材料用水洗涤至pH呈中性后过滤,干燥;精密称取已处理好的碳纳米材料10mg,用蒸馏水配成浓度为1.0mg/mL的碳纳米材料溶液,超声3h分散,并取4μL碳纳米材料溶液饰到电极表面,之后干燥;
(2)将黄嘌呤氧化酶用蒸馏水分散至浓度为0.17U/μL,取2μL黄嘌呤氧化酶溶液修饰到步骤(1)中的经碳纳米材料修饰后的电极表面;或将碳纳米材料和浓度为0.17U/μL的黄嘌呤氧化酶溶液以等体积比混合配成溶液,取6μL该溶液一起修饰到电极表面,之后干燥;
(3)修饰电极干燥后置于5mL通氮除氧的的磷酸缓冲溶液(PBS,1/15mol/L,pH=5.3)中,加入质量浓度为14.0μg/μL的黄嘌呤溶液10μL,静置吸附5分钟,采用电化学方法如循环伏安法或计时电流法测定修饰电极对黄嘌呤的响应;
(4)之后,再将修饰电极冲洗干净后置于另一体积为5mL的通氮除氧的磷酸缓冲溶液(PBS,1/15mol/L,pH=5.3)中,加入6μL质量浓度为3mg/mL的中草药化学成分溶液,即中草药化学成分的最终浓度为3.6μg/mL,静置吸附5分钟,再加入黄嘌呤10μL,静置吸附5分钟,采用电化学方法如循环伏安法或计时电流法测定修饰电极对黄嘌呤的响应;
(5)同时,分别测定(3)、(4)中不加黄嘌呤与中草药化学成分溶液时各实验的电化学背景信号;
(6)加入不同量(12、18、24μL)的质量浓度为3mg/mL的中草药化学成分溶液,重复(4)、(5)操作;
(7)根据公式筛选中草药XOD抑制剂:计算化学成分对XOD的抑制活性:其中ΔI0是不加样品的峰电流与其背景的电流差,ΔI1是加样品的峰电流与其背景的电流差。
将本方法应用于筛选车前子中四个化合物抑制剂活性,结果见说明书附图中图3。图3A、B、C、D分别为XOD/DWNTs/GCE电极在毛蕊花糖苷(浓度分别为0、3.6、7.2、10.8、14.4μg/ml)、异毛蕊花糖苷(浓度分别为0、3.6、7.2、10.8、14.4μg/ml)、去咖啡酰基毛蕊花糖苷(浓度分别为0、1.8、9.0、18.0μg/ml)及bis(2-ethythexyl)-benzene-1,2-dicarboxylate(浓度分别为0、1.8、9.0、18.0μg/ml)存在时对XAN(28.0μg/ml)的响应。由图3A和B可知,毛蕊花糖苷及异毛蕊花糖苷在200~500mV电位出现两对氧化还原峰,这两对氧化还原峰随着毛蕊花糖苷、异毛蕊花糖苷浓度的增加而增加,说明毛蕊花糖苷与异毛蕊花糖苷是电活性成分,但并不对阻抑信号产生干扰。而图3A 610mV处的峰电流随着其浓度增加而降低,说明毛蕊花糖苷可对XOD催化反应电子转移通道产生阻抑,对XOD具有较好的抑制作用,其IC50计算值为8.4μg/ml,筛选结果与文献接近[解放军学报,2006,22(1):30-32]。而异毛蕊花糖苷在610mV电流却基本保持不变,显然它对XOD基本没有抑制活性。为更好说明抑制剂筛选效果,图3C、D中每个浓度的电位均依次往左平移50mV。由图3C和D可知,除了XOD/DWNTs/GCE电极原有信号外,并没有新的信号出现。这表明去咖啡酰基毛蕊花糖苷(C)及bis(2-ethythexyl)-benzene-1,2-dicarboxylate(D)在此电位范围内并非电活性成分。图3C中610峰电流在低、中、高三个剂量组均无变化,而图3D中610mV处的峰电流随bis(2-ethythexyl)-benzene-1,2-dicarboxylate浓度增高缓慢下降,表明去咖啡酰基毛蕊花糖苷(C)对电子转移通道不产生阻抑,而bis(2-ethythexyl)-benzene-1,2-dicarboxylate则对XOD具有较弱的抑制作用,因而是一种较弱的XOD抑制剂。
- 还没有人留言评论。精彩留言会获得点赞!
- 一锅法合成托匹司他的方法
- 草本水杨梅在制备黄嘌呤氧化酶抑制剂中的应用
- 5-芳基吡唑并嘧啶衍生物的合成方法
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 2-(5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺)戊二酸二乙酯的合成方法
- 一种黄嘌呤脱氢酶截断体及其应用
- 5-(4-氟苯基)-N–(3-(二甲基氨基)丙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种5-芳基吡唑并[1,5-a]嘧啶衍生物的合成方法