标记物质、免疫学的测定法、免疫学的测定用试药、分析物的测定方法、分析物测定用套组以及侧流型色谱用测试条与流程
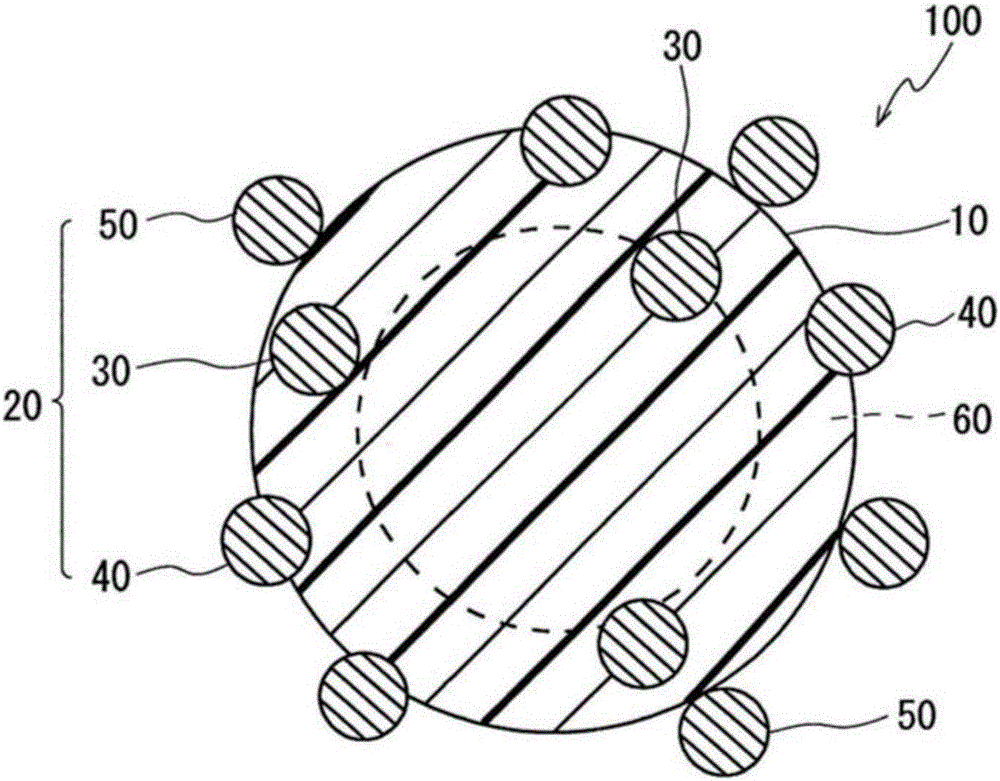
本发明涉及一种可用于免疫学的测定,感度、耐久性及视认性优异的标记物质及利用其的免疫学的测定法,免疫学的测定用试药,分析物的测定方法,分析物测定用套组以及侧流型色谱用测试条。
背景技术:
:在生物体内存在无数的化学物质,因此定性地、定量地对生物体内的特定的微量成分进行分析是极其重要的技术。在医疗、制药、健康食品、生物技术、环境等领域中,仅对生物体内的特定的部位(化学物质)发挥作用的药品及食品、检测生物体的略微的变化的分析装置及诊断药等与所述技术一同发展。所述分析技术之一有免疫测定(immunoassay)。所述技术也被称为免疫学的测定法,其是利用作为免疫反应之一的抗原-抗体间的特异的反应,定性地、定量地对微量成分进行分析的方法。抗原-抗体间反应因感度或反应的选择性高,故广泛地用于所述领域。免疫测定根据其测定原理而存在各种测定法。例如可列举:酶免疫测定法(EnzymeImmunoassay,EIA)、放射性免疫测定法(Radioimmunoassay,RIA)、化学发光免疫测定法(ChemiluminescentImmunoassay,CLIA)、荧光免疫测定法(FluorescenceImmunoassay,FIA)、乳胶等的凝聚法(乳胶免疫测定法(LatexImmunoassay,LIA)、颗粒凝聚(ParticleAgglutination,PA))、免疫色谱法(Immunochromatography,ICA)、红血球凝聚法(Hemagglutination,HA)、红血球凝聚抑制法(HemagglutinationInhibition,HI)等。再者,除免疫测定以外,有物理·化学的测定法、生物学的测定法等。免疫测定根据抗原及抗体进行反应而形成复合体时的变化(抗原、抗体或复合体的浓度变化),定性地或定量地检测抗原或抗体。当检测这些时,使抗体、抗原或复合体与标记物质结合,由此检测感度增大。因此,标记物质的标记能力可以说是影响免疫测定中的检测能力的重要的要素。在以上所例示的免疫测定中,也使用红血球(HA的情况)、乳胶粒子(LIA的情况)、荧光色素(FIA的情况)、放射性元素(RIA的情况)、酶(EIA的情况)、化学发光物质(CLIA的情况)等作为标记物质。然而,当使用经着色的微粒子作为标记物质时,可不使用特别的分析装置而通过目视来确认检测,因此期待可实现更简便的测定。作为此种经着色的微粒子,可列举:金属及金属氧化物的胶体状粒子、利用色素进行了着色的乳胶粒子等(专利文献1、专利文献4等)。但是,所述胶体状粒子根据粒径及制备条件来决定色调,因此存在难以获得所期望的鲜明的浓色调的,即视认性不充分这一问题。另外,所述经着色的乳胶粒子存在利用色素的着色的效果低、目视判定性不充分这一问题。再者,若为了消除所述问题而增加色素的着色量,则色素覆盖乳胶的表面,乳胶粒子原本的表面状态受损,因此存在难以使抗原或抗体结合这一问题。另外,还存在如下的问题:在薄膜过滤器等色谱介质的细孔内堵塞、或乳胶粒子产生非特异凝聚、或因增加色素的着色量而浓浓地着色的情况未必与性能的提升有关联。为了提升所述标记物质的视认性,揭示有如下的免疫色谱方法:在结合有标记物质的抗体(标记抗体)与抗原进行反应而形成复合体后,进而使其他金属对这些标记物质进行修饰,由此使标记物质的检测感度增幅(专利文献2及专利文献5)。但是,在所述方法中,为了使金属银进行修饰而需要特别的装置。因此,操作繁杂,难以实现稳定的增幅。另外,可认为因需要特别的装置等而耗费测定成本,故可应用的用途及使用环境受到限定。另外,揭示有一种包含与聚合物系乳胶粒子的表面结合的金纳米粒子的着色乳胶(专利文献3)。通过使聚合物系乳胶粒子的表面与金纳米粒子结合,所述金纳米粒子本身作为着色剂而有助于目视判定性或检测感度的提升,另一方面,金纳米粒子本身对于抗原或抗体的结合性也优异,因此即便使金纳米粒子结合至变成足够浓的颜色的程度为止,也可使足够量的抗原或抗体进行结合。所述着色乳胶是通过对苯乙烯-丙烯酸共聚物乳胶及金纳米粒子的前体即HAuCl的分散液照射γ射线来使所述乳胶的表面与金纳米粒子结合而成的。但是,所述着色乳胶因金纳米粒子仅与乳胶的表面结合,故不仅显现表面等离子体激元(surfaceplasmon)吸收的金粒子的承载量有限,而且金纳米粒子容易脱离。其结果,存在作为免疫学的测定用试药的视认性或感度不充分之虞。另外,因照射γ射线等电磁放射线,故存在对乳胶造成损害之虞。进而,在专利文献3的说明书中揭示有所述乳胶径或金纳米粒子径的优选的范围,但在实施例中是否在这些优选的范围内得到验证并不明确,不存在优选范围的规定依据。另外,在专利文献4中揭示有一种由金属金包覆的聚合物乳胶粒子,且暗示对于可用于显微镜检査法及免疫测定法的试药的应用。但是,所述由金属金包覆的聚合物乳胶粒子未揭示聚合物乳胶粒子的材质或粒径。进而,作为可用于免疫测定法的试药的效果并无验证。因此,作为金属金及聚合物乳胶粒子中的试药的效果不明。根据以上所述,结合或包覆有金纳米粒子的乳胶粒子虽然作为免疫学的测定用的试药而受到期待,但在现有的技术中,耐久性或视认性并不充分。另外,即便是视认性高的,可应用的用途及使用环境也受到限定。现有技术文献专利文献专利文献1:日本专利特开平5-10950号公报专利文献2:日本专利特开2011-117906号公报专利文献3:日本专利特开2009-168495号公报专利文献4:日本专利特开平3-206959号公报专利文献5:日本专利特开2009-192270号公报技术实现要素:发明要解决的课题本发明的目的在于提供一种可用于免疫学的测定,感度、耐久性及视认性优异,且不需要特别的装置或作业步骤的追加而可实现高感度的判定的标记物质。解决问题的技术手段本发明人等人进行努力研究的结果,发现通过利用具有特定的结构的树脂-金属复合体,可解决所述课题,从而完成了本发明。即,本发明的标记物质包括具有将金属粒子固定于树脂粒子上而成的结构的树脂-金属复合体,其特征在于:具备以下的(A)、(B)的任一种构成:(A)所述树脂-金属复合体的平均粒径超过300nm;或者(B)所述金属粒子的平均粒径为超过20nm、未满70nm的范围内。本发明的标记物质在所述(A)时,所述金属粒子的平均粒径可为1nm以上、80nm以下的范围内。本发明的标记物质在所述(A)时,所述树脂-金属复合体的平均粒径可为超过300nm、且为1000nm以下的范围内。在此情况下,所述金属粒子可为金粒子。本发明的标记物质在所述(B)时,所述树脂-金属复合体的平均粒径可为100nm以上、1000nm以下的范围内。在此情况下,所述金属粒子可为金粒子。本发明的标记物质可为使所述树脂-金属复合体分散于水中而成者。本发明的标记物质可为使抗原或抗体吸附于所述树脂-金属复合体的表面来使用者。本发明的免疫学的测定法的特征在于:使用所述任一种标记物质。本发明的免疫学的测定用试药包括所述任一种标记物质。本发明的分析物的测定方法是对试样中所含有的分析物进行检测或定量的分析物的测定方法。本发明的分析物的测定方法使用包含薄膜、及将与所述分析物特异地结合的捕捉配体固定于所述薄膜上而成的判定部的侧流型色谱用测试条。而且,本发明的分析物的测定方法的特征在于:进行包括下述步骤(I)~步骤(III)的步骤;步骤(I):使试样中所含有的所述分析物、与利用所述任一种标记物质对与所述分析物特异地结合的抗体进行标记而成的标记抗体接触的步骤,步骤(II):在所述判定部中,使步骤(I)中所形成的含有分析物与标记抗体的复合体接触捕捉配体的步骤,步骤(III):测定源自所述标记物质中的所述树脂-金属复合体的局部型表面等离子体激元共振的显色强度的步骤。本发明的分析物测定用套组是使用侧流型色谱用测试条,用以对试样中所含有的分析物进行检测或定量的分析物测定用套组。本发明的分析物测定用套组包括:侧流型色谱用测试条,包含薄膜、及将与所述分析物特异地结合的捕捉配体固定于所述薄膜上而成的判定部;以及检测试药,包含利用根据权利要求第1项至第8项中任一项所述的标记物质对与所述分析物特异地结合的抗体进行标记而成的标记抗体。本发明的侧流型色谱用测试条是用以对试样中所含有的分析物进行检测或定量的侧流型色谱用测试条。本发明的侧流型色谱用测试条包括:薄膜;判定部,在所述试样展开的方向上,将与所述分析物特异地结合的捕捉配体固定于所述薄膜上而形成;以及反应部,在比所述判定部更上游侧包含利用根据权利要求第1项至第8项中任一项所述的标记物质对与所述分析物特异地结合的抗体进行标记而成的标记抗体。发明的效果本发明的标记物质具备具有将金属粒子固定于树脂粒子上而成的结构的树脂-金属复合体。因此,对于树脂粒子的显现局部型表面等离子体激元吸收的金属粒子的承载量多。因此,本发明的标记物质作为耐久性及视认性优异、不需要特别的装置或作业步骤的追加而可实现高感度的判定的优异的材料,可优选地应用于例如EIA、RIA、CLIA、FIA、LIA、PA、ICA、HA、HI等免疫学的测定。附图说明图1是表示构成本发明的一实施形态的标记物质的树脂-金属复合体的剖面的结构的示意图。图2是表示使用本发明的一实施形态的侧流型色谱用测试条的分析物的测定方法的概要的说明图。图3是实施例1中所获得的树脂-金属复合体的扫描型电子显微镜(ScanningElectronMicroscope,SEM)照片。图4是实施例9中所获得的树脂-金复合体的扫描型电子显微镜(SEM)照片。图5是实施例9中所获得的树脂-金复合体的剖面的扫描型透射电子显微镜(ScanningTransmissionElectronMicroscope,STEM)照片。图6是实施例10中所获得的树脂-金复合体的扫描型电子显微镜(SEM)照片。图7是实施例10中所获得的树脂-金复合体的剖面的扫描型透射电子显微镜(STEM)照片。具体实施方式以下,一面适宜参照附图,一面对本发明的实施形态进行详细说明。[第1实施形态]本发明的第1实施形态的标记物质具备具有将金属粒子固定于树脂粒子上而成的结构的树脂-金属复合体,且所述树脂-金属复合体的平均粒径超过300nm。图1是构成本实施形态的标记物质的树脂-金属复合体的剖面示意图。树脂-金属复合体100具备树脂粒子10与金属粒子20。具有树脂-金属复合体100的本实施形态的标记物质例如可优选地用作免疫学的测定用试药或其材料。树脂-金属复合体100将金属粒子20分散或固定于树脂粒子10上。另外,树脂-金属复合体100的金属粒子20的一部分二维地或三维地分布于树脂粒子10的表层部60中,且所述三维地分布的金属粒子20的一部分朝树脂粒子10外部分地露出,剩余的一部分内包于树脂粒子10中。此处,在金属粒子20中存在完全地内包于树脂粒子10中的金属粒子(以下,也称为“内包金属粒子30”)、具有包埋于树脂粒子10内的部位及朝树脂粒子10外露出的部位的金属粒子(以下,也称为“部分露出金属粒子40”))、及吸附于树脂粒子10的表面的金属粒子(以下,也称为“表面吸附金属粒子50”)。当将树脂-金属复合体100用作标记物质时,将抗体或抗原固定于部分露出金属粒子40或表面吸附金属粒子50上来使用。此时,将所述抗体或抗原固定于部分露出金属粒子40及表面吸附金属粒子50上,另一方面,不固定于内包金属粒子30上。但是,包含内包金属粒子30的金属粒子20均显现局部型表面等离子体激元吸收,因此不仅部分露出金属粒子40及表面吸附金属粒子50有助于标记物质的视认性提升,内包金属粒子30也有助于标记物质的视认性提升。进而,与表面吸附金属粒子50相比,部分露出金属粒子40及内包金属粒子30与树脂粒子10的接触面积大,除此以外,由埋包状态所产生的定锚效应等物理的吸附力强,难以自树脂粒子10中脱离。因此,可使作为使用树脂-金属复合体100的标记物质的耐久性、稳定性变得优异。内包金属粒子30是整个表面被构成树脂粒子10的树脂覆盖的。另外,部分露出金属粒子40是其表面积的5%以上、未满100%被构成树脂粒子10的树脂覆盖的。就耐久性的观点而言,其下限优选为表面积的20%以上,更优选为30%以上。另外,表面吸附金属粒子50是其表面积的超过0%、未满5%被构成树脂粒子10的树脂覆盖的。另外,相对于树脂-金属复合体100的重量,对于树脂-金属复合体100的金属粒子20(内包金属粒子30、部分露出金属粒子40及表面吸附金属粒子50的合计)的承载量优选为5wt%(重量百分比)~70wt%。若为所述范围,则树脂-金属复合体100的作为标记物质的视认性、目视判定性及检测感度优异。若金属粒子20的承载量未满5wt%,则存在抗体或抗原的固定化量变少、检测感度下降的倾向。金属粒子20的承载量更优选为15wt%~70wt%。另外,优选为金属粒子20的10wt%~90wt%为部分露出金属粒子40及表面吸附金属粒子50。若为所述范围,则可充分确保朝金属粒子20上的抗体或抗原的固定化量,因此作为标记物质的感度高。更优选为金属粒子20的20wt%~80wt%为部分露出金属粒子40及表面吸附金属粒子50,就耐久性的观点而言,进而更优选为表面吸附金属粒子50为20wt%以下。另外,为了在免疫学的测定中获得优异的检测感度,优选为金属粒子20的60wt%~100wt%、优选为75wt%~100wt%、更优选为85wt%~100wt%存在于表层部60中,更优选为存在于自树脂粒子10的表面起在深度方向上为粒子半径的40%的范围内。另外,存在于表层部60中的金属粒子20的5wt%~90wt%为部分露出金属粒子40或表面吸附金属粒子50,可充分确保朝金属粒子20上的抗体或抗原的固定化量,因此作为标记物质的感度高,故优选。换言之,存在于表层部60中的金属粒子20的10wt%~95wt%为内包金属粒子30即可。此处,所述“表层部”是指以树脂-金属复合体100的最外侧的位置(即,部分露出金属粒子40或表面吸附金属粒子50的突出端部)为基准,自树脂粒子10的表面起在深度方向上为粒子半径的50%的范围。另外,所述“二维地分布”是指金属粒子20分布于树脂粒子10的面方向上。所述“三维地分布”是指金属粒子20不仅分布于树脂粒子10的面方向上,也分布于深度方向上。就金属粒子20难以自树脂粒子10中脱离的观点及金属粒子20的承载量变多的观点而言,优选为金属粒子20“三维地分布”。另外,在本实施形态中,树脂-金属复合体100的平均粒径为超过300nm。若树脂-金属复合体100的平均粒径为300nm以下,则存在作为标记物质的视认性或感度下降的倾向。树脂-金属复合体100的平均粒径优选为超过300nm、且为1000nm以下,更优选为340nm以上、未满650nm。此处,树脂-金属复合体100的粒径是指树脂粒子10的粒径与部分露出金属粒子40或表面吸附金属粒子50的突出部位的长度相加所得的值,可利用激光衍射/散射法、动态光散射法、或离心沉淀法进行测定。树脂粒子10优选为结构中具有可吸附金属离子的取代基的聚合物粒子。尤其,优选为含氮聚合物粒子。含氮聚合物中的氮原子容易化学吸附视认性优异、抗原或抗体的固定化容易的金、钯等金属粒子的前体即阴离子性金属离子,故优选。在本实施形态中,使吸附于含氮聚合物中的金属离子还原,而形成金属纳米粒子,因此所生成的金属粒子20的一部分成为内包金属粒子30或部分露出金属粒子40。另外,如丙烯酸聚合体般,羧酸等可吸附阳离子性金属离子,因此容易吸附银、镍、铜等金属粒子的前体即阳离子性金属离子,而可形成银、镍、铜等的金属粒子20,也可制作与所述金、钯等金属的合金。另一方面,在为结构中具有可吸附金属离子的取代基的含氮聚合物以外的树脂粒子,例如聚苯乙烯等的情况下,树脂内部难以吸附所述金属离子。其结果,所生成的金属粒子20的大部分成为表面吸附金属粒子50。如上所述,表面吸附金属粒子50与树脂粒子10的接触面积小,因此存在树脂与金属的接着力小、金属粒子20自树脂粒子10中脱离的影响大的倾向。所述含氮聚合物为主链或侧链上具有氮原子的树脂,例如有多胺、聚酰胺、多肽、聚氨基甲酸酯、聚脲、聚酰亚胺、聚咪唑、聚噁唑、聚吡咯、聚苯胺等。这些之中,优选为聚-2-乙烯基吡啶、聚-3-乙烯基吡啶、聚-4-乙烯基吡啶等多胺。另外,当在侧链上具有氮原子时,例如可广泛利用丙烯酸树脂、酚树脂、环氧树脂等。金属粒子20例如可应用银、镍、铜、金、钯等。优选为视认性优异、抗原或抗体的固定化容易的金及钯。这些显现源自局部型表面等离子体激元共振的吸收,故优选。更优选为保存稳定性良好的金。这些金属能够以单体或合金等复合体来使用。此处,例如作为金合金,是指包含金与金以外的金属种类,并含有10wt%以上的金的合金。另外,通过扫描型电子显微镜(SEM)观察来测定长度的金属粒子20的平均粒径例如优选为1nm~80nm。在金属粒子20的平均粒径未满1nm的情况或超过80nm的情况下,局部型表面等离子体激元难以显现,因此存在感度下降的倾向。当金属粒子20为金粒子时,第1实施形态中的金属粒子20的平均粒径优选为20nm以上、未满70nm,更优选为22nm以上、未满50nm。[第2实施形态]本发明的第2实施形态的标记物质具备具有将金属粒子固定于树脂粒子上而成的结构的树脂-金属复合体,且所述金属粒子的平均粒径为超过20nm、未满70nm的范围内。构成本实施形态的标记物质的树脂-金属复合体除金属粒子的平均粒径的范围、及树脂-金属复合体的平均粒径的范围与第1实施形态(图1)的树脂-金属复合体100不同以外,与第1实施形态(图1)的树脂-金属复合体100相同。以下,也一面参照图1,一面以与第1实施形态的不同点为中心进行说明。在第2实施形态中所使用的树脂-金属复合体100中,通过扫描型电子显微镜(SEM)观察来测定长度的金属粒子20的平均粒径例如超过20nm、未满70nm。若金属粒子20的平均粒径为20nm以下,则存在感度下降的倾向,若为70nm以上,则存在视认性下降的倾向。金属粒子20的平均粒径更优选为22nm以上、未满50nm。另外,树脂-金属复合体100的平均粒径例如优选为100nm~1000nm。若树脂-金属复合体100的平均粒径未满100nm,则例如当将金粒子用作金属粒子20时,存在金粒子的承载量变少的倾向,因此存在与同尺寸的金粒子相比着色变弱的倾向,若超过1000nm,则存在当制成试药时,容易在薄膜过滤器等色谱介质的细孔内堵塞的倾向、或分散性下降的倾向。树脂-金属复合体100的平均粒径优选为100nm以上、未满700nm,更优选为340nm以上、未满650nm。此处,树脂-金属复合体100的粒径是指树脂粒子10的粒径与部分露出金属粒子40或表面吸附金属粒子50的突出部位的长度相加所得的值,可利用激光衍射/散射法、动态光散射法、或离心沉淀法进行测定。在第2实施形态的标记物质中所使用的树脂-金属复合体100中,所述以外的构成与第1实施形态中所使用的树脂-金属复合体100相同,故省略说明。[树脂-金属复合体的制造方法]所述第1实施形态及第2实施形态的标记物质中所使用的树脂-金属复合体100的制造方法并无特别限定。例如,向利用乳化聚合法所制造的树脂粒子10的分散液中添加含有金属离子的溶液,使金属离子吸附于树脂粒子10上(以下,称为“金属离子吸附树脂粒子”)。进而,将金属离子吸附树脂粒子添加至还原剂溶液中,由此使金属离子还原而生成金属粒子20,从而获得树脂-金属复合体100。另外,例如当使用金粒子作为金属粒子20时,作为含有金属离子的溶液,可列举氯金酸(chloroauricacid)(HAuCl4)水溶液等。另外,还可使用金属络合物来代替金属离子。另外,作为含有金属离子的溶液的溶媒,可使用甲醇、乙醇、正丙醇、异丙醇、正丁醇、仲丁醇、叔丁醇等含水醇或醇,盐酸、硫酸、硝酸等酸等来代替水。另外,视需要,也可向所述溶液中添加例如聚乙烯醇等水溶性高分子化合物、表面活性剂、醇类;四氢呋喃、二乙醚、二异丙醚等醚类;烷二醇、聚烷二醇、这些的单烷基醚或二烷基醚、甘油等多元醇类;丙酮、甲基乙基酮等酮类等各种水混合性有机溶媒等添加剂。此种添加剂促进金属离子的还原反应速度,另外,对于控制所生成的金属粒子20的大小有效。另外,还原剂可使用公知的。例如可列举:硼氢化钠、二甲基胺硼烷、柠檬酸、次亚磷酸钠、水合肼(hydrazinehydrate)、盐酸肼(hydrazinehydrochloride)、硫酸肼(hydrazinesulfate)、甲醛、蔗糖、葡萄糖、抗坏血酸、次膦酸钠、对苯二酚、罗谢耳盐(rochellesalt)等。其中,优选为硼氢化钠或二甲基胺硼烷、柠檬酸。在还原剂溶液中,视需要可添加表面活性剂、或调整溶液的pH。pH调整可利用硼酸或磷酸等缓冲剂,盐酸或硫酸等酸,氢氧化钠或氢氧化钾等碱来调整。进而,利用还原剂溶液的温度来调整金属离子的还原速度,由此可控制所形成的金属粒子的粒径。另外,当使所述金属离子吸附树脂粒子中的金属离子还原来生成金属粒子20时,可将所述金属离子吸附树脂粒子添加至还原剂溶液中,也可将还原剂添加至所述金属离子吸附树脂粒子中,但就内包金属粒子30及部分露出金属粒子40的生成容易性的观点而言,优选为前者。另外,为了保持树脂-金属复合体100对于水的分散性,例如可添加柠檬酸、聚-L-赖氨酸、聚乙烯基吡咯烷酮(polyvinylpyrrolidone)、聚乙烯基吡啶、聚乙烯醇、迪斯帕毕克(DISPERBYK)194、迪斯帕毕克(DISPERBYK)180、迪斯帕毕克(DISPERBYK)184(日本毕克化学(BYK-ChemieJapan)公司制造)等分散剂。进而,可利用硼酸或磷酸等缓冲剂,盐酸或硫酸等酸,氢氧化钠或氢氧化钾等碱来调整pH,并保持分散性。具有以上的构成的树脂-金属复合体100尤其通过使抗原或抗体吸附于金属粒子20的表面而可优选地作为标记物质应用于例如EIA、RIA、CLIA、FIA、LIA、PA、ICA、HA、HI等免疫学的测定法。另外,尤其可优选地用作低浓度区域(高感度区域)中的目视判定性优异的标记物质。另外,标记物质的形态并无特别限定,例如,可用作使树脂-金属复合体100分散于水或调整了pH的缓冲液中而成的分散液。作为使抗原或抗体吸附于所述金属粒子20的表面的方法,并无特别限定,可使用利用公知的物理吸附及化学吸附的方法。例如可列举:使树脂-金属复合体100浸渍于含有抗原或抗体的缓冲液中进行培养(incubate)等物理吸附,或将SH基导入至抗原或抗体中,并与树脂-金属复合体100进行反应而形成Au-SH键等化学吸附。其中,就金属粒子20与抗原或抗体的结合变得牢固而言,优选为化学吸附。其次,对将树脂-金属复合体100用作标记物质的分析物的测定方法、侧流型色谱用测试条及分析物检测·定量套组进行说明。[侧流型色谱用测试条]首先,一面参照图2,一面对本发明的一实施形态的侧流型色谱用测试条(测试条)进行说明。如后述般,所述测试条200可优选地用于本发明的一实施形态的分析物的测定方法。测试条200具备薄膜110。在薄膜110中,在试样的展开方向上依次设置有试样添加部120、判定部130及吸液部140。<薄膜>作为测试条200中所使用的薄膜110,可应用一般的测试条中用作薄膜材料的。薄膜110例如由包含如下的微细多孔性物质的惰性物质(不与分析物160、各种配体等进行反应的物质)形成,所述微细多孔性物质显示出毛细管现象,添加试样的同时,试样展开。作为薄膜110的具体例,可列举:包含聚氨基甲酸酯、聚酯、聚乙烯、聚氯乙烯、聚偏二氟乙烯(polyvinylidenefluoride)、尼龙、纤维素衍生物等的纤维状或不织纤维状基质、膜、滤纸、玻璃纤维滤纸、布、棉等。这些之中,优选为可使用包含纤维素衍生物或尼龙的膜、滤纸、玻璃纤维滤纸等,更优选为可使用硝基纤维素膜、混合硝基纤维素酯(硝基纤维素与乙酸纤维素的混合物)膜、尼龙膜、滤纸。为了使操作变得更简便,测试条200优选为具备支撑薄膜110的支撑体。作为支撑体,例如可使用塑料等。<试样添加部>测试条200也可具有用以添加含有分析物160的试样的试样添加部120。在测试条200中,试样添加部120是用以接收含有分析物160的试样的部位。试样添加部120可在试样展开的方向上,形成在比判定部130更上游侧的薄膜110上,或者也可在薄膜110上设置例如包含纤维素滤纸、玻璃纤维、聚氨基甲酸酯、聚乙酸酯、乙酸纤维素、尼龙、棉布等材料的试样添加垫来构成试样添加部120。<判定部>在判定部130中固定有与分析物160特异地结合的捕捉配体131。捕捉配体131只要是与分析物160形成特异的结合的,则可无特别限制地使用,例如可优选地使用针对分析物160的抗体等。即便在向测试条200提供试样的情况下,捕捉配体131也以不自判定部130移动的方式固定化。捕捉配体131只要通过物理的结合或化学的结合或者吸附等,而直接地或间接地固定于薄膜110上即可。另外,判定部130只要是如含有标记抗体150与分析物160的复合体170接触与分析物160特异地结合的捕捉配体131般的构成,则并无特别限定。例如,可在薄膜110上直接固定捕捉配体131,或者也可在固定在薄膜110上的包含纤维素滤纸、玻璃纤维、不织布等的垫上固定捕捉配体131。<吸液部>吸液部140例如由纤维素滤纸、不织布、布、乙酸纤维素等吸水性材料的垫形成。所添加的试样的展开前线(frontline)到达吸液部140后的试样的移动速度根据吸液部140的材质、大小等而不同。因此,可通过吸液部140的材质、大小等的选定,而对分析物160的检测·定量设定最合适的速度。再者,吸液部140为任意的构成,也可省略。测试条200视需要可进而含有反应部、控制部等任意的部位。<反应部>虽然省略图示,但在测试条200中,也可在薄膜110上形成含有标记抗体150的反应部。反应部可在试样流动的方向上,设置在比判定部130更上游侧。再者,也可将图2中的试样添加部120用作反应部。当测试条200具有反应部时,若向反应部或试样添加部120提供含有分析物160的试样,则在反应部中,可使试样中所含有的分析物160与标记抗体150接触。在此情况下,仅向反应部或试样添加部120提供试样,由此可形成含有分析物160与标记抗体150的复合体170,因此可实现所谓的一步骤型的免疫色谱法。反应部只要含有与分析物160特异地结合的标记抗体150,则并无特别限定,可为将标记抗体150直接涂布于薄膜110上而成的。或者,反应部也可为将使标记抗体150含浸于例如包含纤维素滤纸、玻璃纤维、不织布等的垫(结合垫(conjugatepad))中的固定在薄膜110上而成的。<控制部>虽然省略图示,但测试条200也可在试样展开的方向上,形成将与标记抗体150特异地结合的捕捉配体固定在薄膜110上而成的控制部。通过在判定部130与控制部中一同测定显色强度,可确认向测试条200提供的试样展开后到达反应部及判定部130,且检査正常地进行。再者,控制部除使用与标记抗体150特异地结合的其他种类的捕捉配体来代替捕捉配体131以外,以与所述判定部130相同的方式制作,可采用相同的构成。[分析物的测定方法]其次,对使用测试条200所进行的本发明的一实施形态的分析物160的测定方法进行说明。本实施形态的分析物160的测定方法是对试样中所含有的分析物160进行检测或定量的分析物160的测定方法。实施形态的分析物160的测定方法可使用包含薄膜110、及将与分析物160特异地结合的捕捉配体131固定于所述薄膜110上而成的判定部130的测试条200,并包括下述步骤(I)~步骤(III);步骤(I):使试样中所含有的所述分析物160、与利用具有将多个金属粒子20固定于树脂粒子10上而成的结构的树脂-金属复合体100对与所述分析物160特异地结合的抗体进行标记而成的标记抗体150接触的步骤,步骤(II):在判定部130中,使步骤(I)中所形成的含有分析物160与标记抗体150的复合体接触捕捉配体131的步骤,步骤(III):测定源自树脂-金属复合体100的局部型表面等离子体激元共振的显色强度的步骤。步骤(I):步骤(I)是使试样中所含有的分析物160接触标记抗体150的步骤。只要形成含有分析物160与标记抗体150的复合体170,则接触的形态并无特别限定。例如,可向测试条200的试样添加部120或反应部(省略图示)提供试样,并在所述反应部中使分析物160接触标记抗体150,也可在向测试条200提供试样前,使试样中的分析物160接触标记抗体150。步骤(I)中所形成的复合体170在测试条200上展开后移动,并到达判定部130。步骤(II):步骤(II)是在测试条200的判定部130中,使步骤(I)中所形成的含有分析物160与标记抗体150的复合体170接触捕捉配体131。若使复合体170接触捕捉配体131,则捕捉配体131与复合体170的分析物160特异地结合。其结果,复合体170在判定部130中被捕捉。再者,捕捉配体131不与标记抗体150特异地结合,因此当未与分析物160结合的标记抗体150到达判定部130时,所述未与分析物160结合的标记抗体150通过判定部130。此处,当在测试条200中形成有固定有与标记抗体150特异地结合的其他捕捉配体的控制部(省略图示)时,通过了判定部130的标记抗体150继续展开,并在控制部中与所述其他捕捉配体结合。其结果,未与分析物160形成复合体170的标记抗体150在控制部中被捕捉。步骤(II)之后,视需要在步骤(III)之前,例如可实施利用水、生理食盐水、磷酸缓冲液等生化学检査中所通用的缓冲液,对测试条200进行清洗的清洗步骤。利用清洗步骤,可将未在判定部130、或判定部130及控制部中被捕捉的标记抗体150(未与分析物160结合,而未形成复合体170的标记抗体150)去除。通过实施清洗步骤,当在步骤(III)中,测定由判定部130、或判定部130及控制部中的树脂-金属复合体100的局部型表面等离子体激元共振所引起的显色时,可降低背景的显色强度,可提高信号/背景比,并可进一步提升检测感度或定量性。步骤(III):步骤(III)是测定源自树脂-金属复合体100的局部型表面等离子体激元共振的显色强度的步骤。在实施所述步骤(II)或视需要的清洗步骤后,在测试条200中,测定源自树脂-金属复合体100的局部型表面等离子体激元共振的显色强度。再者,当在测试条200中形成有控制部时,利用步骤(II),在控制部中,标记抗体150由其他捕捉配体捕捉而形成复合体。因此,在步骤(III)中,在测试条200中,不仅可在判定部130中产生由局部型表面等离子体激元共振所引起的显色,在控制部中也可产生由局部型表面等离子体激元共振所引起的显色。如此,通过在判定部130与控制部中一同测定显色强度,可确认向测试条200提供的试样是否正常地展开后到达反应部及判定部130。<试样及分析物>本实施形态的分析物的测定方法中的试样只要是包含蛋白质等可成为抗原的物质作为分析物160的,则并无特别限定。例如可列举:含有目标分析物160的生物体试样(即,全血、血清、血浆、尿、唾液、咳痰、鼻腔拭子液或咽拭子液、脊髓液、羊水、乳头分泌液、眼泪、汗、来自皮肤的浸出液、来自组织或细胞及粪便的提取液等)或食品的提取液等。视需要,为了容易产生标记抗体150及捕捉配体131与分析物160的特异的结合反应,也可在所述步骤(I)前,对试样中所含有的分析物160进行前处理。此处,作为前处理,可列举利用酸、碱、表面活性剂等各种化学药品等的化学的处理,或利用加热·搅拌·超声波等的物理的处理。尤其,当分析物160为流感病毒核蛋白(nucleoprotein,NP)抗原等通常未露出至表面的物质时,优选为利用表面活性剂等进行处理。作为用于所述目的的表面活性剂,可考虑特异的结合反应,例如抗原抗体反应等的配体与分析物160的结合反应性,而使用非离子性表面活性剂。另外,所述试样可利用通常的免疫学的分析法中所使用的溶媒(水、生理食盐水、或缓冲液等)或水混合有机溶媒来适宜稀释。作为所述分析物160,例如可列举肿瘤指标物、信号传送物质、激素等的蛋白质(包含多肽、寡肽等)、核酸(包含单链或双链的脱氧核糖核酸(Deoxyribonucleicacid,DNA)、核糖核酸(Ribonucleicacid,RNA)、多核苷酸(polynucleotide)、寡核苷酸、肽核酸(Peptidenucleicacid,PNA)等)或具有核酸的物质、糖(包含寡糖、多糖类、糖链等)或具有糖链的物质、脂质等其他分子,只要是与标记抗体150及捕捉配体131特异地结合的,则并无特别限定,例如可列举:癌胚抗原(Carcino-EmbryonicAntigen,CEA)、HER2蛋白、前列腺特异抗原(ProstateSpecificAntigen,PSA)、CA19-9、α-胎蛋白(α-fetoprotein,AFP)、免疫抑制酸性蛋白(IPA)、CA15-3、CA125、雌激素受体、孕酮受体、粪隐血、肌钙蛋白I、肌钙蛋白T、CK-MB、CRP、人绒毛膜促性腺激素(HumanChorionicGonadotrophin,HCG)、黄体形成激素(LuteinizingHormone,LH)、卵泡刺激激素(FollicleStimulatingHormone,FSH)、梅毒抗体、流感病毒人体血红蛋白、衣原体抗原、A群β溶血性链球菌抗原、HBs抗体、HBs抗原、轮状病毒、腺病毒、白蛋白、糖化白蛋白等。这些之中,优选为利用非离子性表面活性剂而可溶化的抗原,更优选为如病毒的核蛋白质般形成自集合体的抗原。<标记抗体>标记抗体150用于在步骤(I)中,接触试样中所含有的分析物160,而形成含有分析物160与标记抗体150的复合体170。标记抗体150为利用具有将多个金属粒子20固定于树脂粒子10上而成的结构的树脂-金属复合体100对与分析物160特异地结合的抗体进行标记化而成的。此处,所谓“标记化”,是指在步骤(I)~步骤(III)中,以树脂-金属复合体100不自标记抗体150中脱离的程度,通过化学的结合或物理的结合或者吸附等将树脂-金属复合体100直接地或间接地固定于抗体上。例如,标记抗体150可为抗体与树脂-金属复合体100直接结合而成的,也可为抗体与树脂-金属复合体100经由任意的连接分子结合而成的、或分别固定于不溶性粒子上而成的。另外,在本实施形态中,作为“抗体”,并无特别限制,例如除多株抗体、单株抗体、通过基因重组所获得的抗体以外,可使用与抗原具有结合能力的抗体片段[例如H链、L链、Fab、F(ab')2等]等。另外,作为免疫球蛋白,可为IgG、IgM、IgA、IgE、IgD的任一种。作为抗体的产生动物种类,可以人为首、以及人以外的动物(例如小鼠、大鼠、兔子、山羊、马等)。作为抗体的具体例,可列举:抗PSA抗体、抗AFP抗体、抗CEA抗体、抗腺病毒抗体、抗流感病毒抗体、抗HCV抗体、抗IgG抗体、抗人IgE抗体等。<标记抗体的优选的利记博彩app>其次,列举标记抗体150的优选的利记博彩app来进行说明。标记抗体150的制造至少可包含以下的步骤A;步骤A)在第1pH条件下将树脂-金属复合体100与抗体混合来进行结合,由此获得标记抗体150的步骤,优选为进而包含步骤B;步骤B)在第2pH条件下对标记抗体150进行处理的步骤。[步骤A]在步骤A中,在第1pH条件下将树脂-金属复合体100与抗体混合而获得标记抗体150。步骤A优选为使固体状的树脂-金属复合体100以分散于液相中的状态与抗体接触。第1pH条件根据树脂-金属复合体100中的金属粒子20的金属种类而不同。当树脂-金属复合体100的金属粒子20为金粒子(包含金合金粒子;以下相同)时,就在与抗体的结合维持树脂-金属复合体100的分散与抗体的活性的状态下,使树脂-金属复合体100与抗体均匀地接触的观点而言,第1pH条件优选为pH为2~7的范围内的条件,进而更优选为酸性条件,例如pH为2.5~5.5的范围内。当金属粒子20为金粒子时,若使树脂-金属复合体100与抗体结合时的条件为pH未满2,则存在因强酸性而导致抗体变质并失活的情况,若pH超过7,则当将树脂-金属复合体100与抗体混合时凝聚而难以分散。但是,当不会因强酸性而导致抗体失活时,即便pH未满2,也可进行处理。另外,当树脂-金属复合体100的金属粒子20为金以外的粒子,例如钯粒子、或这些的合金等时,就在与抗体的结合维持树脂-金属复合体100的分散与抗体的活性的状态下,使树脂-金属复合体100与抗体均匀地接触的观点而言,第1pH条件优选为pH为2~10的范围内的条件,更优选为例如pH为5~9的范围内。当金属粒子20为金以外的粒子时,若使树脂-金属复合体100与抗体结合时的条件为pH未满2,则存在因强酸性而导致抗体变质并失活的情况,若pH超过10,则当将树脂-金属复合体100与抗体混合时凝聚而难以分散。但是,当不会因强酸性而导致抗体失活时,即便pH未满2,也可进行处理。步骤A优选为在调整成第1pH条件的结合用缓冲液(BindingBuffer)中进行。例如,在调整成所述pH的结合用缓冲液中混合规定量的树脂-金属复合体100,并充分地进行混合。作为结合用缓冲液,例如可使用调整成规定浓度的硼酸溶液等。结合用缓冲液的pH的调整例如可使用盐酸、氢氧化钠等来进行。继而,向所获得的混合液中添加规定量的抗体,并充分地进行搅拌、混合,由此可获得标记抗体含有液。以所述方式获得的标记抗体含有液例如可利用离心分离等固液分离方法,仅分离取出作为固体部分的标记抗体150。[步骤B]在步骤B中,在第2pH条件下对步骤A中所获得的标记抗体150进行处理,由此进行抑制对于标记抗体150的非特异的吸附的阻隔。在此情况下,在第2pH条件下,使利用固液分离方法而分离取出的标记抗体150分散于液相中。所述阻隔的条件根据树脂-金属复合体100中的金属粒子20的金属种类而不同。当树脂-金属复合体100的金属粒子20为金粒子时,就保持抗体的活性且抑制标记抗体150的凝聚的观点而言,第2pH条件例如优选为pH为2~9的范围内,进而,就抑制标记抗体150的非特异的吸附的观点而言,更优选为酸性条件,例如pH为2~6的范围内。若阻隔的条件为pH未满2,则存在因强酸性而导致抗体变质并失活的情况,若pH超过9,则标记抗体150凝聚而难以分散。另外,当树脂-金属复合体100的金属粒子20为金以外的粒子时,就保持抗体的活性且抑制标记抗体150的凝聚的观点而言,第2pH条件例如优选为pH为2~10的范围内,就抑制标记抗体150的非特异的吸附的观点而言,更优选为pH为5~9的范围内。若阻隔的条件为pH未满2,则存在因强酸性而导致抗体变质并失活的情况,若pH超过10,则标记抗体150凝聚而难以分散。步骤B优选为使用调整成第2pH条件的阻隔用缓冲液(BlockingBuffer)来进行。例如,向规定量的标记抗体150中添加调整成所述pH的阻隔用缓冲液,并使标记抗体150均匀地分散于阻隔用缓冲液中。作为阻隔用缓冲液,例如优选为使用不与被检测物结合的蛋白质的溶液。作为可用于阻隔用缓冲液的蛋白质,例如可列举:牛血清白蛋白、卵白蛋白、酪蛋白、明胶等。更具体而言,优选为使用调整成规定浓度的牛血清白蛋白溶液等。阻隔用缓冲液的pH的调整例如可使用盐酸、氢氧化钠等来进行。标记抗体150的分散例如优选为使用超声波处理等分散方法。以所述方式获得均匀分散有标记抗体150的分散液。以所述方式,可获得标记抗体150的分散液。自所述分散液中,例如可利用离心分离等固液分离方法,仅分离取出作为固体部分的标记抗体150。另外,视需要可实施清洗处理、保存处理等。以下,对清洗处理、保存处理进行说明。(清洗处理)清洗处理是向利用固液分离方法而分离取出的标记抗体150中添加清洗用缓冲液,并使标记抗体150均匀地分散于清洗用缓冲液中。分散例如优选为使用超声波处理等分散方法。作为清洗用缓冲液,并无特别限定,例如可使用调整成pH为8~9的范围内的规定浓度的三羟甲基氨基甲烷缓冲液(Trisbuffer)、甘胺酰胺缓冲液(Glycineamidebuffer)、精胺酸缓冲液(Argininebuffer)等。清洗用缓冲液的pH的调整例如可使用盐酸、氢氧化钠等来进行。标记抗体150的清洗处理视需要可重复进行多次。(保存处理)保存处理是向利用固液分离方法而分离取出的标记抗体150中添加保存用缓冲液,并使标记抗体150均匀地分散于保存用缓冲液中。分散例如优选为使用超声波处理等分散方法。作为保存用缓冲液,例如可使用向清洗用缓冲液中添加规定浓度的抗凝聚剂及/或稳定剂而成的溶液等。作为抗凝聚剂,例如可使用:以蔗糖、麦芽糖、乳糖、海藻糖为代表的糖类,或以甘油、聚乙烯醇为代表的多元醇等。作为稳定剂,并无特别限定,例如可使用:牛血清白蛋白、卵白蛋白、酪蛋白、明胶等蛋白质。能够以所述方式进行标记抗体150的保存处理。在以上的各步骤中,视需要可进而使用表面活性剂,或叠氮化钠、对羟基苯甲酸酯等防腐剂。[分析物检测·定量套组]本发明的一实施形态的分析物测定用套组是使用例如侧流型色谱用测试条200,根据本实施形态的分析物的测定方法,用以对试样中所含有的分析物160进行检测或定量的套组。本实施形态的套组包括:侧流型色谱用测试条200,包含薄膜110、及将与所述分析物160特异地结合的捕捉配体固定于薄膜110上而成的判定部130;以及检测试药,包含利用具有将多个金属粒子20固定于树脂粒子10上而成的结构的树脂-金属复合体100对与分析物160特异地结合的抗体进行标记而成的标记抗体150。本实施形态的套组视需要可进而包含其他构成要素。在使用本发明的套组时,可在使试样中的分析物160与检测试药中的标记抗体150接触来实施步骤(I)后,向测试条200的反应部或试样添加部120中提供试样,然后依次实施步骤(II)、步骤(III)。或者,也可将检测试药涂布于比测试条200的判定部130更上游侧,适宜进行干燥而形成反应部后,向所形成的反应部或比所述反应部更上游侧的位置(例如试样添加部120)添加试样,然后依次实施步骤(I)~步骤(III)。实施例其次,通过实施例来具体地说明本发明,但本发明不受这些实施例任何限定。在以下的实施例、比较例中,只要事先无特别说明,则各种测定、评价为利用下述方式的。<树脂-金属复合体的吸光度测定>关于树脂-金属复合体的吸光度,向光学用白板玻璃制单元(光程长度为10mm)中加入制备成0.01wt%的树脂-金属复合体分散液(分散介质:水),使用瞬间多重测光系统(multi-meteringsystem)(大冢电子公司制造,MCPD-3700),在金的情况下测定570nm的吸光度。在金的情况下,将570nm中的吸光度为0.9以上设为○(良好),将0.5~未满0.9设为△(可),将未满0.5设为×(不可)。<固体成分浓度测定及金属承载量的测定>向磁制坩埚中加入浓度调整前的分散液1g,并在70℃下进行3小时热处理。测定热处理前后的重量,并利用下述式来算出固体成分浓度。固体成分浓度(wt%)=[干燥后的重量(g)/干燥前的重量(g)]×100另外,在500℃下,对所述热处理后的样品进而进行5小时加热处理,测定加热处理前后的重量,并利用下述式来算出金属承载量。金属承载量(wt%)=[500℃加热处理后的重量(g)/500℃加热处理前的重量(g)]×100<树脂粒子及树脂-金属复合体的平均粒径的测定>使用圆盘离心式粒度分布测定装置(CPS圆盘式离心机(DiscCentrifuge)DC24000UHR,CPS仪器有限(CPSinstruments,Inc.)公司制造)进行测定。测定是在使树脂-金属复合体分散于水中的状态下进行。<利用免疫色谱法的评价>使用各实施例等中所制作的树脂-金属复合体标记抗体分散液,进行下述所示的利用免疫色谱法的测定,并评价树脂-金属复合体分散液的性能。(评价方法)评价是使用流感A型评价用单色屏幕(爱德泰克(Adtec)公司制造),比较5分钟后、10分钟后、15分钟后的显色水平。在性能评价中,抗原使用流感A型阳性对照(APC)的2倍稀释列(1倍~1024倍)(APC稀释前的病毒的浓度为5000FFU/ml)。(评价程序)向96孔盘的各孔中各加入3μl树脂-金属复合体标记抗体分散液,并混合APC的2倍稀释列(1倍~1024倍)及阴性对照各100μl。继而,向流感A型评价用单色屏幕中添加50μl,并评价5分钟后、10分钟后、15分钟后的显色水平。显色水平使用胶体金判定用颜色样本(爱德泰克公司制造)进行判定。<金属粒子的平均粒径的测定>金属粒子的平均粒径的测定是根据利用场发射扫描型电子显微镜(STEM;日立先端科技(HitachiHigh-Technologies)公司制造,SU-9000)观测朝带有碳支撑膜的金属性网眼滴加树脂-金属复合体分散液所制作的基板的图像,测定金属粒子的面积平均径。[实施例1]<树脂粒子的合成>使爱丽库特(Aliquat)336[奥德里奇(Aldrich)公司制造](1.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,2.00g)溶解于80g的纯水中后,添加2-乙烯基吡啶(2-VP,9.90g)及二乙烯基苯(DVB,0.100g),在氮气气流下,以250rpm、60℃搅拌30分钟。搅拌后,历时5分钟滴加溶解于9.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.100g),以250rpm、60℃搅拌6小时,由此获得平均粒径为0.45μm的树脂粒子。利用离心分离(9000rpm,10分钟)来使所述树脂粒子沉淀,去除上清液后,再次分散于纯水中,而获得10wt%的树脂粒子分散液。<树脂-金属复合体的合成>向所述树脂粒子分散液(3.05g)中添加30mM氯金酸水溶液(80g),并在室温下放置24小时。其后,利用离心分离(3000rpm,10分钟)来使树脂粒子沉淀,并去除上清液,由此去除多余的氯金酸后,再次分散于55g的纯水中,而制备金离子吸附树脂粒子分散液。历时8分钟将所述金离子吸附树脂粒子分散液45g)滴加至10mM的二甲基胺硼烷水溶液(450ml)中后,在室温下搅拌2小时,由此获得平均粒径为0.6μm的树脂-金复合体。利用离心分离(3000rpm,120分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于37g的纯水中,并利用超滤膜来进行精制,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所述树脂-金复合体分散液中的树脂-金复合体的吸光度的结果为1.20。另外,树脂-金复合体中的金粒子的平均粒径为22.0nm,金的承载量为49.4wt%。将所制作的树脂-金复合体的扫描型电子显微镜(SEM)照片示于图3。[实施例2]除向实施例1中所获得的树脂粒子分散液(3.05g)中添加10mM的氯金酸水溶液(56g)以外,以与实施例1相同的方法获得金离子吸附树脂粒子分散液、平均粒径为0.6μm的树脂-金复合体及1wt%的树脂-金复合体分散液。所述树脂-金复合体分散液中的树脂-金复合体的吸光度为1.04。另外,树脂-金复合体中的金粒子的平均粒径为7.61nm,金的承载量为36.8wt%。[实施例3]<树脂粒子的合成>将2-VP(9.90g)及DVB(0.100g)添加至450g的纯水中,在氮气气流下,以250rpm、60℃搅拌30分钟。搅拌30分钟后,历时5分钟滴加溶解于9.00g的纯水中的AIBA(0.100g),以250rpm搅拌6小时,由此获得平均粒径为0.10μm的树脂粒子。利用离心分离(9000rpm,20分钟)来使所述树脂粒子沉淀,去除上清液后,再次分散于纯水中,而获得10wt%的树脂粒子分散液。<树脂-金属复合体的合成>向树脂粒子分散液(5.0g)中添加30mM的氯金酸水溶液(198g),并在室温下放置24小时。其后,利用离心分离(3000rpm,10分钟)来使树脂粒子沉淀,并去除上清液,由此去除多余的氯金酸后,再次分散于1.5g的纯水中,而制备金离子吸附树脂粒子分散液。历时2分钟将所述金离子吸附树脂粒子分散液(1.5g)滴加至10mM的二甲基胺硼烷水溶液(65ml)中后,在室温下搅拌2小时,由此获得平均粒径为0.22μm的树脂-金复合体。向所述树脂-金复合体中添加10wt%的分散剂(BYK194)600μl并搅拌1小时后,利用离心分离(9000rpm,10分钟)来进行沉淀,并去除上清液。其后,添加适量的纯水再次进行分散,并利用超滤膜来进行精制,而获得1wt%的树脂-金复合体分散液。所述树脂-金复合体分散液中的树脂-金复合体的吸光度为1.12。另外,树脂-金复合体中的金粒子的平均粒径为22.6nm,金的承载量为37.0wt%。[比较例1]<免疫色谱的评价>在着色乳胶(默克密理博(MerckMillipore)公司制造,着色爱斯塔波(Estapor)功能性粒子,K1030,平均粒径为:392nm,570nm中的吸光度为0.83,400nm中的吸光度为1.11)1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使着色乳胶与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔着色乳胶。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作着色乳胶标记抗体。使用所制作的着色乳胶标记抗体,进行下述所示的利用免疫色谱法的测定,并评价着色乳胶的性能。(评价方法)评价是使用流感A型评价用单色屏幕(爱德泰克公司制造),比较5分钟后、10分钟后、15分钟后的显色水平。在性能评价中,抗原使用流感A型阳性对照(APC)的2倍稀释列(1倍~1024倍)(APC稀释前的病毒的浓度为5000FFU/ml)。(评价程序)向96孔盘的各孔中各加入3μl着色乳胶标记抗体,并混合APC的2倍稀释列(1倍~1024倍)及阴性对照各100μl。继而,向流感A型评价用单色屏幕中添加50μl,并评价5分钟后、10分钟后、15分钟后的显色水平。以下表示其结果。根据所述表1A,确认着色乳胶标记抗体对于16倍稀释的抗原显示出良好的显色。将以上的实施例及比较例的吸光度的结果汇总并示于表1B中。[表1B]实施例1实施例2实施例3比较例1570nm中的吸光度1.201.041.120.83评价○○○△[比较例2]<胶体金的合成>向500ml三口圆底烧瓶中加入1mM氯金酸水溶液250ml,使用加热回流装置,一面激烈地搅拌一面使其沸腾,沸腾后添加38.8mM柠檬酸钠水溶液25ml,并确认溶液自淡黄色变化成深红色。一面进行搅拌一面继续加热10分钟后,在室温下进行30分钟左右的搅拌并放置冷却。使用孔径为2μm的薄膜过滤器对溶液进行过滤,移至三角烧瓶中并在阴凉处保存。所制作的粒子的平均粒径为12.3nm。<免疫色谱的评价>在所获得的胶体金1ml(OD=10)中混合流感抗体100μg,并在室温下搅拌约3小时来使胶体金与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔胶体金表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作胶体金标记抗体。使用所制作的胶体金标记抗体,进行下述所示的利用免疫色谱法的测定,并评价胶体金的性能。(评价方法)评价是使用流感A型评价用单色屏幕(爱德泰克公司制造),比较5分钟后、10分钟后、15分钟后的显色水平。在性能评价中,抗原使用流感A型阳性对照(APC)的2倍稀释列(1倍~1024倍)(APC稀释前的病毒的浓度为5000FFU/ml)。(评价程序)向96孔盘的各孔中各加入3μl胶体金标记抗体,并混合APC的2倍稀释列(1倍~1024倍)及阴性对照各100μl。继而,向流感A型评价用单色屏幕中添加50μl,并评价5分钟后、10分钟后、15分钟后的显色水平。以下表示其结果。根据所述表2,确认胶体金标记抗体对于32倍稀释的抗原显示出良好的显色。[比较例3]<树脂粒子的合成>使爱丽库特(Aliquat)336[奥德里奇公司制造](5.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于389.5g的纯水中后,添加2-乙烯基吡啶(2-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于50.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为200nm的树脂粒子。利用离心分离(9000rpm,60分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(beads)(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、20℃进行搅拌,一面历时4分钟滴加528mM的二甲基胺硼烷水溶液(10ml)与528mM的硼酸水溶液(10ml)的混合溶液后,在室温下搅拌2小时,由此获得平均粒径为250nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为1.69。另外,所形成的金粒子的平均粒径为75.0nm,金的承载量为52.3wt%。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000pm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合体标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表3,确认树脂-金复合体标记抗体对于16倍稀释的抗原显示出良好的显色。[实施例4]使爱丽库特(Aliquat)336[奥德里奇公司制造](1.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加2-乙烯基吡啶(2-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时0.5分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为500nm的树脂粒子。利用离心分离(9000rpm,40分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、20℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为510nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为1.01。另外,所形成的金粒子的平均粒径为46.3nm,金的承载量为54.2wt%。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表4,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。[实施例5]使爱丽库特(Aliquat)336[奥德里奇公司制造](0.50g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加2-乙烯基吡啶(2-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时0.5分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为613nm的树脂粒子。利用离心分离(9000rpm,40分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、3℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为625nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为0.98。另外,所形成的金粒子的平均粒径为25.0nm,金的承载量为55.3wt%。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表5,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。[实施例6]使爱丽库特(Aliquat)336[奥德里奇公司制造](1.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加4-乙烯基吡啶(4-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为438nm的树脂粒子。利用离心分离(9000rpm,45分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、3℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为448nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为0.99。另外,所形成的金粒子的平均粒径为24.0nm,金的承载量为55.7wt%。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表6,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。[实施例7]使爱丽库特(Aliquat)336[奥德里奇公司制造](1.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加3-乙烯基吡啶(3-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为429nm的树脂粒子。利用离心分离(9000rpm,45分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、3℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为436nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为1.03。另外,所形成的金粒子的平均粒径为24.3nm,金的承载量为55.5wt%。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表7,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。[实施例8]使甲基丙烯酸2-(二异丙基氨基)乙酯(DPA,10.3g)、聚(丙二醇)二丙烯酸酯(0.2g)与聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,2.0g)溶解于85g的纯水中后,在氮气气流下,以150rpm、30℃搅拌50分钟,继而在70℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于2.00g的纯水中的过氧二硫酸铵(ASP,0.10g),以150rpm、70℃搅拌3.5小时,由此获得平均粒径为338nm的树脂粒子。利用离心分离(9000rpm,45分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、3℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为345nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为0.96。另外,所形成的金粒子的平均粒径为24.6nm,金的承载量为48.5wt%。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表8,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。[实施例9]<树脂粒子的合成>使爱丽库特(Aliquat)336[奥德里奇公司制造](3.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加2-乙烯基吡啶(2-VP,49.50g)及二乙烯基苯(DVB,0.50g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.250g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为370nm的树脂粒子。利用离心分离(9000rpm,60分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、20℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为393nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为0.92。另外,所形成的金粒子的平均粒径为14.9nm,金的承载量为55.8wt%。将所获得的树脂-金复合体的表面的扫描型电子显微镜(SEM)照片示于图4,将其剖面的扫描型透射电子显微镜(STEM)照片示于图5。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合体标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表9,确认树脂-金复合体标记抗体对于64倍稀释的抗原显示出良好的显色。[实施例10]<树脂粒子的合成>使爱丽库特(Aliquat)336[奥德里奇公司制造](2.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,10.00g)溶解于300g的纯水中后,添加2-乙烯基吡啶(2-VP,48.00g)及二乙烯基苯(DVB,2.00g),在氮气气流下,以150rpm、30℃搅拌50分钟,继而在60℃下搅拌30分钟。搅拌后,历时2分钟滴加溶解于18.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.500g),以150rpm、60℃搅拌3.5小时,由此获得平均粒径为380nm的树脂粒子。利用离心分离(9000rpm,60分钟)来进行沉淀,去除上清液后,再次分散于纯水中,将所述操作进行3次后,利用透析处理来去除杂质。其后,进行浓度调整而获得10wt%的树脂粒子分散液。向所述树脂粒(50ml)中添加纯水1233ml后,添加30mM氯金酸水溶液(100ml),并在室温下放置24小时。其后,利用离心分离(3100rpm,30分钟)来使树脂粒子沉淀,并去除上清液,将所述作业重复3次,由此去除多余的氯金酸。其后,进行浓度调整,而制备2.5wt%金离子吸附树脂粒子分散液。继而,向纯水1580ml中添加所述2.5wt%金离子吸附树脂粒子分散液(42.4ml),一面以160rpm、20℃进行搅拌,一面历时2分钟滴加528mM的二甲基胺硼烷水溶液(10ml)后,在室温下搅拌2小时,由此获得平均粒径为399nm的树脂-金复合体。利用离心分离(3100rpm,60分钟)来使所述树脂-金复合体沉淀,去除上清液后,再次分散于纯水中,将所述作业重复3次后,利用透析处理来进行精制、浓度调整,由此获得1wt%的树脂-金复合体分散液。根据所述方法测定所制作的树脂-金复合体的吸光度的结果为0.96。另外,所形成的金粒子的平均粒径为25.0nm,金的承载量为53.2wt%。将所获得的树脂-金复合体的表面的扫描型电子显微镜(SEM)照片示于图6,将其剖面的扫描型透射电子显微镜(STEM)照片示于图7。在所述树脂-金复合体中,金粒子包括完全地内包于树脂粒子中的内包金粒子、具有包埋于树脂粒子内的部位及朝树脂粒子外露出的部位的部分露出金粒子、及吸附于树脂粒子的表面的表面吸附金粒子,且至少一部分的金粒子三维地分布于树脂粒子的表层部。<免疫色谱的评价>在所获得的树脂-金复合体分散液1ml(0.1wt%)中混合流感抗体100μg,并在室温下搅拌约3小时来使树脂-金复合体与抗体结合。以最终浓度变成1%的方式添加牛血清白蛋白溶液,并在室温下搅拌2小时来阻隔树脂-金复合体表面。以12000rpm、4℃进行5分钟离心分离后回收,并悬浮于含有0.2%牛血清白蛋白的缓冲液中来制作树脂-金复合体标记抗体分散液。使用所制作的树脂-金复合体标记抗体分散液,进行利用免疫色谱法的测定,并评价所述树脂-金复合体分散液的性能。以下表示其结果。根据所述表10,确认树脂-金复合体标记抗体对于256倍稀释的抗原显示出良好的显色。若比较实施例9的图5与实施例10的图7的剖面图像,则金粒子的60%~100%、优选为75%~100%存在于自树脂粒子的表面起在深度方向上为粒子半径的50%的范围内的实施例10的免疫色谱的检测感度更优异。[关于标记抗体的制作的试验例][制作例1]<树脂粒子的合成>使爱丽库特(Aliquat)336[奥德里奇公司制造](1.00g)及聚乙二醇甲基乙基醚甲基丙烯酸酯(PEGMA,2.00g)溶解于80g的纯水中后,添加2-乙烯基吡啶(2-VP,9.90g)及二乙烯基苯(DVB,0.100g),在氮气气流下,以250rpm、60℃搅拌30分钟。搅拌后,历时5分钟滴加溶解于9.00g的纯水中的2,2-偶氮双(2-甲基丙脒)二盐酸盐(AIBA,0.100g),以250rpm、60℃搅拌6小时,由此获得平均粒径为0.36μm的树脂粒子A-1。利用离心分离(9000rpm,10分钟)来使所述A-1进行沉淀,去除上清液后,再次分散于纯水中,而获得2.1wt%的树脂粒子分散液B-1。<树脂-金复合体的合成>向所述B-1(19.09g)中添加30mM氯金酸水溶液(106.6g),并在室温下放置24小时。其后,利用离心分离(3000rpm,10分钟)来使树脂粒子沉淀,并去除上清液,由此去除多余的氯金酸后,再次分散于40g的纯水中,而制备金离子吸附树脂粒子分散液C-1。历时4分钟将所述C-1(20g)滴加至3.3mM的二甲基胺硼烷水溶液(600ml)中后,在8℃下搅拌1小时,进而在室温下搅拌5小时,由此获得平均粒径为0.38μm的树脂-金复合体D-1。利用离心分离(3000rpm,120分钟)来使所述D-1沉淀,去除上清液后,添加适量的纯水来再次进行分散,然后利用超滤膜来进行精制,由此获得1wt%的树脂-金复合体分散液E-1。根据所述方法测定E-1中的树脂-金复合体F-1的吸光度的结果为1.0。另外,F-1中的金粒子的平均粒径为22.0nm,金的承载量为49.1wt%。[试药等]在试验例、参考试验例中使用以下的试药等。抗流感A型单株抗体(7.15mg/mL/PBS):爱德泰克股份有限公司制造。结合用缓冲液a:100mM利用HCl将硼酸溶液调整成pH≒3。结合用缓冲液b:100mM利用HCl将硼酸溶液调整成pH≒4。结合用缓冲液c:100mM利用HCl将硼酸溶液调整成pH≒5。结合用缓冲液d:100mM硼酸溶液pH≒6.5。结合用缓冲液e:100mM利用NaCl将硼酸溶液调整成pH≒7.5。结合用缓冲液f:100mM利用NaCl将硼酸溶液调整成pH≒8.5。结合用缓冲液g:50mM2-吗啉基乙磺酸溶液pH≒3.8。阻隔用缓冲液a:利用HCl将1wt%牛血清白蛋白溶液调整成pH≒5。阻隔用缓冲液b:利用HCl将1wt%牛血清白蛋白溶液调整成pH≒7。阻隔用缓冲液c:利用HCl将1wt%牛血清白蛋白溶液调整成pH≒8.5。阻隔用缓冲液d:利用HCl将1wt%牛血清白蛋白溶液调整成pH≒9.5。清洗用缓冲液:利用HCl将5mM三羟甲基氨基甲烷溶液调整成pH≒8.5。保存用缓冲液:以变成10wt%浓度的方式将蔗糖添加至清洗用缓冲液中。流感A型阳性对照(APC):使用检体处理液(爱德泰克股份有限公司制造)对流感A型病毒钝化抗原(爱德泰克股份有限公司制造)进行100倍稀释来制备。APC的抗原浓度相当于5000FFU/ml。阴性对照:检体处理液(爱德泰克股份有限公司制造)。AuNCP粒:制作例1中所获得的树脂-金复合体(1wt%;平均粒径为380nm)。[试验例1](结合步骤)向微型管[IBIS(注册商标;亚速旺(ASONE)公司制造)2mL]中投入作为树脂-金属复合体的AuNCP粒0.1mL,并添加0.9mL的结合用缓冲液a。利用颠倒混合而充分地混合后,添加抗流感A型单株抗体100μg,并在室温下历时3小时进行颠倒搅拌,而获得含有利用树脂-金属复合体进行了标记的抗流感A型单株抗体的标记抗体含有液A-1。(阻隔步骤)继而,对标记抗体含有液A-1进行冰浴冷却后,历时5分钟以12000rpm进行离心分离,去除上清液后,向固体成分残渣中添加1mL的阻隔用缓冲液a,历时10秒~20秒进行超声波分散处理,进而,在室温下历时2小时进行颠倒搅拌,而获得标记抗体含有液B-1。(清洗处理)继而,对标记抗体含有液B-1进行冰浴冷却后,历时5分钟以12000rpm进行离心分离,去除上清液后,向固体成分残渣中添加清洗用缓冲液1mL,历时10秒~20秒进行超声波分散处理。将所述操作重复3次来作为清洗处理。(保存处理)继而,在冰浴冷却后,历时5分钟以12000rpm进行离心分离,去除上清液后,向固体成分残渣中添加保存用缓冲液1mL,历时10秒~20秒进行超声波分散处理,由此获得标记抗体含有液C-1。[试验例2]在试验例1的结合步骤中使用结合用缓冲液b来代替结合用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液A-2、标记抗体含有液B-2、标记抗体含有液C-2。[试验例3]在试验例1的结合步骤中使用结合用缓冲液c来代替结合用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液A-3、标记抗体含有液B-3、标记抗体含有液C-3。[试验例4]在试验例1的结合步骤中使用结合用缓冲液d来代替结合用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液A-4、标记抗体含有液B-4、标记抗体含有液C-4。[参考试验例1]当在试验例1的结合步骤中使用结合用缓冲液e来代替结合用缓冲液a时,树脂-金属复合体凝聚,因此难以获得标记抗体含有液。[参考试验例2]当在试验例1的结合步骤中使用结合用缓冲液f来代替结合用缓冲液a时,树脂-金属复合体凝聚,因此难以获得标记抗体含有液。[试验例5]在试验例1的阻隔步骤中使用阻隔用缓冲液b来代替阻隔用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液B-5、标记抗体含有液C-5。[试验例6]在试验例1的阻隔步骤中使用阻隔用缓冲液c来代替阻隔用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液B-6、标记抗体含有液C-6。[参考试验例3]在试验例1的阻隔步骤中使用阻隔用缓冲液d来代替阻隔用缓冲液a的结果,结合步骤后的标记抗体显示出良好的分散性,但在阻隔步骤后标记抗体凝聚,难以获得标记抗体含有液。[试验例7]在试验例1的结合步骤中使用结合用缓冲液g来代替结合用缓冲液a,除此以外,以与试验例1相同的方式获得标记抗体含有液A-7、标记抗体含有液B-7、标记抗体含有液C-7。<评价方法>评价是使用流感A型评价用单色屏幕(爱德泰克公司制造),比较5分钟后、10分钟后、15分钟后的显色水平。显色水平使用胶体金判定用颜色样本(爱德泰克公司制造)进行判定。在筛选评价中,抗原使用流感A型阳性对照(APC)。在性能评价中,抗原使用APC的2倍稀释列(1倍~1024倍稀释)。<筛选评价>向96孔盘的7个孔中各加入3μL试验例1~试验例7中所获得的标记抗体含有液C-1~标记抗体含有液C-7,并在各孔中混合APC100μL。继而,向流感A型评价用单色屏幕中各添加50μL,并评价5分钟后、10分钟后、15分钟后的显色水平。将其结果示于表11。再者,表11中的数值越大,表示显色水平越高(显色越强)。[表11]根据表11,确认试验例1中所获得的抗体标记含有液C-1显示出最强的显色,具有优异的标记性能。<性能评价>向96孔盘的12个孔中各加入3μL试验例1中所获得的标记抗体含有液C-1,并混合APC的2倍稀释列(1倍~1024倍稀释,分别表示为APC×1~APC×1024)及阴性对照各100μL。继而,向流感A型评价用单色屏幕中添加50μL,并评价5分钟后、10分钟后、15分钟后的显色水平。将其结果示于表12。再者,表12中的数值越大,表示显色水平越高(显色越强)。根据表12,确认试验例1中所获得的标记抗体含有液C-1对于256倍稀释的抗原也显示出良好的显色,具有优异的标记性能。以上,以例示的目的对本发明的实施形态进行了详细说明,但本发明并不受所述实施形态限制。本国际申请主张基于2014年7月1日所申请的日本专利特愿2014-136356号、及2014年7月1日所申请的日本专利特愿2014-136357号的优先权,并将所述申请的所有内容引用于本发明中。[符号的说明]10:树脂粒子20:金属粒子30:内包金属粒子40:部分露出金属粒子50:表面吸附金属粒子60:表层部100:树脂-金属复合体110:薄膜120:试样添加部130:判定部131:捕捉配体140:吸液部150:标记抗体160:分析物170:复合体200:测试条当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1