一种无标记神经降压素受体(NTSR)配体筛选模型的利记博彩app
本发明涉及无标记GPCR配体筛选模型的建立,具体地说是一种无标记神经降压素受体(NTSR)配体筛选模型。所述GPCR为NTSR;所述方法为无标记细胞整合药理学技术;所述应用为NTSR配体的筛选,以及与NTSR相关的心血管疾病、高血压、肺癌、前列腺癌、乳腺癌、结肠癌以及胰腺癌等疾病的预防和治疗。
背景技术:
神经降压素受体(neurotensin receptor,NTSR)是神经降压素(neurotensin,NTS)的特异性受体,是G蛋白偶联受体(G protein-coupled receptors,GPCRs)家族成员中的一种,在中枢神经系统主要分布在大脑内侧隔核、斜角带布神经元、前脑基底核、脑黑质、海马和下丘脑核等区域,在外周组织主要分布在胃肠道等组织。NT与NTSR具有使血管扩张、降血压、调节多巴胺神经传导、减弱脑部神经活动、调节情绪、刺激垂体腺分泌激素、刺激胆囊分泌胆汁、抑制小肠和胃的蠕动、刺激胰腺分泌胰液、刺激结肠运动、以及对胃肠道等许多组织的营养与修复作用的生理功能。NTS及NTSR能刺激多种正常的组织及细胞生长、增殖。但是研究发现在胰腺癌、乳腺癌、前列腺癌、肺癌以及胃癌等癌细胞中发现了NTSR高表达。因此寻找发现针对NTSR的高活性特异性激动剂和拮抗剂是非常必要的(Carraway R,Leeman S E.Isolation of a New Hypotensive Peptide,Neurotensin,from Bovine Hypothalami.Journal of Biological Chemistry,1973,248(19):6854-6861;Vincent J P,Mazella J,Kitabgi P.Neurotensin and neurotensin receptors.Trends in pharmacological sciences,1999,20(7):302-309;Popp E,Schneider A,Vogel P,et al.Time course of the hypothermic response to continuously administered neurotensin.Neuropeptides,2007,41(5):349-354;St-Gelais F,Jomphe C,Trudeau L E.The role of neurotensin in central nervous system pathophysiology:What is the evidence?J PsychiatrNeurosci,2006,31(4):229-245;Mustain W C,Rychahou P G,Evers B M.The role of neurotensin in physiologic and pathologic processes.CurrOpinEndocrinol,2011,18(1):75-82)。
目前NTSR配体的筛选主要是采用荧光标记、酶联免疫法、荧光标记和荧光成像读板仪等法(Fluorescence Image Plate Reader,FLIPR)等传统方法。但是这些方法都有缺点或自身局限性,例如反射自显影技术有操作复杂、通量低等缺点;荧光标记方法有需要特定的荧光、操作繁琐、灵敏度低以及无法实现高通量等缺点;酶联免疫法有操作繁琐、实验周期长、灵敏度低及低通量等特点;FLIPR是唯一一个能实现高通量、快速筛选配体的检测技术,但是其具有只能针对钙流及 膜电位检测的局限性,无法直接针对受体,也不能进行通路研究。而本模型采用的方法为最新的无标记细胞整合药理学(cellular label-free integrative pharmacology,CLIP)技术是采用光学感应技术对细胞内质量发生重置的过程通过光波长的位移来反应细胞内受体信号传导的技术,具有无伤害、高灵敏度、高通量、能多靶点多通路研究、实验周期短以及操作简单等特点。因此,采用CLIP技术建立NTSR无标记配体筛选模型可以大大提高NTSR配体筛选的效率,对于阐述NTS和NTSR的药理学和生理学功能具有重要意义,为与NTSR相关的疾病的靶向治疗提供指导(Botto J M,Guillemare E,Vincent J P,et al.Effects of SR 48692 on neurotensin-induced calcium-activated chloride currents in the Xenopus oocyte expression system:Agonist-like activity on the levocabastine-sensitive neurotensin receptor and absence of antagonist effect on the levocabastine insensitive neurotensin receptor.Neurosci Lett,1997,223(3):193-196;Martin S,Navarro V,Vincent J P,et al.Neurotensin receptor-1and-3complex modulates the cellular signaling of neurotensin in the HT29 cell line.Gastroenterology,2002,123(4):1135-1143;
Sehgal I,Powers S,Huntley B,et al.Neurotensin Is an Autocrine Trophic Factor-Stimulated by Androgen Withdrawal in Human Prostate-Cancer.P NatlAcadSci USA,1994,91(11):4673-4677;Seethalakshmi L,Mitra S P,Dobner P R,et al.Neurotensin receptor expression in prostate cancer cell line and growth effect of NT at physiological concentrations.Prostate,1997,31(3):183-192;Fang Y.Non-invasive optical biosensor for probing cell signaling.Sensors-Basel,2007,7(10):2316-2329;Fang Y,Frutos A G,Verklereen R.Label-free cell-based assays for GPCR screening.Comb Chem High T Scr,2008,11(5):357-369;Fang Y,Ferrie A M,Fontaine N H,et al.Characteristics of dynamic mass redistribution of epidermal growth factor receptor signaling in living cells measured with label-free optical biosensors.Analytical chemistry,2005,77(17):5720-5725)。
目前关于采用无标记细胞整合药理学技术的NTSR配体筛选模型的内容尚未报道。
技术实现要素:
本发明涉及GPCR中的NTSR无标记配体筛选模型的建立及其应用,目的之一是采用无标记细胞整合药理学技术建立NTSR无标记配体筛选模型;目的之二是NTSR配体筛选模型的建立可为与这些疾病相关的靶点提供高活性的配体,为其他受体的配体的筛选提供参照,为与NTSR相关的疾病的靶向治疗提供指导。
本发明的技术方案为:
在接种了HT29细胞的细胞培养板中陆续加入待测样品和神经降压素(NTS),若在HT29细胞上NTS产生的DMR谱的强度随待测样品浓 度的增加而减少,则表明样品可使NTS脱敏,可判断样品具有NTSR的激动或者拮抗活性。
所述细胞培养板为Epic光学生物传感器微孔板。
所述细胞培养板中HT29细胞的接种密度为1.5~4.0×104个/孔,细胞培养液体积为10~60μL/孔。
模型的具体步骤为:
A)NTS以终浓度0.004~32nM加入到接种HT29细胞的细胞培养板,立即检测其DMR信号;
B)将待测样品加入到接种了HT29细胞的细胞培养板,待测样品终浓度为0.01nM~100μM,立即测其DMR谱,若其DMR谱与步骤A)所得的DMR谱具有轮廓相似性;
C)将不同浓度的NTSR拮抗剂SR48692或SR142948A以终浓度为4nM~40μM加入到接种HT29细胞的细胞培养板,室温处理HT29细胞30~60min,加入与步骤B)相同浓度的待测样品立即检测其DMR信号,若其DMR信号小于步骤B)中的DMR信号,则表明样品具有NTSR的激动活性。
模型的具体步骤为:
A)将待测样品和NTS分别加入接种了HT29细胞的细胞培养板,待测样品终浓度为0.01nM~100μM,NTS终浓度0.004~32nM,立即测HT29细胞DMR谱,检测时间40min-120min;
B)若步骤A)中待测样品不产生DMR谱,再向步骤A)中加入了待测样品的细胞培养板中继续加入与步骤A)浓度相同的NTS立即检测DMR谱40min-120min,若所得NTS的DMR信号比步骤A)中的NTS的DMR信号小,则表明样品具有NTSR的拮抗活性。
通路抑制剂U 73122、C1530、枸橼酸托法替尼(tofacitinib citrate)、Y27632、LY294002、H89、GF109203X或厄洛替尼(erlotinib)分别加入接种了HT29细胞的细胞培养板中,加入通路抑制剂的最终浓度为2nM~20μM,室温孵育30~60min,然后加入具有激动活性的待测样品(EC80或EC100)检测,所得细胞测DMR谱,根据其DMR谱是否被上述通路抑制剂所抑制,可判断样品是否具有通路偏向性。
所述GPCR无标记配体筛选模型为NTSR的无标记配体筛选模型。
所述GPCR无标记配体筛选模型采用的方法技术方法为无标记细胞整合药理学技术方法。
所述GPCR无标记配体筛选模型所采用的细胞培养板为Epic光学生物传感器微孔板。
所述GPCR无标记配体筛选模型中Epic光学生物传感器微型细胞培养板中HT29细胞的接种密度为3×104个/孔,细胞培养液体积40μL。
所述GPCR无标记配体筛选模型中NTSR的内源性激动剂NTS在 HT29细胞上的DMR信号,NTS的浓度梯度为32nM、16nM、8nM、4nM、2nM、1nM、0.5nM、0.25nM、0.125nM、0.0625nM、0.03125nM、0.015625nM、0.0078125nM、0.00390625nM。
所述GPCR无标记配体筛选模型采用NTSR特异性拮抗剂SR48692和SR142948A在HT29细胞上对NTSR的激动剂NTS的DMR信号进行了分析。
所述GPCR无标记配体筛选模型采用无标记细胞整合药理学技术结合信号传导通路抑制剂和激酶抑制剂对NTSR的信号传导通路偏向性进行了研究。
体外细胞实验表明,本发明中GPCR无标记配体筛选模型中的GPCR为NTSR,NTSR与肺癌、前列腺癌、乳腺癌、结肠癌以及胰腺癌等疾病相关,根据靶点与疾病的相关性,可以拓宽此模型在临床应用的范围。
附图说明
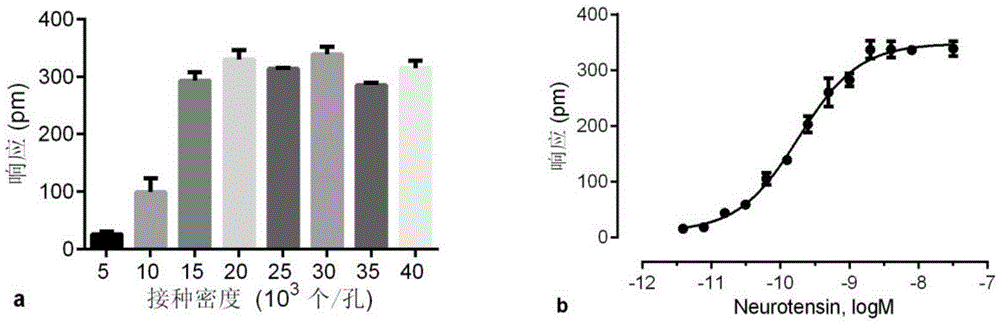
图1(a)神经降压素在不同接种密度的HT29细胞上的DMR最大响应值;(b)神经降压素在最佳接种密度的HT29细胞上的DMR剂量效应曲线。
图2(a)SR48692对神经降压素在HT29细胞上所产生的DMR响应的剂量效应曲线;(b)SR142948A对神经降压素在HT29细胞上所产生的DMR响应的剂量效应曲线。
图3(a)U73122对神经降压素在HT29细胞上的DMR剂量效应曲线;(b)C1530对神经降压素在HT29细胞上的DMR剂量效应曲线;(c)Tofacitinib citrate预处理后神经降压素在HT29细胞上的DMR剂量效应曲线;(d)不同剂量的Y27632预处理HT29细胞之后不同时间神经降压素的DMR响应信号;(e)不同剂量的LY294002预处理之后HT29细胞之后神经降压素的DMR剂量效应曲线;(f)不同剂量的H-89预处理之后HT29细胞之后神经降压素的DMR剂量效应曲线;(g)不同剂量的GF109203X预处理之后HT29细胞之后神经降压素的DMR剂量效应曲线;(h)不同剂量的erlotinib预处理之后HT29细胞之后神经降压素的DMR剂量效应曲线。
图4(a)PD149163在的HT29细胞上的DMR剂量效应曲线;(b)SR48692和SR142948A对PD149163在HT29细胞上所产生的DMR响应的剂量效应曲线;(c)U73122、C1530和Y27632预处理后PD149163在HT29细胞上的DMR剂量效应曲线;
具体实施方式
现结合实例对本发明做进一步说明,实例仅限于说明本发明,而非对本发明的限定。
实施例1:HT29细胞在Epic384光学生物传感器细胞培养板中的接种密度的优化
HT-29细胞购于中国科学院上海细胞库;神经降压素(neurotensin,NTS)、PD149163、SR48692、SR142948A、U73122、Erlotinib、C1530、Y27632、AG490、Tofacitinib citrate、H-89、LY294002购自Sigma公司;GF109203X购于Tocris公司。细胞培养板为Epic384孔光学生物传感器板。检测平台为康宁第三代成像仪,检测的信号为细胞动态质量重置(DMR)引起的波长位移。
将处于对数生长期的HT29细胞接种0.5、1、1.5、2、2.5、3、3.5、4×104个/孔8种不同密度,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL,在37℃条件下,培养24h,测DMR谱,通过NTS的DMR响应来确定一个最佳的接种密度,结果如图1a所示。结果表明NTS在3×104个/孔接种密度的HT29细胞上产生一个最大的DMR响应(图1b),且logEC50为-9.735±0.031(n=4)。因此确定HT29细胞的接种密度为3×104个/孔。
实施例2:采用CLIP技术研究NTSR特异性拮抗剂对NTS在HT29细胞上信号的影响
将处于对数生长期的HT29细胞以3×104个/孔的密度接种到Epic384孔光学生物传感器细胞培养板中,加入培养液,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL,在37℃条件下,培养24h之后,用不同剂量的NTSR特异性拮抗剂SR48692(图2a)和SR142948A(图2b)分别处理HT29细胞1h之后(每种拮抗剂从2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14个孔,平行4次),每孔加入4nM的NTS,然后置于仪器上实时监测记录DMR信号,根据监测到的DMR信号做剂量效应曲线如图2所示。结果表明SR142948A和SR48692都能以一个剂量依赖性的方式抑制NTS在HT29细胞上的DMR信号,且SR142948A的作用强于SR48692。SR142948A对NTS的logIC50为-6.521±0.019(n=4),SR48692对NTS的logIC50为-5.329±0.040(n=4)。
实施例3:采用CLIP技术结合细胞信号转导通路抑制剂及其激酶抑制剂研究NTSR信号转导通路
将处于对数生长期的HT29细胞以3×104个/孔的密度接种到Epic384孔光学生物传感器细胞培养板中,加入培养液,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL,在37℃条件下,培养24h之后用不同剂量的细胞信号转导通路抑制剂及其激酶抑制剂(Gq阻断剂U73122(图3a)、钙泵阻断剂C1530(图3b)、Janus activated kinase(JAK3)抑制剂Tofacitinib citrate(图3c)、 ROCK抑制剂Y27632(图3d)、PI3K抑制剂LY294002(图3e)、PKA抑制剂H-89(图3f)、PKC抑制剂GF109203X(图3g)、酪氨酸蛋白激酶抑制剂Erlotinib(图3h))分别预处理HT29细胞1h后(每种拮抗剂从2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14个孔,平行4次),每孔加入4nM的NTS,然后置于仪器上实时监测记录DMR信号,根据监测到的DMR信号做剂量效应曲线如图3。结果表明这些通路抑制剂及激酶抑制剂都能以一个剂量依赖性的方式不同程度的抑制NTS的DMR信号,这也说明NTSR信号通路与以上通路和激酶密切相关。U73122对NTS的logIC50值为-5.470±0.119(n=4);C1530对NTS的logIC50值分别为-5.682±0.026(n=4);Tofacitinib citrate对NTS的logIC50值为-5.082±0.195(n=4);Y27632对NTS的logIC50值为-4.704±0.085(n=4);LY294002对NTS的logIC50值为-4.749±0.273(n=4);H-89对NTS的logIC50值为-4.313±0.187(n=4);Erlotinib对NTS的logIC50值为-5.128±0.125(n=4)。
实施例4:采用CLIP技术研究NTSR激动剂PD149163在HT29细胞上信号的影响及其激活NTSR后的信号转导通路
首先,将处于对数生长期的HT29细胞接种3×104个/孔,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL,在37℃条件下,培养24h时间,测DMR谱,结果表明PD149163在3×104个/孔接种密度的HT29细胞上产生一个较强的正向的DMR响应信号,其logEC50分别为-5.824±0.038(n=4)(图4a)。
第二,将处于对数生长期的HT29细胞以3×104个/孔的密度接种到Epic384孔光学生物传感器细胞培养板中,加入培养液,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL,在37℃条件下,培养24h之后,用不同剂量的NTSR特异性拮抗剂SR48692和SR142948A分别处理HT29细胞1h之后(每种拮抗剂从2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14个孔,平行4次),每孔加入20μM的PD149163,然后置于仪器上实时监测记录DMR信号,根据监测到的DMR信号做剂量效应曲线如图4b所示。结果表明SR142948A和SR48692都能以一个剂量依赖性的方式抑制PD149163在HT29细胞上的DMR信号,且SR142948A的作用强于SR48692。SR142948A对PD149163的logIC50为-6.762±0.040(n=4),SR48692对PD149163的logIC50为-5.656±0.032(n=4)。
第三,将处于对数生长期的HT29细胞以3×104个/孔的密度接种到Epic384孔光学生物传感器细胞培养板中,加入培养液,所用培养液为McCoy’s 5A(Sigma,批号:SLBG2279V),每孔培养液用量为40μL, 在37℃条件下,培养24h之后用不同剂量的细胞信号转导通路抑制剂及其激酶抑制剂(Gq阻断剂U73122、钙泵阻断剂C1530、ROCK抑制剂Y27632)分别预处理HT29细胞1h后(每种拮抗剂从2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14个孔,平行4次),每孔加入4nM的PD149163,然后置于仪器上实时监测记录DMR信号,根据监测到的DMR信号做剂量效应曲线如图4c。结果表明这些通路抑制剂及激酶抑制剂都能以一个剂量依赖性的方式不同程度的抑制PD149163的DMR信号,这也说明NTSR信号通路与以上通路和激酶密切相关。U73122对PD149163的logIC50值为-5.257±0.270(n=4);C1530对PD149163的logIC50值为-5.557±0.030(n=4);Y27632对PD149163的logIC50值为-4.597±0.070(n=4)。
本发明采用无标记细胞整合药理学技术建立了NTSR无标记配体筛选模型。目前研究表明NTSR与心血管疾病、高血压、肺癌、前列腺癌、乳腺癌、结肠癌以及胰腺癌等疾病相关,根据靶点与疾病的相关性,可以拓宽此模型在临床应用的范围,采用该模型可以大大提高NTSR配体筛选的效率,对于阐述NTS和NTSR的药理学和生理学功能具有重要意义,为与NTSR相关的疾病的靶向治疗提供指导。
- 还没有人留言评论。精彩留言会获得点赞!