一种胰岛靶向蛋白及其真核表达方法与流程
本发明属于生物蛋白制备领域,更具体地,涉及一种胰岛靶向蛋白的真核表达方法,以及由该方法得到的胰岛靶向蛋白。
背景技术:
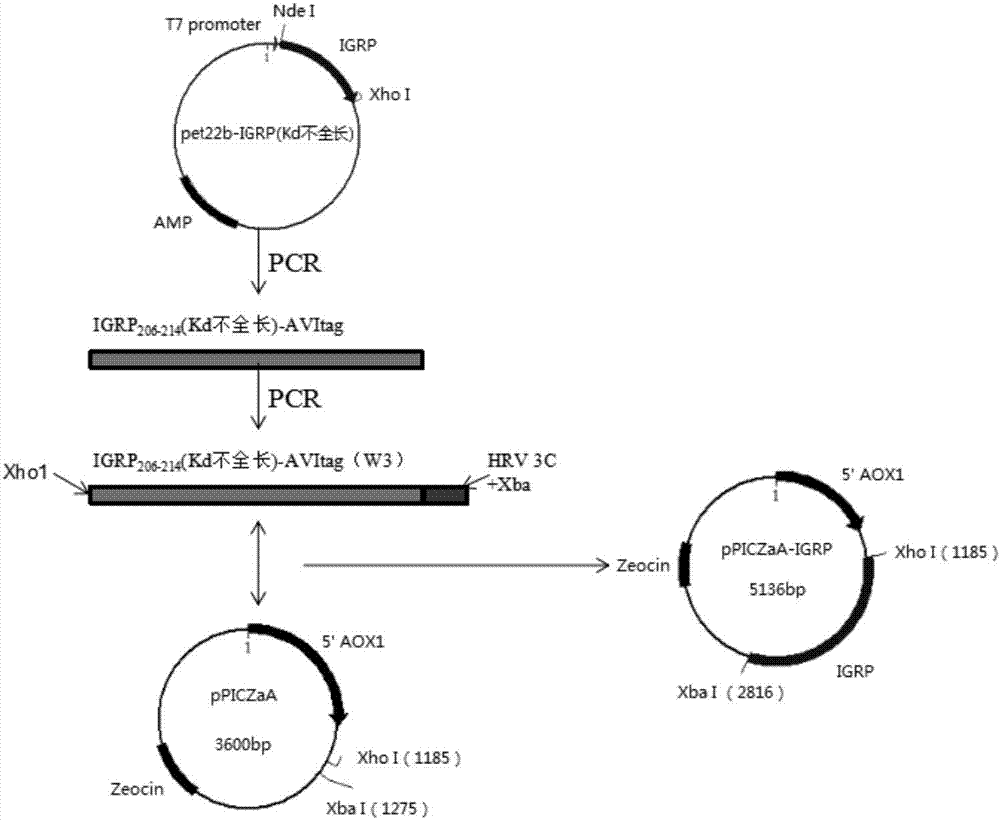
:nod(no-obesediabetes)鼠是研究ⅰ型糖尿病的动物模型,在13周龄体内的胰岛β细胞表面出现出现igrp206-214抗原肽,通过mhc包裹递呈给细胞毒性t细胞(ctl),ctl识别后通过分泌颗粒酶、穿孔素等杀伤胰岛β细胞,造成胰岛素分泌减少,血糖升高。课题组前期已通过原核表达系统制备胰岛靶向蛋白可溶性igrp206-214-dtsct复合物,并制备成四聚体、偶联毒素-皂草素后被特异性ctl识别,细胞内吞毒性后坏死,达到延缓糖尿病发病的作用。然而,原核表达系统由于不具备糖基化功能,不能真实模拟该蛋白的特性。目前,尚未有利用真核表达系统制备可溶性igrp206-214mhc复合物的方法。技术实现要素:本发明的目的是提供一种胰岛靶向蛋白的真核表达方法,以及由该方法得到的胰岛靶向蛋白。本发明的第一方面提供一种胰岛靶向蛋白的真核表达方法,包括以下步骤:(1)构建含有蛋白编码基因igrp206-214-dtsct的质粒;(2)将所述质粒重组到巴斯德酵母的染色体中;(3)通过甲醇发酵诱导获得目的蛋白。优选地,所述蛋白编码基因igrp206-214-dtsct包括上游的linker1编码序列、igrp206-214基因编码序列和下游的linker2编码序列,其中,所述linker1的序列为gcgas(g4s)2,且编码序列的第二位密码子为tgc,所述linker2的序列为(g4s)4。其中,igrp206-214的序列为vylkynvfc。优选地,所述含有蛋白编码基因igrp206-214-dtsct的质粒包括载体、蛋白编码基因igrp206-214-dtsct、5’端信号肽α-因子、3’端hrv3c蛋白酶切消化位点(编码基因为5’-tggaccttgaaacaaaacttccaa-3’,seqidno:3)、avi-tag(生物素化位点编码基因为5’-ttcgtgccattcgattttctgagcctcgaagatgtcgttcagaccgccacc-3’,seqidno:4)、6×his-tag以及双酶切位点。所述双酶切位点优选为xhoⅰ酶切位点(ctcgag)和ndeⅰ酶切位点(catatg)。优选地,所述载体为ppiczαa。优选地,所述蛋白编码基因igrp206-214-dtsct具有seqidno:1所示的碱基序列。优选地,所述含有蛋白编码基因igrp206-214-dtsct的质粒具有seqidno:2所示的碱基序列。上述修饰,使导入巴斯德酵母gs115中表达过程能酶切去除n和c段杂氨基酸。并且符合表达系统的要求。优选地,所述质粒进行单酶切后重组到巴斯德酵母的染色体中,所述单酶切的位点位于aox1上。线性化,是为了通过质粒和毕赤酵母染色体共有的5’aox1进行同源重组,将重组基因插入到染色体内,使重组基因在酵母内稳定的复制转录。根据本发明,单酶切位点为pmeⅰ酶切位点。优选地,步骤(3)中,诱导的过程中,加入d-biotin作为酵母蛋白酶的竞争性底物,并且,每隔8-15小时,加入总体积2-4%的甲醇;所述诱导在15-22℃下进行。诱导的培养基上清体积浓缩后直接进行ni离子亲和纯化,相较于原核表达系统省却了蛋白复性。本发明的第二方面提供由上述的真核表达方法得到的胰岛靶向蛋白,所述胰岛靶向蛋白的分子量优选为52-52.5kd,所述胰岛靶向蛋白的糖基化位点为n229、n319和n399。即重组蛋白氨基酸序列的第229,319,399的天冬氨酸。本发明的胰岛靶向蛋白相较于未糖基化的相同编码基因转录翻译的产物分子量,重组蛋白分子量由51-51.5kda上升到52-52.5kda;获得的重组蛋白在不进行复性的前提下,western-blot和dot-blot结果均显示构象的正确性。通过真核表达系统制备可溶性igrp206-214mhc复合物,较原先制备的原核表达的蛋白存在糖基化修饰,更加接近体内的蛋白晶体结构,增加特异性ctl对蛋白的识别率,以及tcr与mhc分子结合的稳定性,从而增加偶联到蛋白上的毒性被内吞的量,增加重组蛋白的效力,且糖基化修饰后重组蛋白在外环境中更加稳定,保存周期增加。附图说明图1为验证真核表达质粒ppiczαa的琼脂糖凝胶电泳图。图2示出了本发明的质粒设计方案。图3a示出了pe-igrp206-214-dtsct流式标记的非特异染色检验结果的流式结果典型图,a.nod雌鼠外周血,b.balb/c雌鼠外周血;图3b为流式结果柱状分析图。图4a示出了重组蛋白的dot-blot结果;图4b示出了重组蛋白的western-blot结果。图5为重组蛋白的飞行质谱图,其中,a为eigrp206-214-dtsct蛋白,b为经pngase处理的eigrp206-214-dtsct蛋白。图6a为eigrp206-214-dtsct体外刺激特异性ctl的流式结果典型图;图6b为流式结果柱状分析图。图7a为eigrp206-214-dtsct-tetramer体外刺激特异性ctl的流式结果典型图;图7b为流式结果柱状分析图。图8a为偶联毒素蛋白体外刺激特异性ctl的流式结果典型图;图8b为流式结果柱状分析图。具体实施方式下面将更详细地描述本发明的优选实施方式。其中,所用的各种试剂均可通过商购获得,具体操作方法参照商购试剂随附操作手册进行。本发明涉及的术语缩写、英文全称和中文全称如表1所示。表1一、igrp206-214-dtsct真核表达系统的构建及蛋白制备扩增出igrp206-214的全长编码基因,在末端加入可生物素化位点和6×his标签,以及首末端加入酶切位点插入真核表达质粒中,导入巴斯德酵母中构建蛋白的真核表达体系,并利用甲醇培养进行诱导目的蛋白的表达。利用oligo7设计pcr反应过程中目的基因的上下游引物,并预估得到退火温度,得到p1f、p1r、p2f、p2r四种引物序列,送生工定制引物。1、pcr扩增igrp206-214-dtsct基因片段1)吸取单克隆菌株培养液1ml,用质粒小提试剂盒提取pet22b-igrp206-214-dtsct质粒,溶于100μl纯水中。2)利用上下游引物p1f、p1r进行pcr扩增,以上一步的质粒为反应模板。pcr反应条件:98℃预变性3min;98℃变性10sec,59.6℃退火5sec,72℃延伸78sec,反应35个循环;再次72℃延伸5min;16℃无限反应。3)pcr产物跑琼脂糖电泳鉴定长度准确性,并于紫外灯下无菌(防止环境中杂基因干扰)切胶回收,利用胶回收试剂盒得到igrp206-214-dtsct编码片段(w1),溶于100μl超纯水中。pcr反应体系加入量5×primerstarbuffer(mg2+plus)10μldntpmixture(2.5mmeach)4μlp1f/p1r(10mm)各1μl(实验前预混)pet22b-igrp206-214-dtsct质粒<200ngprimerstarhsdnapolymerase(2.5u/ml)0.5μl灭菌蒸馏水至50μl2、pcr设计igrp206-214-dtsct基因片段1)根据真核表达的要求设计得到p2f、p2r上下游引物,oligo软件分析得到pcr反应退火温度。2)以w1为模板,通过p2f、p2r上下游引物,进行pcr反应。pcr反应条件:98℃预变性3min;98℃变性10sec,63.3℃退火5sec,72℃延伸78sec,反应35个循环;再次72℃延伸5min;16℃无限反应。3)pcr产物跑琼脂糖电泳鉴定长度准确性,并于紫外灯下无菌(防止环境中杂基因干扰)切胶回收,利用胶回收试剂盒得到设计的igrp206-214-dtsct编码片段(w2),溶于100μl超纯水中。pcr反应体系加入量5×primerstarbuffer(mg2+plus)10μldntpmixture(2.5mmeach)4μlp2f/p2r(10mm)各1μl(实验前预混)w1<200ngprimerstarhsdnapolymerase(2.5u/ml)0.5μl灭菌蒸馏水至50μl3、构建真核表达质粒ppiczαa以及鉴定1)ppiczαa菌株保存于大肠杆菌top中,无菌环境下,吸取5μl菌液接种到5mllb培养基中,并加入博来霉素(zeocin),使抗生素终浓度达到25μg/ml,加入细菌培养试管中,于摇床上以220rpm/min,37℃避光过夜培养。2)无菌环境下,用细菌接种环蘸取上一步中的菌液,四区划线涂布含25μg/mlzeocin的lb固体培养基,置于37℃恒温培养箱过夜培养。3)无菌环境下,用细菌接种挑取上一步lb培养基上的菌株单克隆,接种到含25μg/mlzeocin的lb培养液中,于摇床上以220rpm/min,37℃过夜培养。4)吸取5ml菌液,用质粒小提试剂盒提取ppiczαa质粒,溶于500μl无菌去离子水中,-80℃冻存。5)利用xhoⅰ、xbaⅰ酶切ppiczαa鉴定质粒的长度正确性。酶切体系添加物添加量xbaⅰ/xhoⅰ1μl10×mbuffer2μldna≤1μg0.1bsa2μl灭菌水至20μl*整个反应体系与37℃下,反应1h。双酶切反应ndeⅰ加2μl,xhoⅰ各加3μl,反应时间延长至4h。6)xhoⅰ、xbaⅰ双酶切w2和ppiczαa质粒,用t4连接酶连接,反应在16℃下过夜连接。取连接后的产物跑琼脂糖电泳鉴定电泳鉴定,确认片段长度正确性。t4ligase25μl反应体系加入量10×t4dnaligasebuffer2.5μldna片段(w2)0.3pmol质粒载体(ppiczαa)0.03pmolt4dnaligase1μl灭菌去离子水至25μl*dna片段的摩尔数控制在载体dna摩尔数的3-10倍4、重组质粒导入中间宿主细胞中1)e.colidh5αelectro-cells(50μl)使用前在冰上融化。2)在融化的细胞中加入构建的重组质粒ppiczαa-igrp206-214-dtsct约1-2μldna溶液。3)将dh5αelectro-cells和dna混合液注入冰上预冷的0.1cm电转杯中。4)电压冲击后,迅速置于冰上冷却,加入1mlsoc培养基(冰上预冷)。电冲击参数:200欧姆,25μf,2.5kv,检查时间常数,应该在3ms以上。5)37℃振荡培养1小时(160-250rpm/min)。6)将培养液低俗低温离心(2000rpm/min,4℃,5min),加入100μlllb培养液混匀,用细菌接种玻璃涂布棒均匀涂布在含zeocin的llb固态培养基上,37℃于恒温细菌培养箱中培养过夜。5、质粒导入gs115菌株以及鉴定1)取dh5α-ppiczαa-igrp206-214-dtsct菌液,摇菌培养获得20ml的新鲜菌液。利用细菌质粒提取试剂盒获得重组质粒,溶于100μl无菌去离子水中。2)利用pmeⅰ核酸内切酶单酶切重组质粒形成线性化的待电转重组质粒。单酶切的重组质粒与未酶切的重组质粒进行琼脂糖电泳鉴定。酶切体系添加物添加量pmeⅰ1μl10×nebbuffer5μldna≤1μg灭菌水至50μl*反应温度为37℃,反应5-15分钟。3)获得高浓度线性化重组质粒:100μl的酶切反应液中加入10μl的3m醋酸钠,以及250μl的无水乙醇,混匀后,12000rpm/min,4℃,离心10min;弃上清,加入1ml70%乙醇,使其白色沉淀悬浮,颠倒混匀数次,不要吹打,缓慢混匀,混匀后,12000rpm/min,4℃,离心10min;弃上清,室温开盖于无菌环境下静置数分钟,使其中的乙醇挥发干净;加入灭菌去离子约15μl溶解dna。4)将5-10μg线性化的ppiczαa-igrp206-214-dtsct质粒(5-10μl灭菌去离子水溶解)加入到80μl制备的gs115感受态细胞中,混匀,加入到预冷的0.2cm电转化杯中(0℃)。5)在冰上孵育转化杯5min。6)根据电转化仪说明书要求,用1.5kv,25μf,200欧姆电击,电击时间参数约5ms最适宜,电脉冲细胞。7)电脉冲完成后立即向杯中添加1ml冰浴的1m山梨醇(无菌,0℃)到电击杯中,吸取溶液到无菌ep管中(用移液器吹打时,尽量避免产生气泡)。8)将ep管于30℃下静置1小时后,3000rpm/min,4℃,离心5min,弃上清,加入新鲜的1m山梨醇(无菌)100μl,混匀后,吸取40μl菌液在无菌环境下,用细菌接种玻璃板涂布到直径10cm的ypds平板上,均匀涂布。9)将涂布菌液的ypds固态培养基置于30℃恒温细菌培养箱中,培养2-3天直到克隆形成。10)挑取单克隆菌株,以设计的上游下游引物p3f、p3r送上海生工公司测序,与设计的eigrp206-214-dtsct编码基因对比。取少量菌液100℃煮样5min后,10000rpm/min,离心10min,取上清液作为pcr模板,以设计的上下游引物p3f、p3r进行pcr,pcr产物跑琼脂糖电泳,验证插入基因长度。6、目的蛋白eigrp206-214-dtsct诱导以及鉴定6.1、酵母菌株的诱导培养1)无菌环境下挑取gs115-ppiczαa-igrp206-214-dtsct单克隆菌株,接种到灭菌的300mlbgmy培养基中,锥形瓶放置于恒温匀速摇床上,培养体系中加入1‰amp和25μg/mlzeocin,30℃,180rpm/min,培养36h,使菌液od600达到20。2)上一步的菌液离心(4000rpm/min,4℃,15min,小转速,短时间,低温以防止对菌体的损伤),去上清,用一定量的bmmy培养基进行诱导,使菌液od600达到0.6-0.8之前,尽量保证2l锥形瓶中菌液量不超过500ml(保证菌液中包含充足的氧气使酵母菌处于有氧呼吸状态),诱导条件:180rpm/min,培养72h,20℃。3)诱导过程中,一开始加入甲醇溶液使浓度达到1%,每过12h补充相同量的甲醇。4)诱导完成后离心(8000rpm/min,4℃,30min)。5)经甲醇诱导的菌液上清与未诱导前以及转入空质粒ppiczαa的巴斯的酵母gs115发酵菌液上清同时跑sds-page。6.2、gs115-ppiczαa-igrp206-214-dtsct高表达菌株挑取1)取2.2.4中电转化涂板培养获得的数个gs115-ppiczαa-igrp206-214-dtsct单克隆菌株,接种到含zeocin(浓度25μg/ml)的ypds培养液中,30℃,180rpm/min培养。2)取一步的菌液涂布在含有25μg/ml的zeocin的ypds固态培养板上,30℃,置于恒温培养箱中培养48h。3)挑取上一步固态培养板中取得单克隆菌株用10μlypds培养基混匀后涂布在含取50μg/ml的zeocin的ypds固态培养板上,30℃,置于恒温培养箱中培养48h。4)挑取上一步固态培养板中取得单克隆菌株用10μlypds培养基混匀后涂布在含取100μg/ml的zeocin的ypds固态培养板上,30℃,置于恒温培养箱中培养48h。5)取200μg/ml的zeocin的ypds固态培养板上,30℃,置于恒温培养箱中培养48h。6)取上述2)-5)步中能获得的具有抗最高浓度zeocin抗性的单克隆菌株与无菌条件下接种到5ml含相应浓度zeocin的ypds培养液中,置于恒温摇床上避光30℃,180rpm/min培养48h,离心(2000rpm/min,4℃,10min),弃上清,用含20%甘油的ypds液体培养基混匀后-80℃冻存高表达菌株。7、eigrp206-214-dtsct蛋白的纯化7.1、eigrp206-214-dtsct蛋白单体超滤1)将保存于20%乙醇中的分子排量为30kda(mwco)的超滤膜用超纯水洗涤,置于摇床上以100rpm/min的速度洗涤三次,每次1h,保证超滤膜上无乙醇残留(乙醇可导致蛋白变性析出),重分的洗涤能增加超滤膜的重复利用率。2)超滤膜置于超滤杯中,光面向上,用无菌超纯水检漏,保证在一定气压压力下,超纯水以水滴的形式被滤过,流速保持在0.6-1ml/min(3-5s/滴)。3)2.3.1超速离心的蛋白培养基混合液过0.22μm滤膜去除大分子杂质以及粗略的除菌处理(后续的步骤尽量保持在低温无菌环境中进行,防止加速蛋白的降解)。4)过滤后的溶液加入到超滤小室中,每次加入300ml,超滤杯密闭后置于4℃层析柜中,于磁力搅拌器上调整转速是悬起的溶液不超过总体积的1/3,调节压力泵的数值,使溶液以水滴的形式被滤过,且流速保持在0.6-1ml/min(3-5s/滴)。5)300ml溶液被浓缩到30ml则停止,向超滤杯中补充270ml的20mmtris(ph=8,无菌)溶液。重复步骤4)。6)重复步骤5)两次,替换用培养基混匀的蛋白液,使蛋白溶液在浓度为(1-0.1^3=0.999)的20mmtris(ph=8,无菌)溶液中,有利于下一步的蛋白纯化。7.2、纯化eigrp206-214-dtsct蛋白由于设计的目的蛋白上带有6×his标签,可以用ni离子亲和层析的方法纯化获得纯度较高的目的蛋白。在蛋白层析纯化系统上(biologicduoflowsystems)配合镍金属鳌和层析柱。7.3、eigrp206-214-dtsct蛋白的截留1)将保存于20%乙醇中的分子排量为30kda(mwco)的截留管用超纯水洗涤,置于摇床上以100rpm/min的速度洗涤三次,每次1h,保证截留管中无乙醇残留(乙醇可导致蛋白变性析出),充分的洗涤能增加截留管上超滤膜的重复利用率。2)用超纯水检漏,在截留管上部加入10ml超纯水,将截留管放入点角离心机中,保持截留离心管的滤膜平面与离心机中心轴垂直,4℃,4000rpm/min离心,5min中观察剩余超纯水,保持在2ml以上证明截留管可继续使用。3)将纯化后的蛋白溶液加入到截留管上部,将截留管放入点角离心机中,保持截留离心管的滤膜平面与离心机中心轴垂直,4℃,4000rpm/min离心,直至截留离心管中剩余约1ml的蛋白溶液(约需要离心30min),收集蛋白浓缩液。4)使用后的截留管用超纯水洗涤,置于摇床上以100rpm/min的速度洗涤三次,每次1h。保存于20%乙醇中,置于4℃冰箱。8、运用蛋白酶切除eigrp206-214-dtsct肽段c端多余氨基酸反应体系如下目的蛋白100μg10×hrv3ccleavagebuffer5μlhrv3cprotease1μl(1u)无菌去离子水至50μl*反应体系在4℃环境下,反应16h。9、eigrp206-214-dtsct蛋白生物素化以及四聚体9.1、eigrp206-214-dtsct的蛋白生物素化以及去除游离生物素1)上述hrv3c蛋白酶反应后的蛋白混合液运用截留管使蛋白的溶剂交换成生物素化buffer,只是截留后剩余的1ml蛋白溶液用生物素化buffer补足10ml,重复截留三次后使生物素化buffer浓度达到99.9%(1-0.1^3=0.999)。2)蛋白生物素化反应体系如下:目的蛋白1mg10×biomixa50μl10×biomixb50μlbira2.5μlpmsf(0.1mm)1μlleu(2.5mg/ml)0.5μlpep(1mm/ml)0.5μl*使用生物素化buffer补足500μl,充分混匀后,在30℃下,反应1h。3)生物素肽段有244da大小,有一部分无反应的游离的以及反应中的bira需要被清除,采用分子筛的方法。用p6分子筛分离柱配合蛋白纯化系统进行蛋白去游离生物素,方案如下:方法步骤通过量(ml)流速(ml/min)(1)pbs平衡155(2)蛋白样品上样0.50.5(3)pbs洗脱50.5(4)pbs平衡155收集去游离生物素后的eigrp206-214-dtsct蛋白,用bca试剂盒测定蛋白浓度(步骤见附件一),通过sds-page分析蛋白。用ep管分装得到的蛋白,每管2μg蛋白,保存于-80℃冰箱中,延长蛋白的半衰期。9.2、eigrp206-214-dtsct四聚体以及偶联皂草素的四聚体的制备生物素化的eigrp206-214-dtsct蛋白与链霉亲和素/偶联皂草素的链霉亲和素分子量的比值是51kda:100kda按4.5:1的摩尔比计算制备过程中两种蛋白的用量。反应在室温下进行,生物素化蛋白分10次加入到链霉亲和素/偶联皂草素的链霉亲和素溶液中,每次均充分混匀,每次反应10min。10、结果验证10.1、构建真核表达质粒ppiczαa以及鉴定空质粒ppiczαa单酶切鉴定长度符合说明书上标注,将设计的w2序列和空质粒ppiczαa用xbaⅰ和xhoⅰ双酶切后,t4连接酶连接形成的重组质粒在电泳上显示别空质粒长度明显长,重组的ppiczαa-igrp206-214-dtsct质粒导入到中间宿主菌dh5α中,使得大肠杆菌具有zeocin抗性,抗性筛选后,小提菌液质粒,再双酶切鉴定,与对照相比(箭头所示)有相同的目的条带,长度为1558bp,如图1所示。10.2、gs115菌株的验证gs115菌株不抗zeocin,同时缺乏his编码基金不能自身合成his,而ppiczαa能补充这些不足,可以用md缺陷培养基筛选gs115以及质粒转化是否成功。实验结果显示,购买的gs115菌株能够在mdh培养基生长,同时抗amp不抗zeocin说明菌株基本符合要求。同时还验证了大肠杆菌能否在zeocin中生长,实验结果证实不具有zeocin抗性。验证了上一步中用zeocin来筛选质粒转化dh5α的可行性。10.3、质粒电转化gs115菌株的验证重组质粒ppiczαa-igrp206-214-dtsct电转化gs115菌株后,理论上能够在mdh培养基中生长,并且具有了zeocin的抗性,实验结果验证了上述猜想。并且转化菌株用生工的酵母染色体小提试剂盒提取染色体基因,作为模板,用p3f以及p3r通过pcr获得与阳性对照组相同长度的条带。提取质粒后送上海生工基因测序,测序结果lasergene软件分析比对测序结果与正确的基因序列,结果显示序列与设计的一致。二、eigrp206-214-dtsct蛋白的理化和活性检测1、脾脏淋巴细胞的分离与培养nod雌性个体周龄达到12-14周时,脾脏中针对igrp表位的特异性ctl的细胞数量达到最高峰,选取此周龄的老鼠最为实验对象。1.1、取nod鼠脾脏1)颈椎脱臼法处死实验小鼠,置于75%乙醇中浸泡5-10分钟。2)取出小鼠置于超净工作台内的玻璃小皿上,右侧卧位。3)左手持镊子,右手持剪刀,在左腹部剪开一小口,分离皮肤暴露脾脏部位。4)持另一把镊子和剪刀剪开肌肉层以及胸腔膜,取出并分离脾脏周围组织。5)将脾脏剪成小块后置于盛有适量2%小牛血清、1×pbs的200目筛网上。6)用玻璃针栓在筛网上轻轻研磨脾脏,然后将下面小皿中的液体转移到15ml离心管中,4℃,1500rpm/min离心5min。7)弃上清,轻弹底部混匀细胞,一只小鼠样本加3ml的1×pbs混匀细胞。1.2、ficoll分离淋巴细胞1)与超净工作台中取干净的15ml玻璃离心管,用移液器缓慢加入1.5mlficoll淋巴细胞分离液。(尽量保证直接加到离心管底部,ficoll:细胞悬液的体积比为1:2)。2)倾斜玻璃离心管,略放平,吸取刚制备的细胞悬液缓慢加入试管中。3)4℃,1500rpm/min离心20min,完成后取出离心管,动作尽量轻柔,不要破坏液层界面,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。4)吸取上层非细胞层弃之,吸出单个核细胞层到另一只无菌的15ml玻璃离心管中,可以吸出单个核层外加一部分的ficoll分离液。5)向吸出的单个核细胞悬液中加入等量的1×pbs混匀后离心,4℃,1500rpm/min,5min,离心后弃上清。6)重复步骤5两次,一共操作三次。7)向离心后的细胞沉淀中加入1ml无菌的10%1640培养基,吹打混匀后。8)细胞计数:吸取10μl淋巴细胞悬液,滴加到红细胞计数板的观察区,显微镜下观察计数,计算细胞浓度,用10%1640培养基调整细胞浓度直至为106个/ml。1.3、脾脏淋巴细胞的培养1)取24孔板,每孔加入浓度为106个/ml的淋巴细胞悬液600μl,即每孔0.6×106个细胞。2)培养体系为1%的亲链霉素双抗,5ng/mlil-2。3)细胞培养板放入恒温培养箱静置培养,参数为:37℃,5%co2。2、流式检测pe-rigrp206-214-dtsct-tetramer的非特异性染色1)将rigrp206-214-dtsct蛋白(51kda)与pe-tetramer(340kda)按4.5:1的摩尔比避光室温孵育,pe-tetramer分十次加入rigrp206-214-dtsct蛋白溶液中,混匀后每次孵育15min。储存在4℃,不超过24h。2)取12周龄的nod鼠雌鼠和12周龄balb/c雌鼠各六只,眼眶静脉丛取血100μl,加入到edta抗凝剂中。3)3000rpm/min,离心5min,弃上清,加入1ml红细胞裂解液,混匀后加入室温下孵育15min。4)3000rpm/min,离心5min,弃上清,观察沉淀颜色判断裂红效果,可重复步骤3。5)裂红成功的细胞用100μl1×pbs重悬,加入过量的apc-anti-mousecd8抗体吹打混匀后,置于4℃,避光孵育30min。6)加入1ml1×pbs吹打混匀,3000rpm/min,离心5min,弃上清,重复洗涤两次。7)向细胞沉淀中加入100μl1×bs移液器吹打重悬,混匀后加入适量的新制的pe-rigrp206-214-dtsct-tetramer吹打混匀后,置于4℃,避光孵育30min。8)加入1ml1×pbs吹打混匀,3000rpm/min,离心5min,弃上清,重复洗涤两次。9)细胞沉淀中加入200μl1×pbs,混匀后上流式检测。3、蛋白印迹鉴定eigrp206-214-dtsct蛋白结构域3.1、dot-blot鉴定eigrp206-214-dtsct蛋白结构域1)剪取适当大小的pvdf膜,甲醇充分浸泡1min,用tbs洗涤两遍,平衡膜上电荷。2)eigrp206-214-dtsct和rigrp206-214-dtsct两组蛋白用bca试剂盒定量后,吸取适量的蛋白用10μl移液器点在pvdf膜表面,于无菌超净台中等待自然风干。3)封闭:pvdf膜点样面朝上置于tbs溶解的5%脱脂奶粉溶液中,并放置于100rpm/min的水平摇床上,室温孵育2h。4)抗体孵育:孵育一抗(一抗用5%脱脂奶粉溶液稀释,体积比1:200),根据膜的大小以0.1ml/cm2加入一抗溶液,反贴法,置于4℃环境中孵育过夜;孵育二抗(二抗用5%脱脂奶粉溶液稀释,体积比1:2000),根据膜的大小以0.1ml/cm2加入二抗溶液,反贴法,室温下避光孵育2h。5)洗膜:孵育好的pvdf膜点样面朝上置于tbst溶液中,并放置于100rpm/min的水平摇床上,洗涤30min,换液重复洗涤3-4次。6)ecl发光液滴加到pvdf膜点样面,化学发光仪下观察。3.2、western-blot鉴定eigrp206-214-dtsct蛋白结构域1)配置非变性非还原page凝胶2)组装蛋白电泳设备,向电泳槽中加入电泳缓冲液,向凝胶槽中加入eigrp206-214-dtsct和rigrp206-214-dtsct两种蛋白,蛋白溶液提前用5×loadingbuffer调配,并离心吸取上清。3)跑胶:60v恒压电泳30min压胶,使蛋白在分离胶和压缩胶的界面处压成一条水平直线,120v恒压电泳,直至蓝色蛋白线条跑至胶底,结束电泳。4)转膜:pvdf膜置于甲醇中平衡1min,用转膜液充分洗涤。覆盖在蛋白胶上,用“三明治法”从上到下依次是滤纸、pvdf膜、蛋白胶、滤纸,抹去气泡并夹紧。100v恒压转膜1h。7)封闭:pvdf膜点样面朝上置于tbs溶解的5%脱脂奶粉溶液中,并放置于100rpm/min的水平摇床上,室温孵育2h。8)抗体孵育:孵育一抗(一抗用5%脱脂奶粉溶液稀释,体积比1:200),根据膜的大小以0.1ml/cm2加入一抗溶液,反贴法,置于4℃环境中孵育过夜;孵育二抗(二抗用5%脱脂奶粉溶液稀释,体积比1:2000),根据膜的大小以0.1ml/cm2加入二抗溶液,反贴法,室温下避光孵育2h。9)洗膜:孵育好的pvdf膜点样面朝上置于tbst溶液中,并放置于100rpm/min的水平摇床上,洗涤30min,换液重复洗涤3-4次。10)ecl发光液滴加到pvdf膜点样面,化学发光液下观察。4、质谱分析eigrp206-214-dtsct糖基化的存在1)运用蛋白酶切除eigrp206-214-dtsct肽段c端多余氨基酸。2)eigrp206-214-dtsct与rigrp206-214-dtsct两种蛋白交换buffer,溶解到无菌去离子水中(金属离子可能影响飞行质谱的结果,出现杂峰)。3)样品进行飞行质谱分子量检测。5、eigrp206-214-dtsct生物学活性研究5.1、流式检测igrp206-214特异性ctl1)将培养有nod鼠脾脏淋巴细胞的24孔细胞培养板置于工作台上,吸取细胞悬液到无菌ep管中,加入1ml1×pbs混匀,3000rpm/min,离心5min,弃上清。2)细胞沉淀用100μl1×pbs重悬,加入过量的apc-anti-mousecd8、percp-anti-mousecd3抗体吹打混匀后,置于4℃,避光孵育30min。3)加入1ml1×pbs吹打混匀,3000rpm/min,离心5min,弃上清,重复洗涤两次。4)向细胞沉淀中加入100μl1×pbs移液器吹打重悬,混匀后加入适量的新制的pe-rigrp206-214-dtsct-tetramer吹打混匀后,置于4℃,避光孵育30min。5)加入1ml1×pbs吹打混匀,3000rpm/min,离心5min,弃上清,重复洗涤两次。6)细胞沉淀中加入200μl1×pbs,混匀后上流式检测。5.2、可溶性eigrp206-214-dtsct-tetramer体外对特异性ctl的影响1)由2.1.3得到脾脏淋巴细胞,向24孔细胞培养板中淋巴细胞培养体系中加入不同浓度的可溶性eigrp206-214-dtsct-tetramer以及rigrp206-214-dtsct-tetramer两种蛋白,设置的蛋白浓度梯度如下:编号1234567eigrp206-214-dtsct-tetramer浓度(μg/ml)00.40.81.2235rigrp206-214-dtsct-tetramer浓度(μg/ml)00.40.81.22352)24孔细胞培养板中淋巴细胞是处于半悬浮转态的,采用半换液法即先吸取一半培养基,再补充一半新鲜的10%1640(1%的亲链霉素双抗,5ng/mlil-2,每孔相同浓度的蛋白),每24h小时按照上述方法换液一次。培养72h后,流式检测igrp抗原特异性ctl。5.3、皂草素偶联的eigrp206-214-dtsct-tetramer体外对特异性ctl的影响1)将eigrp206-214-dtsct蛋白(51kda)与sap-tetramer(100kda)按4.5:1的摩尔比避光室温孵育,sap-tetramer分十次加入rigrp206-214-dtsct蛋白溶液中,混匀后每次孵育15min。储存在4℃,不超过24h。2)由2.1.3得到脾脏淋巴细胞,向24孔细胞培养板中淋巴细胞培养体系中加入不同浓度的可溶性sap-eigrp206-214-dtsct-tetramer,设置的蛋白浓度梯度如下:编号12345sap-eigrp206-214-dtsct-tetramer浓度(μg/ml)012483)由2.1.3得到脾脏淋巴细胞,向24孔细胞培养板中淋巴细胞培养体系中加入相同浓度的可溶性新制sap-eigrp206-214-dtsct-tetramer蛋白、可溶性新制sap-eigrp206-214-dtsct-tetramer,以pbs作为空白对照,设置sap-tetramer阴性对照组,sap-tetramer的用量约为sap-eigrp206-214-dtsct-tetramer复合物的用量的1/3,依次保证sap-eigrp206-214-dtsct-tetramer组中sap的浓度与sap-tetramer组浓度相等。4)24孔细胞培养板中淋巴细胞是处于半悬浮转态的,随意采用先吸取一半培养基,再补充一半新鲜的10%1640(1%的亲链霉素双抗,5ng/mlil-2,每孔相同浓度的蛋白),每24h小时按照上述方法换液一次。培养7天后,流式检测抗原特异性ctl。6、结果6.1、pe-igrp206-214-dtsct流式标记的非特异染色检验参照(窦延.igrp_(206-214)dtsct四聚体偶联皂草素清除nod小鼠抗原特异性ctl[d].扬州大学,2014)获得原核表达系统表达的rigrp206-214-dtsct蛋白,分别与streptavidin、pe-streptavidin按照摩尔比4.5:1,孵育制备四聚体。新制的pe-streptavidin分别标记了nod雌鼠以及balb/c雌鼠12周龄的外周血单个核细胞,流式结果如图3a和图3b所示,nod鼠外周血cd8+igrp-tetramer+/cd8+%在1.147±0.08377%(n=8)之间,balb/c鼠外周血cd8+igrp-tetramer+/cd8+%在0.2313±0.03978%(n=8)之间,两组数据进行t-test检验,p<0.001,存在极显著差异。6.2、dot-blot、western-blor验证eigrp206-214-dtsct蛋白构象正确性purify-anti-h-2kd一抗能够结合到h-2kd重链的α3结构域上,识别构象表位,其阳性结果至少能说明重组蛋白重链的构象正确性及稳定性。如图4a和图4b所示,两种蛋白印迹结果均表明和复性的rigrp206-214-dtsct一样,eigrp206-214-dtsct蛋白均有正确的蛋白结构。图4b中条带2到4随着eigrp206-214-dtsct的点样量加大,条带的灰度梯度提升,条带5为eigrp206-214-dtsct经pngase处理后点样显色结果与条带3的点样量相同,但明显灰度值降低。6.3、质谱证明了eigrp206-214-dtsct蛋白存在糖基化pngase蛋白酶能够特异性切断n-糖链中糖链与天冬酰胺形成的酰胺键,糖链游离后,因为eigrp206-214-dtsct蛋白的糖链可能仅有1-3kda,所以选择了飞行质谱来分析酶切前后eigrp206-214-dtsct蛋白分子量改变。如图5所示,pngase酶切后仅存在51240da处的吸收峰,而eigrp206-214-dtsct未经处理存在51556da、52105da、53381da三处吸收峰,推算出52105da、53381da处可能就是糖基化修饰的蛋白,糖链在500-1800da之间,大约有100个单糖构成的两条以上的糖链。6.4、eigrp206-214-dtsct具有体外刺激特异性ctl的活性6.4.1eigrp206-214-dtsct-tetramer体外提高特异性ctl频率在淋巴细胞培养体系加入不同浓度的eigrp206-214-dtsct-tetramer和rigrp206-214-dtsct-tetramer,培养72h后,流式检测。结果如图6a和图6b所示,蛋白浓度为3μg/ml组(特异性ctl频率为6.495±0.0912%,n=4)和5μg/ml组(特异性ctl频率为6.667±0.0977%,n=4)无差异。而最大刺激浓度即5μg/ml与空白对照组(特异性ctl频率2.417±0.0895%,n=4)相比存在显著差异,p<0.001,t-test。6.4.2eigrp206-214-dtsct-tetramer偶联sap后体外降低特异性ctl频率1)在淋巴细胞培养体系加入不同浓度的sap-eigrp206-214-dtsct-tetramer蛋白,培养7天后,流式检测。如图7a和7b所示,结果显示随着体系中靶向毒蛋白浓度的增加特异性ctl频率由空白组的2.720±0.06014%(n=4)最终降低到实验组0.7650±0.09215%(n=4),t-test分析结果,p<0.001,具有显著性差异。2)在淋巴细胞培养体系加入相同浓度的sap-eigrp206-214-dtsct-tetramer和sap-rigrp206-214-dtsct-tetramer培养7天后,流式检测。如图8a和图8b所示,结果显示sap-tetramer组(特异性ctl频率为2.243±0.1442%,n=4)与pbs空白组(特异性ctl频率2.215±0.09465%,n=4)无差异,说明sap-tetramer蛋白对特异性ctl无直接的杀伤作用。原核蛋白偶联毒素组(特异性ctl频率0.5975±0.06329%,n=4)与真核蛋白偶联毒素组(特异性ctl频率0.3600±0.03873%,n=4)之间有差异,p<0.05,t-test。真核蛋白偶联毒素组与空白组存在极显著差异,p<0.001,t-test。本发明成功的利用真核表达质粒ppiczαa将igrp206-214-h-2kd-dtsct编码基因重组到巴斯德酵母gs115的染色体中,低温甲醇诱导产生糖基化的eigrp206-214-dtsct蛋白,蛋白糖基化得到实验验证,糖链分子量大小为1kda至2kda,蛋白印迹确认真核表达的eigrp206-214-dtsct重组蛋白具有天然的空间构象。利用重组蛋白的生物素化位点,制备了eigrp-tetramer以及偶联皂草素的sap-eigrp-tetramer。在体外实验中,通过流式检测,制备的eigrp206-214-dtsct-tetramer联合il-2能够促进igrp抗原肽特异性ctl的细胞频率增加,共培养72h,与空白对照组相比,特异性ctl细胞频率由2.417±0.08950%,n=4上升到6.667±0.09770%,n=4,存在极显著差异。制备的sap-eigrp206-214-dtsct-tetramer能够促进igrp抗原肽特异性ctl的细胞频率下降,共培养7天,与空白对照组相比特异性ctl细胞频率由2.720±0.06014%,n=4降低到实验组0.7650±0.09215%,n=4,存在显著差异。实验中sap-tetramer组与空白对照组无显著差异,说明igrp抗原肽特异性ctl细胞不能够直接内吞sap-tetramer,需要抗原肽-mhc靶向蛋白的引导。同时,以现有技术原核表达系统表达的重组蛋白制备的sap-rigrp206-214-dtsct-tetramer作为实验对照组,抗原肽特异性ctl细胞为频率0.5975±0.06329%,n=4,真核蛋白偶联毒素组的特异性ctl细胞频率为0.3600±0.03873%,n=4,相较于原核蛋白偶联毒素组存在差异,体外促进抗原肽特异性ctl细胞频率下降的效果更明显。本发明的方法为以后利用真核表达系统表达抗原肽-mhc复合物提供了研究基础。sequencelisting<110>李,凯<120>一种胰岛靶向蛋白及其真核表达方法<130>1700345<160>10<170>patentinversion3.3<210>1<211>1391<212>dna<213>人工序列<400>1ctcgagaaaagagaggctgaagctgtgtacctgaagaccaacgtcttcctcggatgcggt60gcctcaggcggaggcggctcaggaggtggcggttcaatccagaaaacccctcaaattcaa120gtatactcacgccacccaccggagaatgggaagccgaacatactgaactgctacgtaaca180cagttccacccgcctcacattgaaatccaaatgctgaagaacgggaaaaaaattcctaaa240gtagagatgtcagatatgtccttcagcaaggactggtctttctatatcctggctcacact300gaattcacccccactgagactgatacatacgcctgcagagttaagcatgccagtatggcc360gagcccaagaccgtctactgggatcgagacatgggaggcggtggctcaggcggaggcggc420tcaggaggtggcggttcaggaggcggcggatctggcccacattcgctgaggtatttcgtc480accgccgtgtcccggcccggcctcggggagccccggttcatcgctgtcggctacgtggac540gacacgcagttcgtgcgcttcgacagcgacgcggataatccgagatttgagccgcgggcg600ccgtggatggagcaggaggggccggagtattgggaggagcagacacagagagccaagagc660gatgagcagtggttccgagtgagcctgaggaccgcacagagatgctacaaccagagcaag720ggcggctctcacacgttccagcggatgttcggctgtgacgtggggtcggactggcgcctc780ctccgcgggtaccagcagttcgcctacgacggccgcgattacatcgccctgaacgaagac840ctgaaaacgtggacggcggcggacacggcggcgctgatcaccagacgcaagtgggagcag900gctggtgatgcagagtattacagggcctacctagagggcgagtgcgtggagtggctccgc960agatacctggagctcgggaatgagacgctgctgcgcacagattccccaaaggcccatgtg1020acctatcaccccagatctcaagttgatgtcaccctgaggtgctgggccctgggcttctac1080cctgctgatatcaccctgacctggcagttgaatggggaggacctgacccaggacatggag1140cttgtagagaccaggcctgcaggggatggaaccttccagaagtgggcagctgtggtggtg1200cctcttgggaaggagcagaattacacatgccatgtgcaccataaggggctgcctgagcct1260ctcaccctgagatggaagcttcctccatccactgtctccaacggcagtggtggcggtctg1320aacgacatcttcgaggctcagaaaatcgaatggcacgaattggaagttttgtttcaaggt1380ccatttctaga1391<210>2<211>4891<212>dna<213>人工序列<400>2agatctaacatccaaagacgaaaggttgaatgaaacctttttgccatccgacatccacag60gtccattctcacacataagtgccaaacgcaacaggaggggatacactagcagcagaccgt120tgcaaacgcaggacctccactcctcttctcctcaacacccacttttgccatcgaaaaacc180agcccagttattgggcttgattggagctcgctcattccaattccttctattaggctacta240acaccatgactttattagcctgtctatcctggcccccctggcgaggttcatgtttgttta300tttccgaatgcaacaagctccgcattacacccgaacatcactccagatgagggctttctg360agtgtggggtcaaatagtttcatgttccccaaatggcccaaaactgacagtttaaacgct420gtcttggaacctaatatgacaaaagcgtgatctcatccaagatgaactaagtttggttcg480ttgaaatgctaacggccagttggtcaaaaagaaacttccaaaagtcggcataccgtttgt540cttgtttggtattgattgacgaatgctcaaaaataatctcattaatgcttagcgcagtct600ctctatcgcttctgaaccccggtgcacctgtgccgaaacgcaaatggggaaacacccgct660ttttggatgattatgcattgtctccacattgtatgcttccaagattctggtgggaatact720gctgatagcctaacgttcatgatcaaaatttaactgttctaacccctacttgacagcaat780atataaacagaaggaagctgccctgtcttaaacctttttttttatcatcattattagctt840actttcataattgcgactggttccaattgacaagcttttgattttaacgacttttaacga900caacttgagaagatcaaaaaacaactaattattcgaaacgatgagatttccttcaatttt960tactgctgttttattcgcagcatcctccgcattagctgctccagtcaacactacaacaga1020agatgaaacggcacaaattccggctgaagctgtcatcggttactcagatttagaagggga1080tttcgatgttgctgttttgccattttccaacagcacaaataacgggttattgtttataaa1140tactactattgccagcattgctgctaaagaagaaggggtatctctcgagaaaagagaggc1200tgaagctgtgtacctgaagaccaacgtcttcctcggatgcggtgcctcaggcggaggcgg1260ctcaggaggtggcggttcaatccagaaaacccctcaaattcaagtatactcacgccaccc1320accggagaatgggaagccgaacatactgaactgctacgtaacacagttccacccgcctca1380cattgaaatccaaatgctgaagaacgggaaaaaaattcctaaagtagagatgtcagatat1440gtccttcagcaaggactggtctttctatatcctggctcacactgaattcacccccactga1500gactgatacatacgcctgcagagttaagcatgccagtatggccgagcccaagaccgtcta1560ctgggatcgagacatgggaggcggtggctcaggcggaggcggctcaggaggtggcggttc1620aggaggcggcggatctggcccacattcgctgaggtatttcgtcaccgccgtgtcccggcc1680cggcctcggggagccccggttcatcgctgtcggctacgtggacgacacgcagttcgtgcg1740cttcgacagcgacgcggataatccgagatttgagccgcgggcgccgtggatggagcagga1800ggggccggagtattgggaggagcagacacagagagccaagagcgatgagcagtggttccg1860agtgagcctgaggaccgcacagagatgctacaaccagagcaagggcggctctcacacgtt1920ccagcggatgttcggctgtgacgtggggtcggactggcgcctcctccgcgggtaccagca1980gttcgcctacgacggccgcgattacatcgccctgaacgaagacctgaaaacgtggacggc2040ggcggacacggcggcgctgatcaccagacgcaagtgggagcaggctggtgatgcagagta2100ttacagggcctacctagagggcgagtgcgtggagtggctccgcagatacctggagctcgg2160gaatgagacgctgctgcgcacagattccccaaaggcccatgtgacctatcaccccagatc2220tcaagttgatgtcaccctgaggtgctgggccctgggcttctaccctgctgatatcaccct2280gacctggcagttgaatggggaggacctgacccaggacatggagcttgtagagaccaggcc2340tgcaggggatggaaccttccagaagtgggcagctgtggtggtgcctcttgggaaggagca2400gaattacacatgccatgtgcaccataaggggctgcctgagcctctcaccctgagatggaa2460gcttcctccatccactgtctccaacggcagtggtggcggtctgaacgacatcttcgaggc2520tcagaaaatcgaatggcacgaattggaagttttgtttcaaggtccatttctagaacaaaa2580actcatctcagaagaggatctgaatagcgccgtcgaccatcatcatcatcatcattgagt2640ttgtagccttagacatgactgttcctcagttcaagttgggcacttacgagaagaccggtc2700ttgctagattctaatcaagaggatgtcagaatgccatttgcctgagagatgcaggcttca2760tttttgatacttttttatttgtaacctatatagtataggattttttttgtcattttgttt2820cttctcgtacgagcttgctcctgatcagcctatctcgcagctgatgaatatcttgtggta2880ggggtttgggaaaatcattcgagtttgatgtttttcttggtatttcccactcctcttcag2940agtacagaagattaagtgagaccttcgtttgtgcggatcccccacacaccatagcttcaa3000aatgtttctactccttttttactcttccagattttctcggactccgcgcatcgccgtacc3060acttcaaaacacccaagcacagcatactaaattttccctctttcttcctctagggtgtcg3120ttaattacccgtactaaaggtttggaaaagaaaaaagagaccgcctcgtttctttttctt3180cgtcgaaaaaggcaataaaaatttttatcacgtttctttttcttgaaattttttttttta3240gtttttttctctttcagtgacctccattgatatttaagttaataaacggtcttcaatttc3300tcaagtttcagtttcatttttcttgttctattacaactttttttacttcttgttcattag3360aaagaaagcatagcaatctaatctaaggggcggtgttgacaattaatcatcggcatagta3420tatcggcatagtataatacgacaaggtgaggaactaaaccatggccaagttgaccagtgc3480cgttccggtgctcaccgcgcgcgacgtcgccggagcggtcgagttctggaccgaccggct3540cgggttctcccgggacttcgtggaggacgacttcgccggtgtggtccgggacgacgtgac3600cctgttcatcagcgcggtccaggaccaggtggtgccggacaacaccctggcctgggtgtg3660ggtgcgcggcctggacgagctgtacgccgagtggtcggaggtcgtgtccacgaacttccg3720ggacgcctccgggccggccatgaccgagatcggcgagcagccgtgggggcgggagttcgc3780cctgcgcgacccggccggcaactgcgtgcacttcgtggccgaggagcaggactgacacgt3840ccgacggcggcccacgggtcccaggcctcggagatccgtcccccttttcctttgtcgata3900tcatgtaattagttatgtcacgcttacattcacgccctccccccacatccgctctaaccg3960aaaaggaaggagttagacaacctgaagtctaggtccctatttatttttttatagttatgt4020tagtattaagaacgttatttatatttcaaatttttcttttttttctgtacagacgcgtgt4080acgcatgtaacattatactgaaaaccttgcttgagaaggttttgggacgctcgaaggctt4140taatttgcaagctggagaccaacatgtgagcaaaaggccagcaaaaggccaggaaccgta4200aaaaggccgcgttgctggcgtttttccataggctccgcccccctgacgagcatcacaaaa4260atcgacgctcaagtcagaggtggcgaaacccgacaggactataaagataccaggcgtttc4320cccctggaagctccctcgtgcgctctcctgttccgaccctgccgcttaccggatacctgt4380ccgcctttctcccttcgggaagcgtggcgctttctcaatgctcacgctgtaggtatctca4440gttcggtgtaggtcgttcgctccaagctgggctgtgtgcacgaaccccccgttcagcccg4500accgctgcgccttatccggtaactatcgtcttgagtccaacccggtaagacacgacttat4560cgccactggcagcagccactggtaacaggattagcagagcgaggtatgtaggcggtgcta4620cagagttcttgaagtggtggcctaactacggctacactagaaggacagtatttggtatct4680gcgctctgctgaagccagttaccttcggaaaaagagttggtagctcttgatccggcaaac4740aaaccaccgctggtagcggtggtttttttgtttgcaagcagcagattacgcgcagaaaaa4800aaggatctcaagaagatcctttgatcttttctacggggtctgacgctcagtggaacgaaa4860actcacgttaagggattttggtcatgagatc4891<210>3<211>24<212>dna<213>人工序列<400>3tggaccttgaaacaaaacttccaa24<210>4<211>51<212>dna<213>人工序列<400>4ttcgtgccattcgattttctgagcctcgaagatgtcgttcagaccgccacc51<210>5<211>19<212>dna<213>人工序列<400>5gtgtacctgaagaccaacg19<210>6<211>22<212>dna<213>人工序列<400>6ttcgtgccattcgattttctga22<210>7<211>46<212>dna<213>人工序列<400>7ccgctcgagaaaagagaggctgaagctgtgtacctgaagaccaacg46<210>8<211>50<212>dna<213>人工序列<400>8tgctctagaaatggaccttgaaacaaaacttccaattcgtgccattcgat50<210>9<211>20<212>dna<213>人工序列<400>9ccgctcgagaaaagagaggc20<210>10<211>24<212>dna<213>人工序列<400>10gctctagaaaaaaaacatactgtg24当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种肿瘤靶向丝胶蛋白胶束及其制备方法和应用与流程
- 一种靶向缺血心肌的VEGF重组蛋白的利记博彩app与工艺
- 一种胰岛靶向蛋白及其真核表达方法与流程
- 一种基于Ion Torrent测序平台的靶向叶绿体测序方法与流程
- 用于癌症靶向治疗的包含基于重组血红蛋白蛋白质或亚基的治疗剂的药物组合物的利记博彩app与工艺
- 基于STAT3蛋白靶点的靶向抗癌药物的发明的利记博彩app与工艺
- 靶向泛素化降解PLK1和BRD4蛋白的化合物及其应用的制造方法与工艺
- 抗HBV复制的靶向融合蛋白及其构建方法与流程
- 靶向于钙粘着蛋白‑11的EC1结构域的人源化抗体及相关组合物和方法与流程
- 用于刺激靶向热休克蛋白以及促进蛋白质修复的脉冲电磁和超声疗法的制造方法与工艺
- 检测膜通道蛋白与靶向药物的相互作用的方法及其应用的利记博彩app
- 靶向于钙粘着蛋白-11的ec1结构域的人源化抗体及相关组合物和方法
- 因子viii蛋白向血小板的靶向递送的利记博彩app
- 一类人工靶向融合蛋白和蛋白偶联物及其制备方法和应用的利记博彩app
- 一种白血病干细胞靶向可溶性蛋白TrxHis-hSIRPα的利记博彩app
- 靶向人La蛋白的先导化合物及其在制备抗乙型肝炎病毒的药物中的用途的利记博彩app
- 一种具有脑靶向作用的多亚基蛋白质及其制备方法、用途
- 用于向动物或人体无创输送活性蛋白质的制剂的利记博彩app
- 靶向释药的抗癌蛋白质或多肽聚合物前药及其制备方法
- 用于细胞内靶向增殖和蛋白质合成的聚阴离子多价大分子的利记博彩app