一种构建EPO基因敲除斑马鱼动物模型的方法及引物、质粒与制备方法与流程
本发明属于生物医学技术领域,特别涉及一种基于crispr基因敲除技术构建epo基因敲除斑马鱼动物模型的方法、引物、质粒及质粒制备方法。
背景技术:
促红细胞生成素(erythropoietin,epo)是由肾脏和肝脏分泌的一种激素样物质,在抑制原始红细胞凋亡、促进红细胞生成中起到重要作用。近年研究提示,epo在心脏、肾脏、肝脏疾病及糖尿病、高脂血症等多种代谢综合症的发生发展中均起到重要调控作用,在氧化应激、抗凋亡方面作用显著。
由于既往基于锌脂蛋白、talen等基因编辑技术制备epo基因敲除存在基因敲除成功率低、步骤复杂,并且由于epo的作用重要且复杂,既往研究针对epo基因敲除的动物模型由于严重贫血均不能有效存活,导致目前并无可用于科学研究的epo基因敲除生物模型存在,限制了对epo的进一步认识和研究。因此,有必要研究构建epo基因敲除的动物模型的方法,为研究epo研究提供epo基因敲除的动物模型。
crispr是近年来新兴的基因编辑技术,它通过grna引导,利用cas9蛋白操作,从而对多种目标细胞dna进行切除,使基因组有效地产生变化或突变,效率比talen等其他传统基因编辑技术更高。已成为生物医学领域中研究分子机理和致病机制的重要手段。
斑马鱼作为一种新兴的实验生物,具有繁殖周期短、胚胎数量多、幼鱼身体通过药物保持透明等技术优势,被越来越广泛的运用于生物医学各项研究。斑马鱼幼鱼在胚胎发育10天以内可通过外界环境中氧气获得生存,对红细胞携氧的依赖较其他动物模型更少,因此有可能通过构建epo基因敲除斑马鱼,从而在胚胎时期对身体各器官进行更加全面准确的观察及分析。
因此,研究和探讨如何基于crispr基因敲除技术构建epo基因敲除斑马鱼动物模型,有助于解决目前并无可用于科学研究的epo基因敲除生物模型的问题,为epo研究提供epo基因敲除的动物模型。
技术实现要素:
本发明的目的在于提供一种基于crispr基因敲除技术构建epo基因敲除斑马鱼动物模型的方法,以便构建epo基因敲除斑马鱼动物模型,方便对epo的进一步认识和研究。
本发明的目的还在于提供一种用于构建epo基因敲除斑马鱼动物模型的引物和质粒,以及质粒的制备方法。
本发明是通过以下技术方案来实现:
一种基于crispr基因敲除技术构建epo基因敲除斑马鱼动物模型的方法,包括步骤:
1)建立含有epo基因片段靶序列的大肠杆菌质粒;
2)基于crispr基因敲除技术建立并培育epo基因敲除斑马鱼模型;
其中,步骤1)具体包括:
1-1)针对epo外显子2区域靶序列进行引物设计和引物合成,其中,
epo外显子2区域靶序列为:catctgtgacctgcgcgt(seqidno.1);
1-2)合成含有epo基因片段靶序列的大肠杆菌质粒。
优选地,在步骤1-1)中,所设计和合成的引物为:
前向引物:taggacgcgcaggtcacagatg(seqidno.2);
逆向引物:aaaccatctgtgacctgcgcgt(seqidno.3)。
优选地,步骤2)具体包括:
2-1)提取目标dna;
2-2)将目标dna逆转录为epogrna;
2-3)合成cas9rna;
2-4)向斑马鱼受精卵单细胞中注射epogrna和cas9rna的混合物;
2-5)步骤2-4)所得受精卵培养成为嵌合体斑马鱼,成年嵌合体斑马鱼与野生斑马鱼杂交获得杂合子斑马鱼,成年杂合子斑马鱼杂交获得纯合子斑马鱼胚胎。
优选地,在步骤2-4)与2-5)之间,还包括:在受精48~72小时后,提取胚胎基因组dna进行pcr扩增,进行基因测序和序列比对,确认基因敲除的有效性。
优选地,在步骤2-2)中,使用
优选地,在步骤2-3)中,cas9质粒来自addgenetm(plasmid#63154),使用
优选地,在步骤2-4)中,将epogrna与cas9rna混合于0.1mol/lkcl溶质中,在斑马鱼受精卵单细胞进行注射;混合后epogrna的浓度为180~220pg/μl,混合后cas9rna的浓度为180~220pg/μl。
一种用于构建epo基因敲除斑马鱼动物模型的引物,包括:
前向引物:taggacgcgcaggtcacagatg;
逆向引物:aaaccatctgtgacctgcgcgt。
一种用于构建epo基因敲除斑马鱼动物模型的含有epo靶序列的大肠杆菌质粒,其包括序列:
catctgtgacctgcgcgt。
所述的含有epo靶序列的大肠杆菌质粒的制备方法,包括步骤:
1)合成引物,其中,引物的序列为:
前向引物:taggacgcgcaggtcacagatg;
逆向引物:aaaccatctgtgacctgcgcgt;
2)引物退火:将前向引物和逆向引物的混合物退火,得退火寡聚物;
3)退火寡聚物的限制内切,得限制内切产物;
4)将限制内切产物转导入大肠杆菌中,大肠杆菌隔夜培养;
5)隔夜培养菌群挑选单一菌落隔夜培养,提取质粒并进行基因测序,筛选出含有epo基因片段靶序列的大肠杆菌质粒。
与现有技术相比,本发明具有以下有益的技术效果:
本发明针对epo外显子2区域靶序列设计和合成出了引物,并借助该引物合成出含有epo基因片段靶序列的大肠杆菌质粒,并最终基于crispr基因敲除技术建立epo基因敲除斑马鱼动物模型。本发明已成功培育出epo基因敲除杂合子斑马鱼成鱼,以及基因敲除纯合子斑马鱼幼鱼。通过基因测序及血红蛋白染色初步证实该方法具有较高的基因敲除成功率。本发明利用crispr技术敲除epo基因,得到相应靶基因修饰的斑马鱼模型,不仅可以加深对epo在基因调控中的作用认识,同时可为转化医学和新药研发提供高水平的基因模型。
本发明所提供的质粒和引物,可以用于构建epo基因敲除斑马鱼动物模型。
附图说明
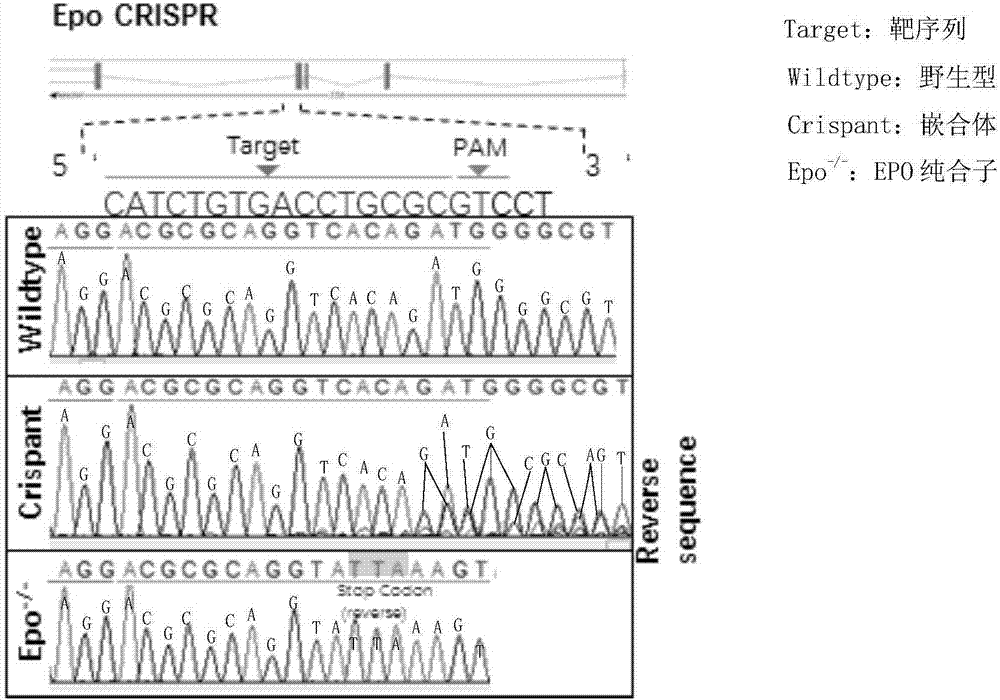
图1为epo基因敲除嵌合体及纯合子斑马鱼胚胎基因测序结果图示。
图2为epo基因敲除嵌合体斑马鱼胚胎受精后48h血红蛋白染色结果图。
图3为斑马鱼存活率图,其中,epo+/+为野生型,epo+/-为杂合子,epo-/-为纯合子;embryopercentage为胚胎比例;2/6/8dpf为受精后2/6/8天;3month为3月成年鱼。
具体实施方式
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
1、epo基因敲除斑马鱼模型的建立
1)建立含有epo基因片段靶序列的大肠杆菌质粒:
1-0)ensemble数据库(http://www.ensembl.org)获取斑马鱼epo基因序列(ensdart00000020288.9);
1-1)针对epo基因外显子2区域使用zifittargetversion4.2进行靶序列选择和引物设计,然后合成所设计的引物;
其中,所选择的epo外显子2区域的靶序列如seqidno.1所示,为:
catctgtgacctgcgcgt;
其中,所设计和合成的引物为:
前向引物(seqidno.2)taggacgcgcaggtcacagatg
逆向引物(seqidno.3)aaaccatctgtgacctgcgcgt
1-2)合成含有epo基因片段靶序列的大肠杆菌质粒;
1-2a)引物退火:2μl前向引物、2μl逆向引物、2μlneb缓冲液、14μl蒸馏水混合,混合物95℃下孵育5min,然后以0.1℃/sec的速度降温至50℃,50℃下孵育10min,然后以1℃/sec降温至4℃,得退火寡聚物;
1-2b)限制内切:1μl1-2a)所得的退火寡聚物、400ngpt7-grna质粒、1μlneb缓冲液、1μlt4dna连接酶、0.5μlbsmbi酶、0.3μlbglii酶、0.3μlsali酶、0.5μlt4连接酶和无dna水混合,混合后总容量为10μl;混合物先在37℃下孵育60min,再在16℃下孵育45min,如此循环三次;然后混合物升温至37℃并孵育30min,然后升温至55℃并孵育30min,再升温至80℃并孵育15min,降温至4℃,得限制内切产物;
1-2c)将限制内切产物转导入大肠杆菌中:大肠杆菌在-80℃冰箱中保存,取出后在冰上放置20~30min,将步骤1-2b)中所合成的限制内切产物与50μl大肠杆菌混合,混合物在冰上放置20min,再在42℃水浴中放置90sec,再在冰上放置至少90sec;将以上混合物中加入1mllb培养液在37℃、220rpm恒温箱培养板进行培育45min,然后将以上混合物在4℃离心机6000rpm离心5min,取离心后上清液900μl,平铺在lb培养基中,37℃恒温温箱隔夜培养。
1-2d)将隔夜培养菌群挑选单一菌落在3ml培养液中,37℃、220rpm隔夜培养;使用getmhealthcareillustrakit提取质粒进行基因测序;获得含有目的基因序列(epo外显子2区域靶序列:catctgtgacctgcgcgt)的质粒为阳性质粒;
2)基于crispr基因敲除技术建立并培育epo基因敲除斑马鱼模型:
2-1)将含有目的序列的阳性质粒1~3ug、neb3:1缓冲液5μl、10%bsa5μl、bamhi-hf1μl混合,无dna水将体积调整为50μl,37℃隔夜水浴;加入100ug/ml蛋白酶k0.5μl及0.5%sds2.5μl,在50℃加热20min,使用qiagentmpcrpurificationkit提取dna,琼脂凝胶电泳验证,得目标dna;
2-2)使用
2-3)cas9质粒来自addgenetm(plasmid#63154),使用
2-4)将epogrna与cas9rna混合于0.1mol/lkcl溶质中,在斑马鱼受精卵单细胞进行注射;混合后epogrna的浓度为200pg/μl,混合后cas9rna的浓度为200pg/μl。使用对照rna与cas9混合注射作为对照观察组;
在受精72小时后,提取胚胎基因组dna进行pcr扩增。进行基因测序,使用clustalw2(http://www.ebi.ac.uk/tools/msa/clustalw2/)进行序列比对,进一步明确基因敲除有效性;
2-5)将epogrna注射后获得嵌合体鱼(即含有多种混合基因突变细胞的嵌合体斑马鱼)培养至3月左右成年鱼大小,取鱼鳍组织基因测序,将基因测序阳性成年鱼与野生背景斑马鱼杂交获得epo+/-杂合子斑马鱼,将成年杂合子背景斑马鱼杂交获得epo-/-纯合子斑马鱼胚胎。通过基因测序结果判断纯合子基因变异序列。
2、epo基因敲除斑马鱼的血红蛋白染色及存活率评价
1)通过基因测序筛选检测epo+/-杂合子斑马鱼杂交后纯合子胚胎比率(epo-/-纯合子斑马鱼可存活至胚胎第8日)。
如图1所示,通过对crispr注射后嵌合子和纯合子斑马鱼进行靶位点pcr引物扩增,并且进行基因测序,与野生型斑马鱼序列比较,我们发现:①嵌合子斑马鱼胚胎目的序列受到干扰,可以检测到多个碱基信号;②纯合子目的序列中存在taa(逆向序列:tta)终止子基因突变。该结果进一步证实本基因敲除方法的可靠性和有效性。
2)血红蛋白染色评价epo基因敲除效率。
如图2所示,对crispr注射后48hpf(hourspostfertilization)嵌合子斑马鱼进行血红蛋白染色,可发现,epo基因敲除杂合子斑马鱼与对照组相比,血红蛋白明显减少。这提示epo基因敲除可影响斑马鱼造血系统正常发展,进一步证实本基因敲除方法的有效性。
3)通过对epo+/-杂合子斑马鱼成鱼进行交配,获得含有野生型、杂合子、纯合子的胚胎,选取16-24枚胚胎,提取基因组dna,通过pcr提取目的基因片段进行基因测序,判断斑马鱼的基因型为野生型、纯合子或杂合子,进一步在受精后2天、6天、8天、3月计算不同基因型斑马鱼的存活率,可以发现,如图3所示,其中,epo+/+为野生型,epo+/-为杂合子,epo-/-为纯合子;embryopercentage为胚胎比例;2/6/8dpf为受精后2/6/8天;3month为3月成年鱼。epo-/-基因敲除纯合子斑马鱼可存活至受精后8日,但无法存活至成年。这一结果进一步评价了本基因敲除的效率,并且证实通过本基因敲除方法获得基因敲除纯合子斑马鱼,可进行相关实验观察至胚胎发育第8日。
本发明通过构建epogrna,并对斑马鱼胚胎单细胞器进行基因注射,已成功培育出epo基因敲除杂合子斑马鱼成鱼,以及基因敲除纯合子斑马鱼幼鱼。通过基因测序及血红蛋白染色初步证实该方法具有较高的基因敲除成功率。
本发明利用crispr技术敲除epo基因,得到相应靶基因修饰的斑马鱼模型,不仅可以加深对epo在基因调控中的作用认识,同时可为转化医学和新药研发提供高水平的基因模型。在具体的操作中,利用互联网软件可筛选出合适的epogrna,并同时预测脱靶概率及中靶概率,可有效提高基因敲除效率。
核苷酸序列表
<110>西安交通大学医学院第一附属医院
<120>一种构建epo基因敲除斑马鱼动物模型的方法及及引物、质粒与制备方法
<160>3
<210>1
<211>20
<212>dna
<213>斑马鱼(barchydanioreriovar)
<400>1
catctgtgacctgcgcgt20
<210>2
<211>22
<212>dna
<213>人工合成
<400>2
taggacgcgcaggtcacagatg22
<210>3
<211>30
<212>dna
<213>人工合成
<400>3
aaaccatctgtgacctgcgcgt22
- 还没有人留言评论。精彩留言会获得点赞!