一种用于筛选定位及检测血液中稀有细胞的生物芯片的利记博彩app
本发明涉及一种生物芯片,尤其涉及到一种用于筛选定位及检测血液中稀有细胞的生物芯片。
背景技术:
近年来,ctc(circulatingtumorcell:循环肿瘤细胞)研究得到了越来越多的关注,许多研究报告已经证实ctc在肿瘤转移的早期诊断、疗效监控、个体化治疗及探索肿瘤转移机制等方面具有潜在的价值,然而ctc在循环系统中的含量极低,往往大约一千万个正常血细胞中才会发现一个或数个ctc,要想有效富集这些细胞极其困难,需要借助专门的生物芯片和灵敏的检测设备,这成为限制其临床相关应用的主要难点。
目前对ctc的分选富集方法主要分为生物学方法和物理学方法两大类。生物学方法指的是选择特异性抗体对细胞表面表达的生物标志物进行特异性的抗原抗体吸附,从而能动分选富集目的细胞或特异性去除非目的细胞以外的细胞与蛋白,仅保留目的细胞。其最大的优点是高特异性,能够高效识别ctc,其缺点主要有:1、由于抗原抗体的吸附作用不能在较高流速下进行,因此限制了其流速,从而较为耗时,通量低;2、抗原抗体反应会影响细胞活性,导致细胞表面的抗原(表面标志物)表达不确定;3、抗体试剂价格较为高昂。
物理方法指的是利用外力场(例如磁场、电场、流体场、超声波等)基于细胞间的物理特性差异(大小、变形性、密度、介电性等)进行分离。例如申请号为201210477243.5的中国发明专利申请文件公开了“一种用于筛选血液中稀有细胞的生物芯片”,其结构如下:包括具有凹槽的薄片和载玻片,薄片上的凹槽朝向载玻片并将薄片紧贴在所述的载玻片上,使薄片和载玻片之间形成一个密闭的微流体通道;所述的薄片上开设有连通所述的微流体通道的出液孔和进液孔。其在血液样本内放入磁性纳米粒子,磁性纳米粒子吸附在目标细胞上,然后将稀有细胞已被标记的血液样本流经微流体通道,血液样本中的附着有磁性纳米粒子的稀有细胞被放置于生物芯片下方的磁性体发出的梯度磁场引导,等采集工作完成后,将载玻片与薄片分离,对载玻片上的稀有细胞进行后续分析。该结构的生物芯片在使用过程中存在如下缺点:1、自由纳米粒子和被标记的纳米粒子肿瘤细胞往往会被吸附并聚集在载玻片上的一个小范围内,这种聚集可能会在识别过程中干扰甚至损坏肿瘤细胞;2、标记的目标纳米粒子肿瘤细胞在弱磁场区域内滚动,在没有被磁性体捕获的情况下容易从微流体通道内逃脱。
技术实现要素:
本发明的主要目的在于提供一种能高效捕获循环肿瘤细胞、不损坏循环肿瘤细胞且方便后续检测的用于筛选定位及检测血液中稀有细胞的生物芯片。
为达到以上目的,本发明采用的技术方案为:一种用于筛选定位及检测血液中稀有细胞的生物芯片,包括基层和微流控通道层,所述的微流控通道层紧贴设置在所述的基层上,所述的微流控通道层的上表面设置有捕获槽,所述的捕获槽的槽底设置有多个富集坑,所述的富集坑的深度为15~50微米,所述的微流控通道层的上表面紧贴设置有信号放大层,所述的信号放大层的上表面上与所述的捕获槽对应的位置处设置有纳米金层,贯穿所述的纳米金层以及所述的信号放大层设置有进入通道和排出通道,所述的进入通道和所述的排出通道分别与所述的捕获槽连通。
所述的捕获槽由依次连通的呈三角形的入口区域、呈矩形的捕获区域和呈三角形的出口区域组成,所述的进入通道与所述的入口区域位置对应且连通,多个所述的富集坑设置在所述的捕获区域内,所述的排出通道与所述的出口区域位置对应且连通。该结构中,捕获槽整体呈六边形设计,从流体力学角度出发,经过程序模拟运算,得出的结论是六边型形体分布最均匀,其能够支持高流量的细胞分选捕获。
多个所述的富集坑呈阵列分布设置在所述的捕获区域内。在本芯片的外部设置有磁场,当磁性纳米粒子标记的循环肿瘤细胞流经捕获区域时,就会在磁场力的作用下发生垂直于流速方向的偏转,进入到富集坑,从而实现循环肿瘤细胞的分选,多个富集坑的设置提高了分选捕获的效率。
所述的基层为二氧化硅层,所述的微流控通道层为二氧化硅层、塑料层或者树脂层,所述的信号放大层为二氧化硅层。在加工时,将基层、微流控通道层、信号放大层和纳米金层依次整齐叠加,放入到80℃的烘箱当中进行固化,得到完整的结构。
所述的基层的厚度为1~2毫米,所述的微流控通道层的厚度为0.1~0.3毫米,所述的信号放大层的厚度为10~30微米。该结构中,各个层的厚度经过实验对比以后,达到以上数据,在达到高效捕获循环肿瘤细胞的情况下节省芯片制作成本。
所述的捕获槽的表面修饰有特异性识别肿瘤细胞的anti-epcam抗体或者anti-cd45抗体。该结构中,anti-epcam抗体用于捕获表面具有epcam抗原的内源性的ctc细胞,而cd45是白细胞的通用抗原,使用cd45抗体的目的在于去除血液中表达cd45抗原的其它细胞,如白细胞,单球等与免疫调节相关量的免疫系统的细胞与蛋白,结合物理筛选方法,与纯生物学筛选相比,降低了制作成本,进一步达到分选纯度高的目的。
所述的基层紧贴设置在所述的微流控通道层上,所述的微流控通道层的上表面设置有捕获槽,所述的捕获槽的槽底设置有多个富集坑,所述的富集坑的深度为15~50微米,所述的基层的上表面紧贴设置有信号放大层,所述的信号放大层的上表面上与所述的捕获槽对应的位置处设置有纳米金层,贯穿所述的纳米金层、所述的信号放大层及所述的基层设置有进入通道和排出通道,所述的进入通道和所述的排出通道分别与所述的捕获槽连通。为了便于图示及兼顾微流控芯片的整体结构,本芯片富集与捕获ctc的核心部位被设计在三层结构微流控芯片的中间,但是出于预防ctc富集与染色标记时可能出现的交叉污染与实际应用的便利性,产品化的该微流控芯片可能将微流控通道层放置在底部,直接连接待富集标本的进入通道和排出通道,基层紧贴设置在所述的微流控通道层上提供支撑,而信号放大层的位置不变。
所述的捕获槽由依次连通的呈三角形的入口区域、呈矩形的捕获区域和呈三角形的出口区域组成,所述的进入通道与所述的入口区域位置对应且连通,多个所述的富集坑设置在所述的捕获区域内,所述的排出通道与所述的出口区域位置对应且连通。该结构中,捕获槽整体呈六边形设计,从流体力学角度出发,经过程序模拟运算,得出的结论是六边型形体分布最均匀,其能够支持高流量的细胞分选捕获。
多个所述的富集坑呈阵列分布设置在所述的捕获区域内。在本芯片的外部设置有磁场,当磁性纳米粒子标记的循环肿瘤细胞流经捕获区域时,就会在磁场力的作用下发生垂直于流速方向的偏转,进入到富集坑,从而实现循环肿瘤细胞的分选,多个富集坑的设置提高了分选捕获的效率。
与现有技术相比,本发明的优点在于:通过在微流控通道层设置捕获槽,捕获槽设置有多个富集坑,待分选的血液从进入通道进入到捕获槽后,在外界磁场的作用下,事先被磁性纳米粒子标记的循环肿瘤细胞流经富集坑时,就会在磁场力的作用下发生垂直于流速方向的偏转,进入到富集坑,避免了循坏肿瘤细胞过度聚集,而未被标记的细胞则从排出通道流出,从而实现循环肿瘤细胞的捕获;信号放大层不直接参与捕获细胞前后的各种工序,依靠表层纳米金的信号放大效应,放大检测信号,能够实现后续的快速分析;本发明能高效捕获循环肿瘤细胞、不损坏循环肿瘤细胞,同时方便后续检测。
附图说明
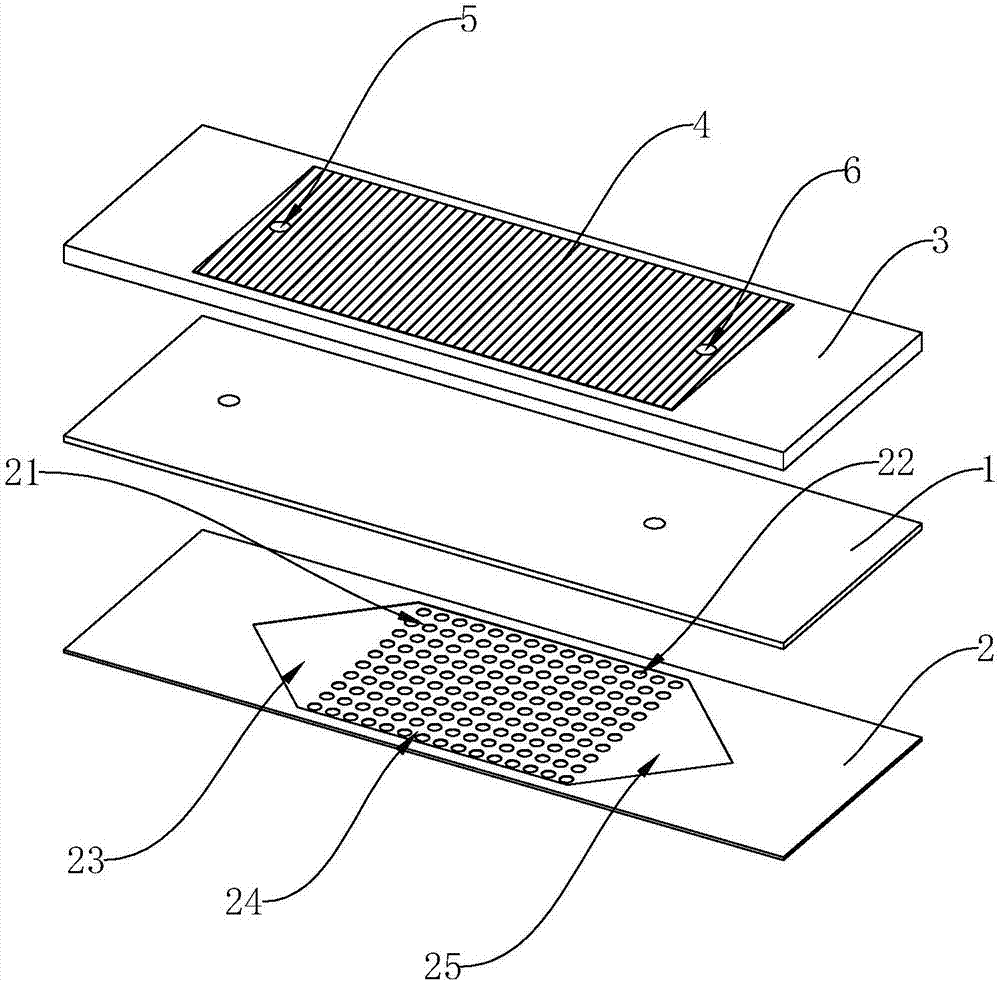
图1是本发明实施例一、实施例二和实施例三的分解状态的结构示意图;
图2是本发明实施例四的分解状态的结构示意图。
具体实施方式
以下结合附图实施例对发明作进一步详细描述。
实施例一:如图所示,一种用于筛选定位及检测血液中稀有细胞的生物芯片,包括基层1和微流控通道层2,微流控通道层2紧贴设置在基层1上,微流控通道层2的上表面设置有捕获槽21,捕获槽21的槽底设置有多个富集坑22,富集坑22的深度为15~50微米,微流控通道层2的上表面紧贴设置有信号放大层3,信号放大层3的上表面上与捕获槽21对应的位置处设置有纳米金层4,贯穿纳米金层4以及信号放大层3设置有进入通道5和排出通道6,进入通道5和排出通道6分别与捕获槽21连通。
实施例二:如图所示,一种用于筛选定位及检测血液中稀有细胞的生物芯片,包括基层1和微流控通道层2,微流控通道层2紧贴设置在基层1上,微流控通道层2的上表面设置有捕获槽21,捕获槽21的槽底设置有多个富集坑22,富集坑22的深度为15~50微米,微流控通道层2的上表面紧贴设置有信号放大层3,信号放大层3的上表面上与捕获槽21对应的位置处设置有纳米金层4,贯穿纳米金层4以及信号放大层3设置有进入通道5和排出通道6,进入通道5和排出通道6分别与捕获槽21连通。
本实施例中,捕获槽21由依次连通的呈三角形的入口区域23、呈矩形的捕获区域24和呈三角形的出口区域25组成,进入通道5与入口区域23位置对应且连通,多个富集坑22设置在捕获区域24内,排出通道6与出口区域25位置对应且连通。
本实施例中,多个富集坑22呈阵列分布设置在捕获区域24内。富集坑22的截面形状为三角形、矩形、圆形等,优选的是圆形,且截面的尺径范围为10-20微米。
在具体使用时,首先在血液样本内放入磁性纳米粒子,磁性纳米粒子表面带有抗体,通过免疫反应吸附在目标细胞上,然后将目标细胞已被标记的血液样本从进入通道5进入到捕获槽21当中,在外置磁场的作用下,已被标记的ctc发生垂直于流速方向的偏转,进入到富集坑22,一个富集坑22只能容纳一个被标记的细胞,未被标记的细胞则从排出通道6流出,之后取出芯片,往捕获槽21注入少量红外荧光染料,结合纳米金层4,可放大的检出信号强度优于传统的荧光信号,极大方便了后续分析。
实施例三:如图所示,一种用于筛选定位及检测血液中稀有细胞的生物芯片,包括基层1和微流控通道层2,微流控通道层2紧贴设置在基层1上,微流控通道层2的上表面设置有捕获槽21,捕获槽21的槽底设置有多个富集坑22,富集坑22的深度为15~50微米,微流控通道层2的上表面紧贴设置有信号放大层3,信号放大层3的上表面上与捕获槽21对应的位置处设置有纳米金层4,贯穿纳米金层4以及信号放大层3设置有进入通道5和排出通道6,进入通道5和排出通道6分别与捕获槽21连通。
本实施例中,捕获槽21由依次连通的呈三角形的入口区域23、呈矩形的捕获区域24和呈三角形的出口区域25组成,进入通道5与入口区域23位置对应且连通,多个富集坑22设置在捕获区域24内,排出通道6与出口区域25位置对应且连通。
本实施例中,多个富集坑22呈阵列分布设置在捕获区域24内。富集坑22的截面形状为三角形、矩形、圆形等,优选的是圆形,且截面的尺径范围为10~20微米。
本实施例中,基层1为二氧化硅层,微流控通道层2为二氧化硅层、塑料层或者树脂层,信号放大层3为二氧化硅层。
本实施例中,基层1的厚度为1~2毫米,微流控通道层2的厚度为0.1~0.3毫米,信号放大层3的厚度为10~30微米。
本实施例中,捕获槽21的表面修饰有特异性识别肿瘤细胞的anti-epcam抗体或者anti-cd45抗体。特别是富集坑22的表面也设置有anti-epcam抗体或者anti-cd45抗体。
实施例四:如图所示,一种用于筛选定位及检测血液中稀有细胞的生物芯片,包括微流控通道层2和基层1,基层1紧贴设置在微流控通道层2上,微流控通道层2的上表面设置有捕获槽21,捕获槽21的槽底设置有多个富集坑22,富集坑22的深度为15~50微米,基层1的上表面紧贴设置有信号放大层3,信号放大层3的上表面上与捕获槽21对应的位置处设置有纳米金层4,贯穿纳米金层4、信号放大层3及基层1设置有进入通道5和排出通道6,进入通道5和排出通道6分别与捕获槽21连通。
本实施例中,捕获槽21由依次连通的呈三角形的入口区域23、呈矩形的捕获区域24和呈三角形的出口区域25组成,进入通道5与入口区域23位置对应且连通,多个富集坑22设置在捕获区域24内,排出通道6与出口区域25位置对应且连通。
本实施例中,多个富集坑22呈阵列分布设置在捕获区域24内。
- 还没有人留言评论。精彩留言会获得点赞!