一种稠合的苯并咪唑杂氮环丁酮衍生物的制备方法及其在抗肿瘤药物中的应用与流程
本申请涉及药物领域,尤其是一类稠合的苯并咪唑杂氮环丁酮衍生物及其在抗肿瘤药物中的应用。
背景技术:
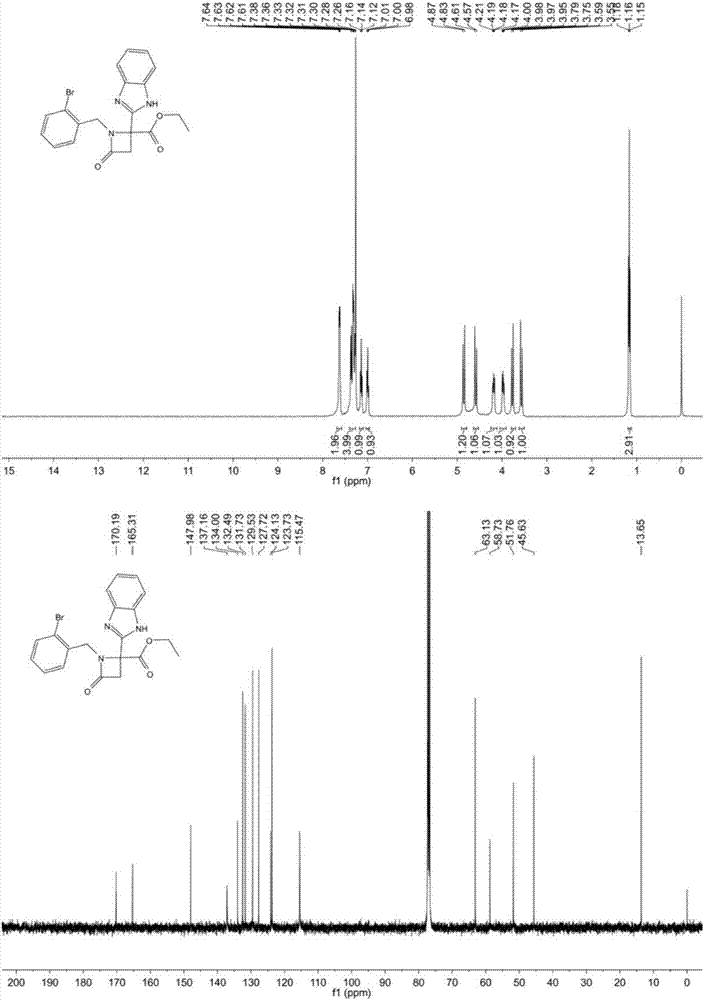
:苯并咪唑类化合物具有广泛的生物活性,在抗肿瘤、消炎等疾病方面有所应用,另外还可以作为有机反应的重要中间体。在倡导绿色化学的今天,如何使苯并咪唑类化合物的合成进一步绿色化,仍然是一个重要的课题。杂氮环丁酮类化合物也同样作为重要的药物基团,在很多的药物中都有所体现。首个也是唯一一个选择性胆固醇吸收抑制剂依折麦布(ezetimibe),是降脂药物近15年来的一大创新,该药物就是杂氮环丁酮类化合物。虽然,杂氮环丁酮结构有很多的研究已经开展,但是苯并咪唑和杂氮环丁酮结构共同组合的新结构化合物还未有报道,急需人们关注和研究。技术实现要素:本发明的目的在于提供一类稠合的苯并咪唑杂氮环丁酮衍生物的制备方法及其在抗肿瘤药物中的应用。本申请合成出稠合的苯并咪唑杂氮环丁酮衍生物,并对其进行了体外肿瘤细胞抑制活性的测试,结果显示这类化合物对人类肺癌、胶质瘤、肝癌、乳腺癌、结肠癌和前列腺癌有一定的抑制作用(10mm生长抑制率可达到53%),具有抗肿瘤活性,可用作制备抗肿瘤药物。本发明的目的是通过以下技术方案实现的:一种稠合的苯并咪唑杂氮环丁酮衍生物,其特征在于:衍生物的结构通式如下:其中所述的r1为烷基、芳基和杂芳基,r2为氢原子、卤素、甲基。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(2-溴苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-苄基-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(3-氟苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯。而且,所述化合物为乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯。所述的稠合的苯并咪唑杂氮环丁酮衍生物,其特征在于:合成路线如下其中r1为烷基、芳基和杂芳基,r2为氢原子、卤素、甲基。而且,稠合苯并咪唑杂氮环丁酮衍生物在制备抗肿瘤药物中的应用。所述化合物可用作制备治疗人类肺癌、胶质瘤、肝癌、乳腺癌、结肠癌和前列腺癌的抗肿瘤药物。本发明的优点和积极效果:(1)本发明以乙醛酸乙酯为其中一种原料,经过ugi反应和碱性条件下的关环得到杂氮环丁酮结构,然后在酸性条件下得到苯并咪唑环,首次合成出了具有抗肿瘤活性的稠合苯并咪唑杂氮环丁酮衍生物,并对其进行了体外肿瘤细胞抑制活性的测试,结果显示这类化合物对人类肺癌、胶质瘤、肝癌、乳腺癌、结肠癌和前列腺癌有一定的抑制作用(10mm生长抑制率可达到53%),具有抗肿瘤活性,可用作制备抗肿瘤药物。(2)本发明合成路线具有操作工艺简单、合成路线短,成本低等优点。(3)本发明所述的化合物具有抑制或杀灭人肺癌、胶质瘤、肝癌、乳腺癌、结肠癌和前列腺癌细胞,可以用作制备治疗相关的抗肿瘤药物。附图说明图1为结构通式,其中所述的r1为烷基、芳基和杂芳基,r2为氢原子、卤素、甲基。图2为乙基2-(1h-苯并咪唑-2-基)-1-(2-溴苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图3为乙基2-(1h-苯并咪唑-2-基)-1-苄基-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图4为乙基2-(1h-苯并咪唑-2-基)-1-(3-氟苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图5为乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图6为乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图7为乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮杂环丁烷-2-羧酸乙酯的核磁谱图。图8为乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。图9为乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的核磁谱图。具体实施方式为了理解本发明,下面结合实施例子对本发明作进一步说明:下述实施例子是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。本发明所述的稠合苯并咪唑杂氮环丁酮衍生物的结构通式如下:其中r1为烷基、芳基和杂芳基,r2为氢原子、卤素、甲基。所述的稠合的苯并咪唑杂氮环丁酮衍生物具体合成路线如下:下面通过实施例子具体说明合成过程。实施例1其中r1为烷基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(2-溴苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-溴苄胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(2-溴苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率47%。1hnmr(400mhz,cdcl3)δ7.62(dd,j=5.9,3.1hz,2h),7.40–7.27(m,4h),7.14(t,j=7.4hz,1h),7.00(t,j=7.5hz,1h),4.85(d,j=15.2hz,1h),4.59(d,j=15.2hz,1h),4.18(dt,j=14.3,7.2hz,1h),4.04–3.91(m,1h),3.77(d,j=14.4hz,1h),3.57(d,j=14.4hz,1h),1.16(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ170.19,165.31,147.98,137.16,134.00,132.49,131.73,129.53,127.72,124.13,123.73,115.47,63.13,58.73,51.76,45.63,13.65.lc/mscalculatedforc20h18brn3o3[m+h]+,428;found428。实施例2其中r1为烷基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-苄基-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和苄胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-苄基-4-氧代氮杂环丁烷-2-羧酸乙酯,产率45%。1hnmr(400mhz,cdcl3)δ9.10(s,2h),7.64(dd,j=6.1,3.1hz,2h),7.34(dd,j=6.1,3.1hz,2h),7.15–6.97(m,5h),4.67(d,j=15.2hz,1h),4.46(d,j=15.2hz,1h),4.03(dddd,j=25.0,10.7,7.2,3.6hz,2h),3.59-3.77(m,2h),1.14(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ168.19,147.76,134.65,134.10,128.81,128.46,127.83,124.96,115.06,63.44,58.6550.66,46.14,13.61.lc/mscalculatedforc20h19n3o3[m+h]+,350;found350。实施例3其中r1为烷基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(3-氟苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和3-氟苄胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(3-氟苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率46%。1hnmr(400mhz,cdcl3)δ7.62(dd,j=6.0,3.1hz,2h),7.33(dd,j=6.1,3.1hz,3h),7.11(dd,j=13.8,7.8hz,1h),7.00–6.78(m,3h),4.71(d,j=15.3hz,1h),4.37(d,j=15.3hz,1h),4.19(tt,j=14.0,7.0hz,1h),4.11–3.99(m,1h),3.74(d,j=14.4hz,1h),3.60(d,j=14.5hz,1h),1.20(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ169.87,165.52,163.95,161.49,147.98,137.01,130.05,124.56,123.98,116.00,115.79,115.46,114.90,114.69,63.25,58.79,51.15,45.59,13.71.lc/mscalculatedforc20h18fn3o3[m+h]+,368;found368。实施例4其中r1为烷基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和3-氟苄胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率49%。1hnmr(400mhz,cdcl3)δ7.57(dd,j=6.1,3.2hz,2h),7.31(dd,j=6.1,3.2hz,2h),7.03(d,j=8.6hz,2h),6.64(d,j=8.6hz,2h),4.51(q,j=14.8hz,2h),4.30–4.18(m,1h),4.14–4.07(m,1h),3.74(d,j=14.5hz,1h),3.66(s,3h),3.59(d,j=14.5hz,1h),1.26(d,j=2.2hz,3h).13cnmr(100mhz,cdcl3)δ169.79,165.59,159.37,148.37,136.94,130.53,126.18,123.79,115.36,113.94,63.13,58.68,55.2,50.67,45.43,13.86.lc/mscalculatedforc21h21n3o4[m+h]+,380;found380。实施例5其中r1为芳基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和3-氟苄胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率44%。1hnmr(400mhz,cdcl3)δ7.67(dd,j=6.0,3.2hz,2h),7.33(dd,j=6.1,3.1hz,2h),7.16(d,j=9.0hz,2h),6.76(d,j=9.0hz,2h),4.49–4.31(m,2h),3.80–3.66(m,5h),1.26(s,3h).13cnmr(100mhz,cdcl3)δ170.39,162.15,156.87,148.23,130.12,123.95,119.04,115.63,114.47,63.60,58.63,55.44,52.15,13.94.lc/mscalculatedforc20h19n3o4[m+h]+,366;found366。实施例6其中r1为芳基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和苯胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮杂环丁烷-2-羧酸乙酯,产率42%。1hnmr(400mhz,cdcl3)δ7.66(dt,j=6.6,3.3hz,2h),7.37–7.30(m,2h),7.25–7.18(m,4h),7.06(ddd,j=8.6,5.2,3.4hz,1h),4.48–4.31(m,2h),3.73(dd,j=30.9,14.7hz,4h),1.22(d,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ170.32,162.37,148.11,136.80,129.19,124.78,123.88,116.91,115.65,63.62,58.29,52.29,13.88.lc/mscalculatedforc19h17n3o3[m+h]+,336;found336。实施例7其中r1为芳基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和3-氯苯胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率45%。1hnmr(400mhz,cdcl3)δ7.66(dd,j=6.1,3.2hz,2h),7.41(t,j=1.8hz,1h),7.32(dd,j=6.1,3.2hz,2h),7.13(t,j=8.1hz,1h),7.01(dd,j=21.7,8.4hz,2h),4.41(tdd,j=10.7,7.1,3.6hz,2h),3.72(dd,j=34.0,14.8hz,2h),1.25(s,3h).13cnmr(100mhz,cdcl3)δ170.21,162.32,137.78,134.94,130.13,124.82,123.70,117.50,114.66,63.70,52.56,13.90.lc/mscalculatedforc19h16cln3o3[m+h]+,370;found370。实施例8其中r1为芳基,r2为氢原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯的合成,具体步骤如下:在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和4-氯苯胺(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将溴乙酸(1.0毫摩尔)和异氰化合物(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二异丙胺(dipa)(2.0毫摩尔),在微波炉中90oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用真空泵旋干得到固体。把该固体溶解在10%tfa/dce(5毫升),然后再微波120oc反应10分钟。该反应混合物使用乙酸乙酯(15毫升)稀释后,用饱和碳酸钠溶液和氯化钠溶液洗涤洗涤3次,每次20毫升。有机项使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯,产率45%。1hnmr(400mhz,cdcl3)δ11.01(s,1h),7.64(dd,j=5.8,3.1hz,2h),7.34(dd,j=6.0,3.0hz,2h),7.23–7.03(m,4h),4.48–4.25(m,2h),3.76(q,j=15.1hz,2h),1.21(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ168.69,162.20,147.32,135.78,135.12,130.05,129.24,124.74,118.12,115.40,63.92,58.69,52.27,13.85.lc/mscalculatedforc19h16cln3o3[m+h]+,370;found370。实施例9抗肿瘤活性测试的具体步骤:本发明抗肿瘤测试所用的细胞为a549,ln229,mda-mb-453,sw620和du145。细胞使用的培养液为含的青霉素一链霉素溶液的胎牛血清的dmem细胞培养液,培养条件为37℃、含5%co2的恒温培养箱。具体步骤:(1)用血球计数板对细胞进行计数后,用dmemlowglucose培养液将其稀释至5×104个/ml;(2)在96孔板的每个孔里加入100ml细胞悬液吹打混匀,培养箱37℃温育24h;(3)将所要测试化合物稀释至种浓度为10mm,按照该浓度依次加药,培养箱37℃温育48h;(4)加入浓度为5mg/ml的mtt,培养箱37℃温育4h;(5)加dmso将细胞溶解,酶标仪测490nm和630nm下的od值;(6)处理数据,根据od值计算抑制率。表1新型稠合苯并咪唑杂氮环丁酮衍生物抗肿瘤活性结果。序号化合物a549ln229mda-mb-453sw620du1451乙基2-(1h-苯并咪唑-2-基)-1-(2-溴苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯6391518192乙基2-(1h-苯并咪唑-2-基)-1-苄基-4-氧代氮杂环丁烷-2-羧酸乙酯2234247323乙基2-(1h-苯并咪唑-2-基)-1-(3-氟苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯1038131244乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苄基)-4-氧代氮杂环丁烷-2-羧酸乙酯243462245乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯32531514156乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮杂环丁烷-2-羧酸乙酯3843911187乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯36379548乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮杂环丁烷-2-羧酸乙酯630262315由测试结果可以看出,本发明所述的新型稠合苯并咪唑杂氮环丁酮衍生物可以抑制或杀灭瘤细胞,具有抗肿瘤活性,可以在治疗人肺癌、胶质瘤、肝癌、乳腺癌、结肠癌和前列腺癌的抗肿瘤药物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 苯并吲唑类衍生物及其制备方法、应用与制造工艺
- 一种二苯并环庚烷衍生物的制备方法与制造工艺
- Atropurpuran的苯并咪唑基和吗啉基衍生物组合物用于防治胰腺纤维化的制造方法与工艺
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的利记博彩app
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的利记博彩app
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的利记博彩app