利用家蚕核型多角体病毒载体系统过量表达microRNA的方法与流程
本发明涉及分子生物技术领域,具体来说是一种利用家蚕核型多角体病毒载体系统过量表达microRNA的方法。
背景技术:
家蚕(Bombyx mori)是一种有重要经济价值的昆虫,也是研究生长发育和遗传变异的重要模式生物。MicroRNA(miRNA)是一类长约20-25nt的非编码RNA,广泛存在于真核生物中,主要通过与靶mRNA的3’UTR靶位点不完全互补配对,降解mRNA或抑制靶基因翻译,进而调节生长发育、信号转导、新陈代谢等各项生命活动。利用杆状病毒表达系统过量表达家蚕miRNA,可望为研究家蚕miRNA的功能或调节机制提供新的手段。在线虫(Caenorhabditis elegans)中,let-7通过与靶基因lin-14、lin-28、lin-41、lin-42和daf-12的3’UTR端相结合来负调控靶基因,进而调控线虫幼虫晚期到成虫的发育。在哺乳动物中,let-7负调控致癌基因RAS的表达,当let-7过表达时,肺癌细胞的生长受到抑制。在果蝇(Drosophila melanogaster)的let-7缺失突变体中,幼虫的肌肉和神经维持到成虫期致使成虫出现飞行、运动和生殖缺陷;let-7通过下调基因abrupt使果蝇腹部肌肉和神经得以更新,从而保障幼虫到成虫的转变。在德国小蠊(Blattella germanica)的蛹期下调miR-100时,成虫翅膀会变小,而同时下调let-7和miR-100时导致成虫翅脉畸形,但下调miR-125后却无显著影响。在家蚕中,bmo-let-7和bmo-miR-100的表达与蜕皮激素有关,可能参与家蚕的变态发育。然而,家蚕let-7-Complex(let-7、miR-100和miR-2795)在家蚕变态发育过程中的具体生物学功能并不清楚。
杆状病毒是一类专一性感染节肢动物的DNA病毒。其中,苜蓿银蚊夜蛾(autogra phacalifornica)多核型多角体病毒(multiple nuclear polyhedro-sis virus,MNPV)(AcMNPV或AcNPV)能感染30多种鳞翅目昆虫,被广泛用作基因表达系统载体。Smith和Summers等在1983年建立了杆状病毒表达系统。1985年,Maeda等首次以来自家蚕的核型多角体病毒BmNPV为载体,在家蚕细胞和个体中高效表达α-干扰素等外源基因,开辟了以家蚕作为生物反应器生产外源蛋白的手段。目前已有数千种外源基因在昆虫NPV系统中得到高效表达。虽然利用AcNPV杆状病毒bac-to-bac表达系统在昆虫Sf9细胞中实现了miRNA的超量表达,但还未有利用BmNPV在家蚕细胞和个体中过量表达miRNA的报道。将家蚕let-7簇全长序列构建到BmNPV基因组上,在家蚕胚胎细胞系BmE和家蚕五龄幼虫特异组织中实现miRNA的超量表达,为探索miRNA的功能或调控机制提供技术手段。
技术实现要素:
本发明的目的是针对上述技术存在的问题,提供一种利用家蚕核型多角体病毒载体系统过量表达microRNA的方法。利用家蚕核型多角体病毒(Bombyx mori nuclearpolyhedrovirus,BmNPV)载体超量表达家蚕miRNA,为研究家蚕miRNA的功能提供新的思路。
为实现上述目的,本发明采用的技术方案是:一种利用家蚕核型多角体病毒载体系统过量表达microRNA的方法,步骤包括:
(1)总RNA与重组Bacmid全基因组DNA提取:用Trizol提取细胞和组织总RNA,测定RNA浓度和纯度,1.2%琼脂糖凝胶电泳检测RNA质量,然后离心收集重组Bacmid感染BmE细胞后不同时间点的细胞上清液,提取重组病毒DNA,测定DNA浓度和纯度;
(2)引物设计:从miRbase下载bmo-let-7、bmo-miR-100和bmo-miR-2795的成熟体序列,从NCBI数据库下载家蚕gapdh基因序列和BmNPV的糖蛋白gp41基因序列,运用Primer 5.0软件设计gapdh和gp41的荧光定量PCR引物;
(3)miRNA重组杆状病毒的构建:划线复苏Red-pFastBac1-let-7-C(RP-let-7-C)永久菌,挑取单菌落后扩大培养,提取质粒,用Not I和Xho I双酶切验证重组报告基因载体,取20μL RP-let-7-C质粒转化100μL E.coli DH10Bac/BmNPV感受态细胞,冰浴30min,42℃热激90s,37℃水平摇床摇1h后,取100μL细菌悬液涂布在“卡那霉素50μg·mL-1、四环素10μg·mL-1、庆大霉素50μg·mL-1、IPTG 40μg·mL-1、X-gal 100μg·mL-1”的LB固体平板上,37℃过夜培养,通过蓝白斑筛选出Tn7转座成功的重组杆状病毒BmNPV-let-7-C,以M13引物PCR验证阳性克隆,送华大基因测序鉴定;
(4)重组杆状病毒转染BmE细胞系:37℃水浴快速解冻复苏家蚕胚胎细胞系BmE,用Grace完全培养基在27℃培养箱中培养。待细胞生长状态良好,细胞密度达2-5×106cells·mL-1时,重悬细胞将其均匀铺至24孔细胞培养板,培养24h后,吸去完全培养基,每孔加入400μL无抗、无血清的Grace培养基;以不加处理的BmE细胞作为空白对照组,非重组病毒BmNPV处理的BmE细胞为阴性对照组,重组病毒处理的BmE细胞为实验组;用8μL转染试剂X-treme分别包埋1μg的BmNPV和BmNPV-let-7-C质粒,再加入100μL无抗、无血清的Grace培养基,瞬离混匀后室温孵育20min,将混合液缓慢滴入细胞孔中央,顺时针轻摇细胞板使混合液均匀分布于细胞板内,27℃培养6-8h后更换成完全培养基,通过OLYMPUS倒置荧光显微镜观察细胞的红色荧光蛋白信号;
(5)重组杆状病毒BmNPV注射家蚕幼虫:在BmNPV-let-7-C转染BmE细胞72h后,可观察到明显的红色荧光,通过5,000rpm/5min离心收集含病毒粒子的细胞上清液,然后分别用BmNPV和BmNPV-let-7-C病毒上清液感染新鲜铺板的BmE细胞,倒置荧光显微镜观察病毒感染细胞后12h、24h、48h、72h、96h和120h的细胞红色荧光蛋白信号,离心收集上述时间点的细胞材料,细胞上清液用于提取病毒DNA检测病毒拷贝数,细胞沉淀用PBS清洗后,加入Trizol裂解细胞用于提取RNA检测miRNA表达,当BmNPV-let-7-C病毒上清感染BmE细胞72h后,离心获取具强侵染活性的病毒上清液,采用TCID50和qPCR测定病毒滴度后,注射等量病毒至家蚕五龄起蚕,用消毒后的桑叶在25℃室温下正常饲养,观察幼虫生长变化,取注射后24h和72h的幼虫中肠、脂肪体和整蚕,液氮研磨后取约100μg粉末,加入1mL Trizol充分混匀以完全裂解组织细胞,提取RNA用于qPCR检测miRNA的表达;
(6)荧光定量PCR检测miRNA的表达:用Trizol提取BmE细胞和家蚕组织总RNA,1.5%琼脂糖凝胶电泳检测RNA质量,miScript II RT Kit反转录的cDNA用于miRNA定量检测,重组Bacmid基因组DNA测定浓度后,将其稀释到200ng·μL-1用于qPCR检测,即在20μL荧光定量PCR体系中加入2μL DNA模板。
优选的,步骤(2)中,所述引物为:
M13-F GTTTTCCCAGTCACGAC
M13-R CAGGAAACAGCTATGAC
Qgapdh-F CATTCCGCGTCCCTGTTGCTAAT
Qgapdh-R GCTGCCTCCTTGACCTTTTGC
Qgp-41-F CCGTTACCGTTCAATCAGCAG
Qgp41-R GTTGATGTGCGGAAAGCGA
Qlet-7 CGGTGAGGTAGTAGGTTGTATAG
QmiR-100 AACCCGTAGATCCGAACTTGTG
QmiR-2795 AAGTTTGGTGATACGCGGGC
QU6 CGCAAGGATGACACGCAA
进一步的,步骤(4)中,所述Grace完全培养基配方为Grace液体培养基+10%Gibco FBS+20万单位/升的青霉素和链霉素混合液。
本发明的有益技术效果是:本发明通过双酶切验证重组报告基因穿梭载体Red-pFastBac1-let-7-C,通过Tn7同源重组把let-7-C和报告基因转座到家蚕核型多角体病毒BmNPV基因组上,获得重组杆状病毒质粒BmNPV-let-7-C。将BmNPV-let-7-C转染家蚕胚胎细胞系BmE,用荧光显微镜观察转染不同时间后细胞中的红色荧光蛋白信号,以荧光定量PCR检测重组杆状病毒在不同时间点的增殖和miRNA的表达。离心收集转染72h后的BmE细胞上清液,用于侵染新鲜的BmE细胞,以获取具有强感染力的重组病毒上清,将其注射至家蚕五龄起蚕,分别在12h、24h和72h取幼虫组织,检测miRNA的表达。成功将let-7-C构建到BmNPV基因组上,获得BmNPV-let-7-C过表达载体。BmNPV-let-7-C转染家蚕胚胎细胞系BmE,24h后观察到红色荧光信号;72h时,荧光信号最强,重组杆状病毒的拷贝数也达最高。将重组病毒上清注射至家蚕五龄起蚕,24h后取整蚕和脂肪体检测,bmo-miR-2795显著超量表达。利用家蚕核型多角体病毒表达载体在家蚕胚胎细胞系BmE和家蚕脂肪体组织中过量表达了let-7簇miRNA,为后续研究家蚕miRNA的功能提供了可能。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
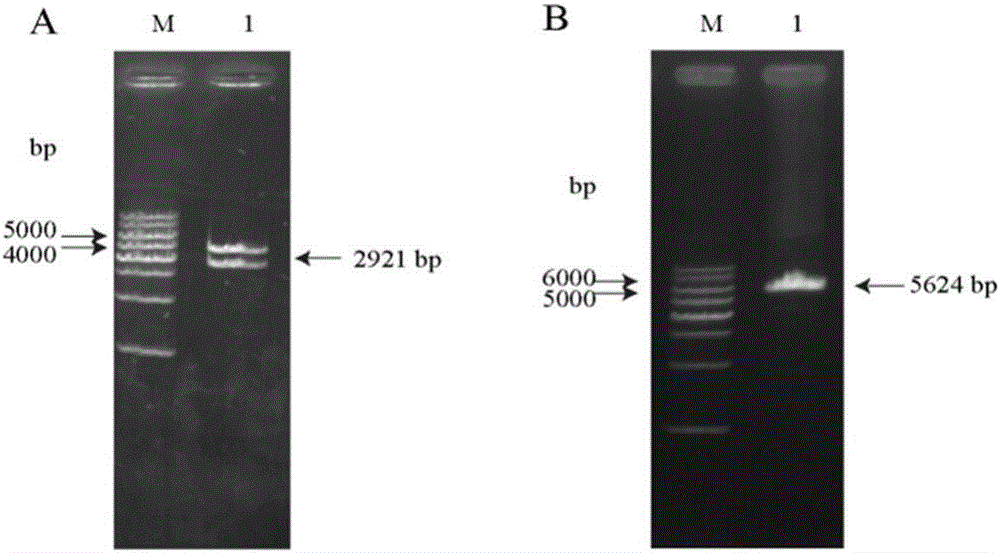
图1家蚕let-7-C重组杆状病毒表达载体构建;A:Rp-let-7-C重组质粒双酶切验证。M:TH5000DNA ladder;1:Rp-let-7-C重组质粒双酶切;B:BmNPV-let-7-C菌液PCR验证。M:1kb Ladder DNA marker(购自Promega);1:BmNPV-let-7-C的PCR产物;
图2重组杆状病毒感染BmE细胞后Red报告基因信号检测:A-F:重组杆状病毒BmNPV-let-7-C上清液感染BmE细胞分别12h、24h、48h、72h、96h和120h,72h未处理的BmE细胞(WT);H:阴性对照BmNPV上清液感染BmE细胞72h,I:重组杆状病毒BmNPV-let-7-C上清液感染BmE细胞72h,J:gp41是BmNPV糖蛋白基因,用以检测病毒DNA拷贝数;GAPDH是甘油醛-3-磷酸脱氢酶,作为病毒感染家蚕后的内参基因;
图3 BmNPV杆状病毒表达载体在细胞水平对let-7簇miRNA的过量表达:A:BmNPV-let-7-C转染BmE细胞48h后bmo-let-7的表达;B:BmNPV-let-7-C转染BmE细胞48h后bmo-miR-100的表达;C:BmNPV-let-7-C转染BmE细胞48h后bmo-miR-2795的表达;E:BmNPV-let-7-C转染BmE细胞72h后bmo-let-7的表达;F:BmNPV-let-7-C转染BmE细胞72h后bmo-miR-100的表达;G:BmNPV-let-7-C转染BmE细胞72h后bmo-miR-2795的表达
图4 BmNPV杆状病毒表达载体在个体水平对let-7簇miRNA的过量表达:A:BmNPV-let-7-C注射后72h的整蚕中bmo-let-7的表达;B:BmNPV-let-7-C注射后72h的整蚕中bmo-miR-100的表达;C:BmNPV-let-7-C注射后72h的整蚕中bmo-miR-2795的表达;D:BmNPV-let-7-C注射后72h的脂肪体中bmo-let-7的表达;E:BmNPV-let-7-C注射后72h的脂肪体中bmo-miR-100的表达;F:BmNPV-let-7-C注射后72h的脂肪体中bmo-miR-2795的表达;G:BmNPV-let-7-C注射后24h的脂肪体中bmo-let-7的表达;H:BmNPV-let-7-C注射后24h的脂肪体中bmo-miR-100的表达;I:BmNPV-let-7-C注射后24h的脂肪体中bmo-miR-2795的表达;J:BmNPV-let-7-C注射后12h的脂肪体中bmo-miR-2795的表达;K:BmNPV-let-7-C注射后24h的中肠组织中bmo-miR-2795的表达。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
(1)总RNA与重组Bacmid全基因组DNA提取:用Trizol提取细胞和组织总RNA,以核酸浓度测定仪(NANODROP2000C)测定RNA浓度和纯度,1.2%琼脂糖凝胶电泳检测RNA质量。离心收集重组Bacmid感染BmE细胞后不同时间点的细胞上清液(含重组病毒),提取重组病毒DNA,操作步骤详见MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0说明书,用核酸浓度测定仪测定DNA浓度和纯度。
(2)引物设计:从miRbase(http://www.mirbase.org/)下载bmo-let-7、bmo-miR-100和bmo-miR-2795的成熟体序列,从NCBI数据库(http://www.ncbi.nlm.nih.gov/)下载家蚕gapdh基因序列和BmNPV的糖蛋白gp41基因序列,运用Primer 5.0软件设计gapdh和gp41的荧光定量PCR引物(表1)。
表1本研究所用引物
(3)miRNA重组杆状病毒的构建:划线复苏Red-pFastBac1-let-7-C(RP-let-7-C)永久菌,挑取单菌落后扩大培养,提取质粒,用Not I和Xho I双酶切验证重组报告基因载体。取20μL RP-let-7-C质粒转化100μL E.coli DH10Bac/BmNPV感受态细胞,冰浴30min,42℃热激90s,37℃水平摇床摇1h后,取100μL细菌悬液涂布在“卡那霉素(50μg·mL-1)-四环素(10μg·mL-1)-庆大霉素(50μg·mL-1)-IPTG(40μg·mL-1)-X-gal(100μg·mL-1)”的LB固体平板上,37℃过夜培养,通过蓝白斑筛选出Tn7转座成功的重组杆状病毒BmNPV-let-7-C,以M13引物PCR验证阳性克隆,送华大基因测序鉴定。
由于BmNPV基因组上含有一个与pFsatBac1穿梭载体上Tn7同源重组的mini-attTn7结合位点,且E.coli DH10Bac/BmNPV感受态细胞中的helper质粒能够促进Tn7的同源重组,使目的基因高效地与BmNPV基因组完成整合。用Not I和Xho I双酶切重组报告基因载体RP-let-7-C(图1-A),提取RP-let-7-C质粒,转化E.coli DH10Bac/BmNPV感受态细胞。以BmNPV基因组上mini-attTn7两端的M13F/R作为PCR扩增引物,1%琼脂糖凝胶电泳检测到5,624bp目的条带(图1-B)。
(4)重组杆状病毒转染BmE细胞系:37℃水浴快速解冻复苏家蚕胚胎细胞系BmE,用Grace完全培养基(Grace液体培养基+10%Gibco FBS+20万单位/升的青霉素和链霉素混合液)在27℃培养箱中培养。待细胞生长状态良好,细胞密度达2-5×106cells·mL-1时,重悬细胞将其均匀铺至24孔细胞培养板,培养24h后,吸去完全培养基,每孔加入400μL无抗、无血清的Grace培养基。以不加处理的BmE细胞作为空白对照组(WT),非重组病毒BmNPV处理的BmE细胞为阴性对照组(BmNPV),重组病毒处理的BmE细胞为实验组(BmNPV-let-7-C)。用8μL转染试剂X-treme分别包埋1μg的BmNPV和BmNPV-let-7-C质粒,再加入100μL无抗、无血清的Grace培养基,瞬离混匀后室温孵育20min。将混合液缓慢滴入细胞孔中央,顺时针轻摇细胞板使混合液均匀分布于细胞板内,27℃培养6-8h后更换成完全培养基。通过OLYMPUS倒置荧光显微镜观察细胞的红色荧光蛋白信号。
当转染试剂包裹病毒Bacmid进入BmE细胞后,在72h可观察到一定强度的红色荧光蛋白信号,离心收集72h的细胞上清液以获取具有侵染活性的病毒粒子,用其直接感染新培养的BmE细胞。在倒置荧光显微镜下观察,发现重组Bacmid感染BmE后,在12h、24h、48h、72h和96h时,细胞中的红色荧光蛋白信号由渐强到渐弱(图2-A-2-F),72h的红色荧光蛋白信号最强。荧光信号的强弱间接反映了细胞中病毒的增殖状态,载体上的let-7簇miRNA也可能随着病毒的增殖而高量表达(图2-G-2-I);但是,随着感染时间的延长,病毒的大量累积导致细胞的营养与能源物质严重损耗,细胞从梭形变成圆形,并逐渐破裂,从而使病毒的增殖和生长受到抑制,红色荧光蛋白信号也越来越弱。
为了进一步证实重组病毒在细胞中增殖,我们提取了重组Bacmid感染BmE后12h、24h、48h、72h、96h和120h的病毒DNA,用qPCR进行定量检测,发现病毒DNA量从12h开始不断增加,在72h时达最大值,随后逐渐降低,120h的表达水平显著低于48h(图2-J),病毒DNA量的变化反映了病毒的增殖变化,这与荧光信号的变化一致。
为了检测载体上的miRNA是否伴随着病毒增殖而过量表达,我们提取了重组Bacmid感染BmE后12h、24h、48h、72h、96h和120h的细胞总RNA,qPCR检测结果表明48h的let-7、miR-100和miR-2795均显著性超量表达(图3-A和3-C)。感染后48h的WT组和BmNPV阴性对照组之间无显著变化(图3-A和3-C),但72h的BmNPV组和WT之间却有明显的差异,let-7、miR-100和miR-2795表达量明显低于WT组(图3-D和3-F)miRNA。
(5)重组杆状病毒BmNPV注射家蚕幼虫在BmNPV-let-7-C转染BmE细胞72h后,可观察到明显的红色荧光,通过5,000rpm/5min离心收集含病毒粒子的细胞上清液。然后分别用BmNPV和BmNPV-let-7-C病毒上清液感染新鲜铺板的BmE细胞,倒置荧光显微镜观察病毒感染细胞后12h、24h、48h、72h、96h和120h的细胞红色荧光蛋白信号。离心收集上述时间点的细胞材料,细胞上清液用于提取病毒DNA检测病毒拷贝数,细胞沉淀用PBS清洗后,加入Trizol裂解细胞用于提取RNA检测miRNA表达。当BmNPV-let-7-C病毒上清感染BmE细胞72h后,离心获取具强侵染活性的病毒上清液,采用TCID50和qPCR测定病毒滴度后,注射等量病毒至家蚕五龄起蚕,用消毒后的桑叶在25℃室温下正常饲养,观察幼虫生长变化。取注射后24h和72h的幼虫中肠、脂肪体和整蚕,液氮研磨后取约100μg粉末,加入1mL Trizol充分混匀以完全裂解组织细胞,提取RNA用于qPCR检测miRNA的表达。
(6)荧光定量PCR检测miRNA的表达:用Trizol提取BmE细胞和家蚕组织总RNA,1.5%琼脂糖凝胶电泳检测RNA质量。参照试剂盒说明书和我们前面所用的方法进行qPCR检测。miScript II RT Kit反转录的cDNA用于miRNA定量检测。重组Bacmid基因组DNA测定浓度后,将其稀释到200ng·μL-1用于qPCR检测,即在20μL荧光定量PCR体系中加入2μL DNA模板。
BmNPV杆状病毒过表达载体在家蚕个体中是否也能实现miRNA的过量表达?为此,我们分别收集了注射重组病毒的实验组(BmNPV-let-7-C)和注射非重组病毒的阴性对照组(BmNPV)感染BmE细胞72h后的细胞上清液,采用TCID50和qPCR共同测定到上清液中的病毒滴度分别为1.09×107PFU·mL-1和1.14×107PFU·mL-1,分别注射5μL到家蚕五龄起蚕。无任何处理的空白对照组(WT)、阴性对照组和实验组的幼虫分别隔离饲养于25℃培养箱中。注射后第3天,发现BmNPV组和BmNPV-let-7-C组的幼虫不进食、节间凸起、体壁破裂并伴有纯白色脓血流出,在注射后第4天死亡;而WT组正常进食、上簇吐丝和化蛹。qPCR检测结果表明,注射后72h的整蚕中,let-7表达量无显著差异(图4-A),miR-100的表达量只相对于WT组过量表达,与阴性对照组没有显著性差异(图4-B);而miR-2795显著性过量表达(图4-C),且过表达倍数高达40多倍。然而在72h的脂肪体组织中,阴性对照组与实验组的let-7、miR-100和miR-2795的表达量均受到显著性抑制(图4-D和4-F),这可能是因为在发病的第三天,病毒已在脂肪体中大量增殖,脂肪体被病毒损坏,基因的表达平衡被打破,从而使let-7簇miRNA的表达受到抑制。在24h的脂肪体组织中,miR-2795显著性超量表达(图4-I),let-7和miR-100呈上调趋势(图4-G和4-H),WT组和BmNPV病毒注射组无明显差异,这说明BmNPV病毒在感染的早期还没有对家蚕幼虫的生长发育造成明显破坏。脂肪体作为家蚕营养和能量的储备场所,有利于病毒载体的增殖,从而达到高效表达外源基因的目的。因此,我们取了注射后12h的脂肪体组织,qPCR检测结果显示bmo-miR-2795的表达量并无显著差异(图4-J),这也说明了病毒的复制增殖需要一定的时间。虽然bmo-miR-2795在24h的脂肪体中都能实现超量表达,但在24h的中肠组织中其表达量却无显著性差异(图4-K)。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!