一种检测CYP2C9基因多态性的ARMS引物的利记博彩app
本发明属生命科学和生物
技术领域:
,特别涉及检测CYP2C9基因第3、7号外显子突变的ARMS引物,采用普通PCR技术和凝胶电泳,可用于快速检测CYP2C9基因多态位点的突变情况。
背景技术:
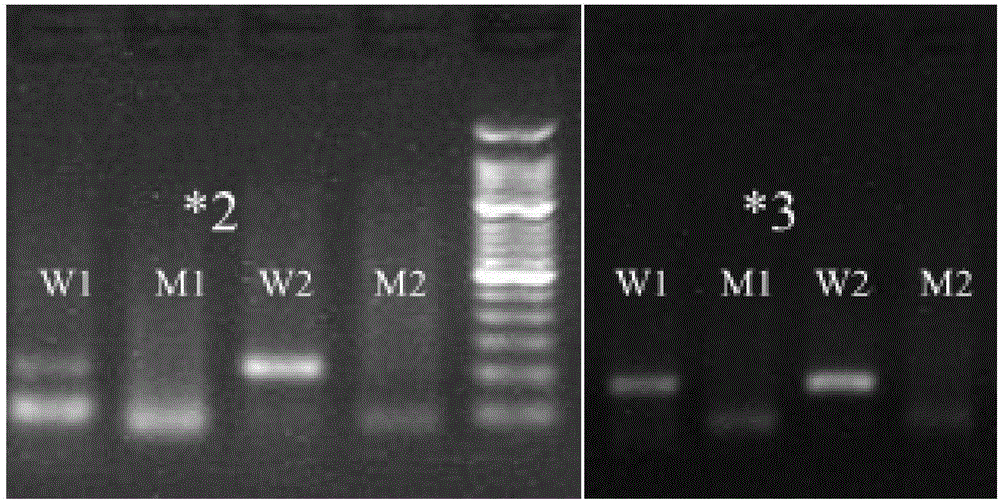
:人类基因多态性在阐明人体对疾病、毒物的易感性与耐受性,对疾病临床表现的多样性,以及对药物治疗的反应性上都起着重要的作用。CYP2C9基因位于人类第10号染色体上,总长83529bp,共10个外显子。CYP2C9是细胞色素P450酶(CYP)第二亚家族中的重要成员,占肝微粒体P450蛋白总量的20%。CYP2C9参与抗凝血药、抗惊厥药、降糖药、非甾体类解热镇痛抗炎药、抗高血压药以及利尿药等多种药物的羟化代谢,其中华法林、甲苯磺丁脲和苯妥因均为治疗指数较窄的药物。CYP2C9活性变化可导致这些药物体内浓度出现较大变化,甚至导致严重药物不良反应的发生。CYPC2C9*2(rs1799853,C430T,Arg144Cys)和CYP2C9*3(rs1057910,A1075C,Ile359Leu)均导致CYP2C9酶活性降低,CYP2C9*3纯合子个体酶活性仅为该位点野生型纯合子基因型个体(携带CYP2C9*1或Arg144/Ile359等位基因)的4-6%。中国人群中CYPC2C9*2的频率为0%,CYPC2C9*3的频率为3%。CYP2C9遗传多态性导致其酶活性变化,从而导致药物代谢种族和个体差异现象。可用于CYP2C9基因分型的方法很多,包括如DNA直接测序法、杂交芯片法、焦磷酸测序法、变性高效液相色谱法、实时荧光定量法、限制性片段长度多态性(RFLP)以及扩增阻碍突变系统(ARMS)等等。其中,DNA测序法为基因分型的金标准,但该方法在临床应用上存在一些限制:检测的灵敏度不高,费时,操作复杂,易污染,通量小等。限制性片段长度多态性仅适用于突变位点附近存在适当的特定限制性内切酶识别序列的情况,应用局限性较大。杂交芯片检测方法存在假阳性率高、退火温度要求精确,特异性不高的问题;Taqman法探针制备以及配套使用的仪器设备昂贵,准确性不高。扩增阻滞突变系统利用Taq酶没有3’→5’的外切酶活性,当3’末端碱基发生错配,不能有效扩增的原理。基因分型检测通常包括两个互补的PCR反应,使用相同的DNA模板和一条相同的共有引物和反应条件,区别仅在于与共有引物配对的ARMS引物不同,野生型ARMS引物3’末端与野生型模板匹配,突变型ARMS引物设计时将突变位点设计在3’端,与突变型模板匹配,使两个反应选择性扩增特定的DNA模板,即3’末端不匹配引物的延伸受到阻碍,通常还在3’末端2-4个碱基人为设置错配碱基,以提高错配引物的选择扩增性。技术实现要素:本发明的目的是针对现有检测CYP2C9基因多态性所存在的问题而提供一种基于ARMS-PCR的方法检测CYP2C9基因多态性的ARMS引物,可用于快速、有效检测待测者CYP2C9基因多态位点的突变情况。为了实现上述发明目的,本发明所采用的技术方案如下:针对CYPC2C9*2(rs1799853,C430T,Arg144Cys)和CYP2C9*3(rs1057910,A1075C,Ile359Leu)每个SNP的序列改变而设计的特异性ARMS引物和共用引物,特异性ARMS引物于3’末端第二位或三位引入错配碱基(下划线标记碱基),以此扩大特异性引物3’末端碱基与DNA模版上SNP位点碱基互补和不互补情况下扩增效率间的差距,从而大幅提高检测的特异性和准确性。其中:一种检测CYP2C9基因多态性的ARMS引物,包括:检测CYPC2C9*2(rs1799853,C430T,Arg144Cys)基因的引物,其碱基序列为:共用引物2C9*2-CR:CCAGTAAGGTCAGTGATATGGAGTAG;用于检测位点CYPC2C9rs1799853,C的特异性引物为下列核苷酸序列之一:2C9*2-W1:GGGAAGAGGAGCATTGAGGGCC;2C9*2-W2:GGGAAGAGGAGCATTGAGGTCC;用于检测位点CYPC2C9rs1799853,T的特异性引物为下列核苷酸序列之一:2C9*2-M1:GGGAAGAGGAGCATTGAGGGCT;2C9*2-M2:GGGAAGAGGAGCATTGAGGTCT;检测CYPC2C9*3(rs1057910,A1075C,Ile359Leu)基因的引物,其碱基序列为:共用引物2C9*3-CR:ACCTTGGGAATGAGATAGTTTCTGAAT;用于检测位点CYPC2C9rs1057910,A的特异性引物为下列核苷酸序列之一:2C9*3-W1:GTGCACGAGGTCCAGAGATAGA;2C9*3-W2:GTGCACGAGGTCCAGAGATAAA;用于检测位点CYPC2C9rs1057910,C的特异性引物为下列核苷酸序列之一:2C9*3-W1:GTGCACGAGGTCCAGAGATAGC;2C9*3-W2:GTGCACGAGGTCCAGAGATAAC。在本发明的一个优选实施例中,当检测位点为CYPC2C9*2(rs1799853)时,使用引物组合为共用下游引物2C9*2-CR以及ARMS引物对2C9*2-W2/2C9*2-M2。在本发明的一个优选实施例中,当检测位点为CYPC2C9*3(rs1057910)时,使用引物组合为共用下游引物2C9*3-CR以及ARMS引物对2C9*3-W2/2C9*3-M2。本发明操作简单、检测结果准确可靠,具体有益效果如下:1、回避了家族基因间序列相近区域,避免家族基因间序列的相近区域引起的非特异性扩增,此引物组的设计具有特异性强的优点。2、引入的碱基错配,提高了引物对SNP的识别能力,使引物能有效识别一个碱基的差异,扩大了最适退火温度范围,避免了因退火温度要求精确所导致检测结果的假阳性发生,提高了检测准确性和可靠性。3、检测方法简单,无需昂贵设备,仅需要PCR和电泳设备就能完成试验。4、操作快速便捷,检测用时短,可在2小时内完成分型工作。附图说明图1为CYPC2C9*2(rs1799853)和CYPC2C9*3(rs1057910)的分型电泳图。图中所用的marker为Takara公司的50bp的marker。最下面的条带为50bp,倒数第二条为100bp。左侧是检测样本CYP2C9*2,从左至右扩增使用的引物分别为2C9*2-W1、2C9*2-M1、2C9*2-W2和2C9*2-M2;右侧是检测样本CYP2C9*3,从左至右扩增使用的引物分别为2C9*3-W1、2C9*3-M1、2C9*3-W2和2C9*3-M2。图2为CYPC2C9*2的Sanger测序验证图谱。图中对样本使用Sanger测序检测CYPC2C9*2(rs1799853,C430T,Arg144Cys),图中框显示的是多态性位点。图3为CYPC2C9*3的Sanger测序验证图谱。对样本使用Sanger测序检测CYPC2C9*3(rs1057910,A1075C,Ile359Leu),图中框显示的是多态性位点。具体实施方式本发明依据ARMS-PCR原理,优选了CYPC2C9的8条特异性引物,包括针对rs1799853的四条特异性引物(2C9*2-W1/2C9*2-M1,2C9*2-W2/2C9*2-M2);针对rs1057910的四条特异性引物(2C9*3-W1/2C9*3-M1,2C9*3-W2/2C9*3-M2)。这8条特异性引物的3’端碱基与对应SNP位点的两种不同的碱基相互补,并在3’末端的第二位或第三位引入错配碱基,错配碱基的引入可以扩大特异性引物与互补的模版和非互补模版结合后的扩增效率差异,使特异性引物的最佳退火范围扩大,避免非特异性扩增的产生,提高了检测的准确性和特异性。经实验测试,这些引物可在55度~60度范围内进行退火,进行特异性扩增,最大可能的避免了假阳性的发生。本发明还优选了2条共用下游引物,包括针对rs1799853的2C9*2-CR;针对rs1057910的2C9*3-CR。这2条引物通过在人类基因组数据库中检测,回避了家族基因间基因序列的一致的区域,避免与目的片段外模版序列的结合,提高了扩增的特异性。本发明可选取针对同一检测位点的特异性引物中的任意一条和其对应的下游共用引物结合,组成此为点的检测引物组合,实现对检测位点的特异性扩增检测。检测位点为CYPC2C9*2(rs1799853)时,使用引物组合为共用下游引物2C9*2-CR,以及ARMS引物对2C9*2-W2/2C9*2-M2、2C9*2-W2/2C9*2-M2两对特异性引物中任意一对;检检测位点为CYPC2C9*3(rs1057910)时,使用引物组合为共用下游引物2C9*3-CR,以及ARMS引物对2C9*3-W2/2C9*3-M2、2C9*3-W2/2C9*3-M2两对特异性引物中任意一对。下面结合具体实施例和附图,进一步阐述本发明。实施例1一种基于ARMs-PCR法的CYPC2C9基因分型检测PCR扩增反应液扩增反应液为20ul,使用NEB公司的Q5hifiDNApilymerase试剂装,包含5xQ5buffer、5xGCbuffer、dNTP、Q5hifiDNApilymerase和5xGCenhancer。PCR反应管每人份2个,1~2号管为特异性反应管。具体见表1表1实施例2一种基于ARMs-PCR法的CYPC2C9基因分型检测的操作步骤(1)提取受检者全血DNA或唾液DNA,稀释成20ng/ul的DNA溶液;(2)PCR扩增:检测在常规PCR仪上进行,反应条件见表2:表2PCR扩增体系试剂配制方法见表3:表35xQ5buffer4ul5xGCbuffer4ul10mMdNTP0.4ulQ5hifiDNApilymerase0.2ul5xGCenhancer4ultemplateDNA20ng10uMForwardPrimer1ul10uMReversePrimer1ulNuclease-freewaterupto20ul(3)电泳:2%琼脂糖凝胶电泳,110V,25min。在凝胶成像系统中拍照,获得电泳结果图。根据目的条带的有无,进行基因型分析。若PCR反应管中,如无任何产物带,仅有引物二聚体带(小于100bp),判断为扩增失败。若PCR反应管中,野生型引物扩增有目的产物,而特异型ARMS引物扩增后没有条带,则判读为野生型;若PCR反应管中,特异型ARMS引物扩增没有目的产物,而野生型引物扩增后有条带,则判读为突变纯合型;若PCR反应管中,野生型引物和特异型ARMS引物扩增都有目的产物,则判读为杂合型。图中所用的marker为Takara公司的50bp的marker。样本为同一个人的基因组DNA。左侧是检测样本CYP2C9*2,从左至右扩增使用的引物分别为2C9*2-W1、2C9*2-M1、2C9*2-W2和2C9*2-M2。可以从图中看出两对引物都是野生型引物扩增有目的产物,而特异型ARMS引物扩增后没有条带,判读为野生型;右侧是检测样本CYP2C9*3,从左至右扩增使用的引物分别为2C9*3-W1、2C9*3-M1、2C9*3-W2和2C9*3-M2。可以从图中看出两对引物都是野生型引物扩增有目的产物,而特异型ARMS引物扩增后没有条带,判读为野生型。经DNA直接测序验证,如图2、图3所示,完全与上述结果一致,样本的CYP2C9*2和CYP2C9*3均为野生型。上述结果表明,本发明的ARMS引物来检测CYP2C9基因多态性的方法可靠,灵敏度高,操作简单,判读结果客观。序列表SEQUENCELISTING<110>上海派森诺生物科技股份有限公司<120>用于检测CYP2C9基因多态性的ARMS引物<130><160>10<170>PatentInversion3.3<210>1<211>26<212>DNA<213>人工序列<400>1ccagtaaggtcagtgatatggagtag26<210>2<211>22<212>DNA<213>人工序列<400>2gggaagaggagcattgagggcc22<210>3<211>22<212>DNA<213>人工序列<400>3gggaagaggagcattgaggtcc22<210>4<211>22<212>DNA<213>人工序列<400>4gggaagaggagcattgagggct22<210>5<211>22<212>DNA<213>人工序列<400>5gggaagaggagcattgaggtct22<210>6<211>27<212>DNA<213>人工序列<400>6accttgggaatgagatagtttctgaat27<210>7<211>22<212>DNA<213>人工序列<400>7gtgcacgaggtccagagataga22<210>8<211>22<212>DNA<213>人工序列<400>8gtgcacgaggtccagagataaa22<210>9<211>22<212>DNA<213>人工序列<400>9gtgcacgaggtccagagatagc22<210>10<211>22<212>DNA<213>人工序列<400>8gtgcacgaggtccagagataac22当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于HRM检测基因多态性的引物组合物的应用的利记博彩app与工艺
- MDR1基因多态性检测体系及其试剂盒的利记博彩app与工艺
- GSTP1基因多态性检测体系及其试剂盒的利记博彩app与工艺
- 一种检测MTHFR基因rs1801131多态位点基因型的方法及试剂盒与流程
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- CDA基因多态性检测体系及其试剂盒的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用