一种调控植物耐逆性的棉花WRKY转录因子GarWRKY5及应用的利记博彩app
本发明属于生物基因工程技术领域,是一种正调控植物耐逆性的棉花转录因子GarWRKY5。
背景技术:
植物在其整个生命周期的生长发育过程中,常会面临各种不同且多变的不良环境(如盐害、干旱、低温等),而这些非生物胁迫因子会对植物的生长发育造成不良的影响。农作物是人类赖以生存的重要的生物能量来源,而在非生物胁迫中,干旱和高盐作为两种主要的非生物胁迫严重影响作物的产量和品质。据联合国世界粮农组织的不完全统计,全世界各种盐渍土面积近十亿公顷,广泛分布于世界五大洲的各个生物气候带,尤其是在干旱和半干旱地区,其中分布于我国的近一亿公顷,另一方面我国地域辽阔,海岸线长,拥有大量的滩涂盐碱地。棉花被誉为盐碱地先锋作物,进一步发掘棉花抗逆能力,将棉花生产向沿海滩涂及内陆盐碱地转移是非常迫切的,是粮食安全的需要,同时对有效利用土地以及稳定植棉生产,实现农业生产的可持续发展具有十分重要的意义。
植物WRKY转录因子是近年来新发现的植物特有新型锌指型转录调控因子。WRKY通过特异结合靶基因启动子中的W盒(T)(T)TGAC(C/T),来调控靶基因的转录水平,参与植物对非生物胁迫的应答,最终使植物体内某种胁迫达到平衡。WRKY转录因子广泛分布于植物中,大量的文献报道了很多WRKY转录因子可以被高盐胁迫诱导表达,但有些也可以被高盐胁迫抑制表达。WKRY转录因子在植物的盐应答中角色的多样性,此外,很多研究也表明,单一的WRKY转录因子作为调控因子可参与多调控多重逆境胁迫以及介导不同信号通路之间的相互作用。目前,在多种植物中都已发现WRKY转录因子家族成员,并在一些模式植物的研究中解析了该转录因子在植物应答逆境胁迫的功能和调控网络,但棉花中与耐逆相关的WRKY转录因子的研究鲜少报道,因此,发掘研究并利用棉花中与逆境相关的WRKY转录因子,对棉花耐逆能力的提高具有重要的意义。
技术实现要素:
本发明的目的是提供一种调控植物耐逆性的棉花WRKY转录因子GarWRKY5及其应用。
本发明所述的调控植物耐逆性的棉花WRKY转录因子基因GarWRKY5,其cDNA核苷酸序列如SEQ ID NO.2所示。
本发明还公开了调控植物耐逆性的棉花GarWRKY5基因编码的蛋白质,具有序列表中SEQ ID NO.3所述的氨基酸序列。
本发明提供了含有上述棉花WRKY转录因子GarWRKY5的植物表达载体。更具体的是,将GarWRKY5基因克隆到pCAMBIA2301,获得pCAMBIA2301-CaMV35S-GarWRKY5植物表达载体。
本发明还公开了所述基因GarWRKY5在培育耐盐植物中的应用。具体是将GarWRKY5基因通过植物表达载体转入目的植物内。所述植物优选是模式植物拟南芥。
本发明的有益效果:利用现有的植物基因工程技术,利用电子克隆及RT-PCR技术,分离与鉴定棉花耐逆相关基因序列信息,并通过根癌农杆菌浸花法将基因转入拟南芥,经过耐逆表型鉴定证明转基因植株的耐逆力明显增强。
附图说明
图1 GarWRKY5基因全长cDNA序列的扩增结果。
图2植物表达载体pCAMBIA2301-CaMV35S-GarWRKY5的构建
(A)大肠杆菌pCAMBIA2301-CaMV35S-GarWRKY 5PCR检测电泳结果
(B)pCAMBIA2301-CaMV35S-GarWRKY5的酶切鉴定。
图3转基因植株的PCR鉴定
PCR扩增载体pCAMBIA2301-CaMV35S-GarWRKY5抗性拟南芥目的基因。
图4转基因植株的PCR鉴定与纯系植株RT-PCR鉴定
转pCAMBIA2301-CaMV35S-GarWRKY5基因拟南芥纯系在DNA与cDNA水平的鉴定。
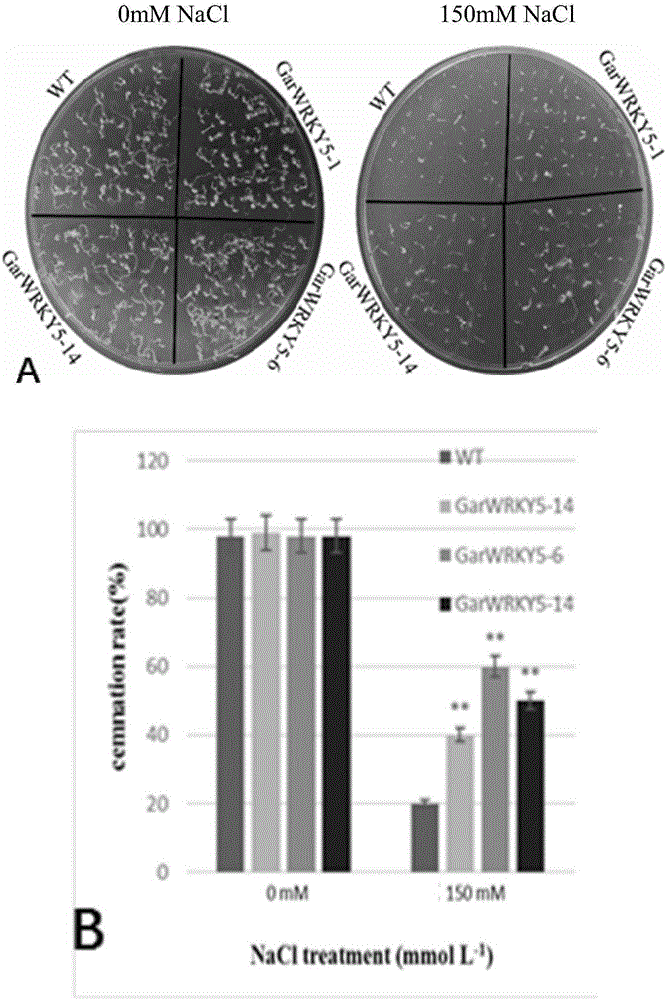
图5萌发期耐盐性的比较
在0mM和150mM NaCl的MS培养基上,野生型和转基因株系萌发期耐盐性的比较与统计分析。
图6苗期耐盐性的比较。
此图表示0mM,100mM和150mM NaCl条件下野生型和转基因株系苗期的生长情况。
图7萌发期耐旱性的比较
转基因拟南芥与野生型在MS和含20%PEG6000的MS培养基上,萌发情况的比较。
图8幼苗期耐旱性的比较
转基因拟南芥与野生型在MS和含20%PEG6000的MS培养基上,根生长情况的比较
图9苗期耐旱性的比较
用相同体积的清水和含20%PEG6000mM溶液分别处理野生型和转基因株系,观察其苗期的生长情况。
具体实施方式
实施例1、GarWRKY5基因的获得
1.1 RNA的提取
提取RNA
(1)取0.5g新鲜棉花组织,加入0.1g交联聚乙烯砒咯烷酮(PVPP),在液氮3中充分研磨至粉末,将冻粉末迅速转入10ml离心管中,加5ml CTAB提取液与500μL0.1M pH8.0的Tris-HCl,65℃水浴20min,中途翻转混匀;
(2)加等体积氯仿充分混匀,冰浴静置10min;
(3)4℃,10000rpm离心20min。分装于4个1.5ml离心管;
(4)吸上清,加入1/3体积的8M LiCl混匀,-70℃30min或-20℃过夜;
(5)4℃,10000rpm离心20min。弃上清,70%乙醇洗涤两次后,吹干沉淀溶解于30μLDEPC水;
(6)加入10U无RNase活性的DNase和25U RNase Inhabitor,10×buffer消化30min后加等体积氯仿,抽提一次;
(7)上清转移到新管中,加1/10体积的3M pH 5.2NaAc和等体积的异丙醇或2.5倍体积的无水乙醇,-20℃放置过夜或-70℃冰浴3h;
(8)4℃,10000rpm离心20min,弃上清,70%乙醇洗涤两次后溶解于30μL DEPC水。即得棉花RNA。
1.2 cDNA的合成
体系:
cDNA第一链的合成
1.3 cDNA克隆
根据本实验室旱地棉转录组测序(Xu et al.,2013)(De novo transcriptome sequencing and comparative analysis of differentially expressed genes in Gossypiumaridum under salt stress)获得的6个EST序列,序列拼接得到一长为1238pb长的序列,其核酸序列如SEQ ID NO.1所示。用软件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测完整ORF。在ORF序列两侧设计上游引物5’-AGCAAACATGTCTTGGAAC-3’(SEQ ID NO.4)和下游引物5’-CGGCCTTTCAAAACTGA–3’(SEQ ID NO.5),用旱地棉cDNA(由步骤1.2合成的)进行RT-PCR,得到包含整个编码框的GarWRKY5cDNA克隆,全长921bp(SEQ ID NO.2)(图1)。回收该片段,克隆至PTG19-T-载体(北京全式金生物技术有限公司)中鉴定、测序。参照文献cai et al.,2014(Genome-wide analysis of the WRKY transcription factor gene family in Gossypiumraimondii and the expression of orthologs in cultivated tetraploid cotton),我们将分离得到的旱地棉WRKY基因命名为GarWRKY5,其编码的氨基酸序列如SEQ ID NO.3所示。
1.3.1 PCR反应体系(50μL)
1.3.2 PCR扩增程序:94℃3min;94℃30sec,60℃30sec,72℃3min,34个循环;72℃10min;4℃保温。
C、扩增得到该基因的ORF序列,回收扩增产物,并克隆到PTG19-T载体,筛选阳性克隆,测序由上海英俊公司完成。
1.4 基因的表达分析
1.4.1 PCR反应
①以cDNA为模板,引物为
GarWRKY5-RT-F:5‘-GCCTTGTCATTTCATGGTGGA-3’(SEQ ID NO.6)
GarWRKY5-RT-R:5‘-GGGTTGTCGTTGCCTTGC-3’(SEQ ID NO.7)
②PCR反应体系:
实施例2、植物表达载体的构建
2.1 pCAMBIA2301-CaMV35S-GarWRKY5植物表达载体的构建
植物表达载体pCAMBIA2301-CaMV35S质粒(冯娟等.,2013;棉属野生种旱地棉蛋白激酶基因GarCIPK8的克隆与功能分析)。选用XbaI和KnpⅠ分别对pCAMBIA2301-CaMV35S和目的基因片段GarWRKY5进行酶切,回收载体大片段和目的基因片段,用T4连接酶连接后转化大肠杆菌Trans1-T1感受态细胞(购自北京全式金生物技术有限公司),鉴定重组子后即得到带有目的基因的植物表达载体。
pCAMBIA2301-CaMV35S质粒和目的基因片段的酶切
质粒双酶切体系如下:
于30℃酶切,反应时间≥5h。双酶切后琼脂糖凝胶对双酶切产物进行电泳检测。
GarWRKY5片段双酶切体系:
回收pCAMBIA2301-CaMV35S载体大片段和目的基因片段。
2.1.1 基因与酶切得到的pCAMBIA2301大片段的连接
连接反应体系:
2.1.2 转化大肠杆菌
连接产物转化大肠杆菌感受态细胞,在含Amp100mg/L的LB液体培养基中37℃振荡培养。
2.1.3 重组子的鉴定
①PCR鉴定(图2A)
②挑取单菌落接种于1.5mL含卡那霉素的LB液体培养基中37℃振荡培养,用GarWRKY22基因特异性引物GarWRKY5F-XbaI:5’-GCTCTAGAATGGAGAAGAAGAACGAGAA-3’(SEQ ID NO.8)和GarWRKY5R-KpnI:5'-GGGGTACCCTACTGATCTTCTTCCTTTGC-3'(SEQ ID NO.9)进行PCR扩增,琼脂糖凝胶电泳检测是否含有预期片段。PCR反应程序如下::94℃5min;94℃30sec,55℃45sec,72℃1min30sec,36个循环;72℃10min;4℃保温。质粒的酶切鉴定(图2B)
用碱变性法提取质粒,选取XbaI和KnpⅠ酶进行酶切,酶切体系同上,琼脂糖凝胶电泳检测是否有预期片段。
③pCAMBIA2301-CaMV35S-GarWRKY5提取和保存
挑取①和②鉴定的阳性单菌落接种于5mL含卡娜青霉素的LB液体培养基中37℃过夜振荡培养,用质粒提取试剂盒(AxyPrep Plasmid Miniprep Kit,康宁生命科学有限公司)提取质粒pCAMBIA2301-CaMV35S-GarWRKY5并将质粒保存在-20℃备用。
实施例3、农杆菌感受态的制备与转化
3.1 农杆菌EHA105感受态的制备
(1)挑取EHA105单菌落,接种于5ml LB液体培养基中,28℃,200rpm震荡培养过夜至OD600值为0.4;
(2)以1:100接种于400-500ml LB培养基中(1L三角瓶中),摇菌至OD600为0.6-0.8,冰浴10min;
(3)预冷的50ml离心管中收集菌液,4℃,5000rpm,离心5min;
(4)弃上清,沉淀用无菌水充分悬浮,4℃,5000rpm,离心5min;重复此过程3次,。
(5)向洗好的菌体中加1ml(根据菌体多少而定)含10%无菌甘油重悬浮细胞。
(6)分装成50μL每管,液氮速冻,置于-80℃备用。
3.2 电击法转化农杆菌感受态细胞EHA105
1.取出农杆菌感受态细胞于冰上冻融。
2.加2μl pCAMBIA2301-CaMV35S-GarWRKY5质粒DNA于50μl感受态细胞中,用枪头轻轻搅拌混匀。
3.取出细胞与质粒的混合物转入电击杯中(电击杯-20℃预冷),吸干电击杯表面的水,将电击杯放入电转化仪的电极之间,在2400V高压下电击4-5s。
4.取出电击杯,迅速加入1ml LB液体培养基不含抗生素),混匀并转移混合液到1.5ml离心管中,28℃,200rpm振荡培养3h。
5.取100ul菌液涂布于含Rif(50mg/L)和Kan(100mg/L)LB平板上,28℃倒置培养2-3天。
注:
1.细胞与质粒的混合物应沿槽壁慢慢加入电击杯中,避免产生气泡。
2.电击前擦干电击杯外侧。
3.涂板菌液量可根据菌液浓度作调整。
3.3 菌体PCR鉴定
菌体PCR方法及程序同上(同步骤2.1.4)。
3.4 含GarWRKY5基因的农杆菌的保存
挑取3.3鉴定的阳性克隆接种到5ml LB(50mg/L的Rif和100mg/L的Kan)中28℃,200rpm振荡培养1-2天直到OD600=0.6-1.0。然后向灭菌的1.5ml离心管加入灭菌的50%的甘油300μl和菌液700μl,混匀,保存于-80℃的冰箱中备用。
实施例4、转化拟南芥及转基因功能验证
4.1 浸花法侵染拟南芥
4.1.1 转化液的配置(现配现用)
1/2MSSucrose:5%silwette-77 5μl/100ml(PH:5.8)
4.1.2 转化
1.选择盆中长出约20-30个花絮的拟南芥,剪掉已成熟的果荚,转化前2-3天浇足水。
2.用接种环将3.4保存的含GarWRKY5基因的农杆菌接种到1.5ml离心管中28℃,200rpm振荡培养1-2天。
3.取5ul到50ml LB(50mg/L的Rif和100mg/L的Kan)培养基中,28℃,200rpm振荡培养直到OD600=0.6-1.0
4.700g离心5分钟
5.弃上清,收集菌体,用100ml的MS转化液重悬浮菌体备用
6.将待转化的植株倒置于MS转化液中45s(花蕾要全部浸入转化液中)。
7.套袋,暗光培样24h后至于正常培养条件下。
8.一周后再转化一次,步骤同上。
4.2 转基因阳性植株的鉴定
4.2.1 播种
1.将待播种子装于2ml的EB管中
2.70%的乙醇(v/v)消毒1-3min,无菌水洗一次
3.15%的NaClO(v/v)消毒5min,9000rpm离心2分钟
4.无菌水清洗3-5次
5.加适量的无菌水
6.4℃暗培养2-3天
4.2.2 阳性植株的鉴定
1.将收获的T0代种子播于含100mg L–1卡那霉素的1/2MS培养基上,2周后观察,转基因植株长出真叶并呈绿色,表型正常,而非转基因植株生长停留在子叶期,并且呈黄。
2.将长出真叶并呈绿色的拟南芥植株移栽到土质基质上,置于培养箱中正常培养数周
3.采集叶片进行基因组水平和转录组水平的PCR验证(图4),PCR扩增转基因植株的基因组DNA为模板,引物用基因特异性引物GarWRKY2F-XbaI(SEQ ID NO.8),GarWRKY5R-KpnI(SEQ ID NO.9),PCR反应体系和反应条件同上。
4.3 拟南芥转化系的抗性鉴定
4.3.1 转基因株系耐盐性的鉴定
4.3.1.1 转基因株系萌发期耐盐性的鉴定
选取T3代纯系拟南芥转基因种子与野生型种子,灭菌后将种子分别平铺到0mM L-1NaCl、150mM L-1NaCl的1/2MS播种培养基上,暗培养2-3d;然后放置18/22℃,16hr光照/8hr黑暗的条件下培养4d.如图5,在0mM L-1NaCl的培养基上,转基因株系与野生型的萌发无明显差异(如图5A),在含150mmol L NaCl的MS培养基上转基因植株的萌发情况,转基因植株的萌发情况明显优于野生型,统计数据结果也进一步证明转基因后代在萌发期表现出一定的耐盐性(如图5B)。
4.3.1.2 幼苗耐逆性试验的鉴定
将转基因纯系拟南芥种子和野生型种子(WT)一同播种在土质基质中。15-20天后,分别用相同体积的清水,150mM和200mM的NaCl溶液浇灌,随时观察植株的生长状况,直到表现出抗性差异。每个盆砵中9株,每次平行做3个重复,如图6,在盐胁迫环境下,转基因植株的耐盐性明显高于野生型,说明GarWRKY5在调控植物耐盐方面有一定的促进作用。
4.3.2 转基因株系耐旱性的鉴定
4.3.2.1 转基因株系萌发期耐旱性的鉴定
选取T3代纯系拟南芥转基因种子与野生型种子,灭菌后将种子分别平铺在0和20%PEG6000的MS培养基上,暗培养2-3d;然后放置18/22℃,16hr光照/8hr黑暗的条件下培养4d.如图7,在MS的培养基上,转基因株系与野生型的萌发情况无明显差异,在含20%PEG6000的MS培养基上转基因植株的萌发情况明显优于野生型,证明转基因后代在萌发期表现出一定的耐旱性。
4.3.2.2 转基因株系幼苗耐旱性试验的鉴定
选取T3代拟南芥转基因种子与野生型种子,将消毒的野生型(作为对照)及T3代纯合体种子分别平铺到MS播种培养基上,暗培养2-3d;然后放置18/22℃,16hr光照/8hr黑暗的条件下培养
当植株根长为1cm时,选取根长长势基本一致的野生型植株和转基因阳性植株植,分成两组,分别转移至含0和20%PEG6000的MS固体培养基上,8/22℃,16hr光照/8hr黑暗的条件下培养,选取转基因植株3个家系做处理,每个处理至少10株苗。继续培养10天后,观察转基因拟南芥和野生型拟南芥幼苗的根生长情况。整个生长过程中,MS平板垂直放置。结果如图8,在MS培养基上转基因型和野生型的根长无显著差异,而在含20%PEG6000的MS固体培养基上,转基因型植株的根长与野生型有显著差异,表现出明显的耐旱性。
4.3.2.2 转基因株系苗期耐旱性试验的鉴定
将转基因纯系拟南芥种子和野生型种子(WT)一同播种在土质基质中。15-20天后,分别用相同体积的清水和20%PEG6000溶液浇灌,随时观察植株的生长状况,直到表现出抗性差异。每个盆砵中9株,每次平行做3个重复,如图9,在模拟干旱胁迫环境下,转基因植株的耐旱性明显高于野生型,说明GarWRKY5在调控植物耐逆方面有一定促进作用。
- 还没有人留言评论。精彩留言会获得点赞!