一种制备融合表达重组鸡α干扰素的生产工艺的利记博彩app
本发明涉及基因重组技术领域,特别涉及一种制备融合表达重组鸡α干扰素的生产工艺。
背景技术:
干扰素是机体天然免疫系统重要的一员,其介导的抗病毒反应是天然免疫系统第一道防线。病毒入侵时,机体细胞可以通过细胞内外的模式识别受体对病毒进行识别,然后激活与干扰素相关的天然免疫信号通路,诱导干扰素基因的表达。表达的干扰素可以与其他细胞上的特异性受体结合,介导细胞内抗病毒信号的转导,产生抗病毒蛋白,从而有效抵抗病毒的入侵。
自干扰素被发现以来,人类对干扰素的应用进行了多年、深入的发明。人类干扰素的应用研发历史可以分为三个阶段,第一阶段是天然原型干扰素,主要采用病毒诱导离体的人白细胞和人源转化细胞系合成干扰素,然后分离纯化干扰素。但其缺点是白细胞来源少;诱导出来的干扰素是各个亚型的混合物,疗效一般;另外,有病毒污染的风险。第二阶段是重组干扰素,80年代起已经具备干扰素的克隆以及基因改造的技术,因此主要采用基因工程和重组技术大量制备人类干扰素,同时提高了制品的纯度和效价,但该重组干扰素在体内的半衰期短,易被清除。第三阶段是长效干扰素的研制,在第二阶段的基础上,采用PEG化修饰、白蛋白融合技术制备,改善了药代动力学过程,提高了疗效。目前人类干扰素已经大规模临床应用于治疗多种病毒性疾病,如乙型肝炎等,取得了很好的疗效。
与人类干扰素生物学功能类似,重组鸡干扰素是通过对自身免疫系统的调节来达到抗病毒的目的,与传统的化学药物、疫苗等兽用抗病毒生物制品相比,不会使病原产生耐药性突变和药物残留,因此近年来重组鸡干扰素的发明也越来越受到重视,尤其是鸡α干扰素在抗病毒感染等方面显出良好的效果。但由于目前鸡干扰素的生产过程较复杂,生产成本较高,市面上禽类重组干扰素的制品较少,还不具备大规模临床应用的条件。
技术实现要素:
本发明要解决的技术问题是克服现有技术的缺陷,提供一种制备融合表达重组鸡α干扰素的生产工艺。
为了解决上述技术问题,本发明提供了如下的技术方案:
一种制备融合表达重组鸡α干扰素的生产工艺,其包括以下步骤:
S1、根据大肠杆菌密码子的偏好性对Genebank中发表的鸡α干扰素基因序列进行密码子优化,人工合成该鸡α干扰素基因;
S2、根据密码子优化后的鸡α干扰素基因,设计三条特异性的引物:
P1 CGCCATATGTGCAACCATCTGCGCCC;
P2 CGCGAATTCTCAGGTGCGGGTGTTGCCGG;
P3 CGCCCATGGATCACAAAGTGCATCA;
S3、首先用引物P1和P2,以优化后鸡α干扰素基因作为模板,通过PCR扩增得到鸡干扰素片段,纯化回收PCR产物,用NdeI和EcoRI对纯化的干扰素片段及pCold-ProS2-ChIFN-α载体进行酶切,纯化酶切产物后连接,转化大肠杆菌DH5a菌株,筛选阳性克隆,测序确认,得到载体pCold-ProS2-ChIFN-α;
之后用引物P3和P2,以pCold-ProS2-ChIFN-α质粒为模板进行PCR扩增,得到带标签的鸡干扰素片段,对PCR产物进行纯化,之后用NcoI和EcoRI内切酶分别对pET28及PCR产物进行酶切,纯化回收后进行连接,连接产物转化大肠杆菌DH5a菌株,筛选阳性克隆,测序确认,得到目的载体pET-28b-ProS2-ChIFN-α;
S4、将测序正确的pET-28b-ProS2-ChIFN-α重组质粒转化BL21(DE3)感受态细胞,经氨苄青霉素抗性平板筛选、NdeI、EcoRI 双酶切鉴定,进一步验证该重组阳性质粒;
S5、将再次鉴定的BL21(DE3)E.coli/pET-28b-ProS2-ChIFN-α,接种于液体LB培养基,37℃震荡培养。OD值为0.6时,培养物中加终浓度为1mM的IPTG诱导表达。继续培养5h之后,离心收集菌体,进行SDS-PAGE分析,然后将SDS-PAGE凝胶上的蛋白转印至硝酸纤维素膜(NC),Western-blot检测目的蛋白。由于目的蛋白含有His标签,所以用His 标签抗体( 1∶2 000) 作为一抗,用辣根过氧化物酶标记的羊抗鼠( 1∶ 10 000) 作二抗。
进一步地,还包括以下步骤:
S6、表达产物的提取与蛋白复性纯化
S61、包涵体的提取与处理:
将1L 诱导表达的重组菌E.coli/pET-28b-ProS2- ChIFN-α 以10000 r/min离心收集菌体,按1:5的菌体超声缓冲液重悬菌体,在冰浴的条件下,充分超声破碎,其中所述超声缓冲液为50mM Tris,0.5mM EDTA,50mM NaCl,pH7.0;然后于4℃10 000 r/min 离心15 min 收集沉淀,该沉淀即为粗制包涵体;
离心收集的包涵体用洗涤缓冲液1充分悬浮,该洗涤缓冲液为150mM Tris-HCl,0.5% TritonX-100,0.5M NaCl,pH8.0,磁力搅拌30min后,以10 000 r/min,4℃,20min进行离心;
然后依次用洗涤缓冲液2和洗涤缓冲液3对包涵体进行洗涤;该洗涤缓冲液2为50mM Tris-HCl,2M Uera,1%巯基乙醇,2mM EDTA,0.15M Nacl,pH8.0;该洗涤缓冲液3为50mM Tris- HCl,4M Uera,5mM DTT,0.5M NaCl,pH8.0;
S62、包涵体的变性
按1:5的包涵体变性液比例将洗涤后的包涵体溶解于8M尿素的变性液中该变性液为50mM Tris-HCl,8M Uera,5mM DTT,pH8.0;室温磁力搅拌6小时,然后以12000rpm,4℃,20min离心,收集变性液上清,4℃保存;
S63、包涵体的复性
采取梯度稀释法进行蛋白复性,复性时采用滴管悬滴,分三次把变性液加入到预冷的中,该复性液为50mM Tris-HCl,0.15M NaCl,0.3M L-Arg,1mM GSSG,5mM GSH,10%甘油,pH7.0;每次加完后磁力搅拌5min,使变形液与复性液的比例达到1:10;完成后转入4℃冰箱,静置复性24h,通过Broadford法测定蛋白浓度,计算此重组鸡α干扰素的包涵体复性效率;
S64、镍柱亲和纯化
复性完成后,复性液经透析除去L-Arg,参照QIAGEN公司镍柱纯化说明书纯化His标签的目的蛋白,接着对纯化产物进行SDS-PAGE分析。
一种鸡α干扰素优化基因,其序列如SEQ ID NO:1所示。
一种鸡α干扰素的氨基酸,其序列如SEQ ID NO:2所示。
对于鸡α干扰素这一类具有治疗效果的生物制品来说,其本质是有生物活性的蛋白质,因此,对于这一类生物制品的开发利用,其重要的是以较低的成本生产出生物活性较高的产品,因此本研究的重点就是研究如何以较低的成本实现鸡干扰素的高效表达以及提高鸡干扰素的复性效率(复性效率指的是无活性的包涵体恢复为具有活性的天然构象后可溶性蛋白占复性前包涵体蛋白的比例),从而获得较高生物活性的鸡干扰素。本发明用到的Protein S存在于粘细菌的孢子衣中,由173个氨基酸残基组成,是一种非常稳定的可溶性蛋白质。将两个Protein S的N-末端结构域串联,再结合ProS2 Tag的作用能够促进蛋白质的正确折叠,就能使融合目的蛋白的稳定性和可溶性得到提高。本发明通过基因工程方法把鸡α干扰素基因与促溶标签ProS2连接,构建原核表达载体pET-28b-ProS2- ChIFN-α,结果显示本发明实现了鸡干扰素的高效表达,以包涵体形式表达的干扰素具有较高的复性效率,复性效率达73%,镍柱纯化后干扰素纯度在95%以上,并且最终所得的鸡干扰素具有较高的生物学活性,有利于鸡干扰素的商业化生产,对于推动鸡干扰素的临床应用具有极大的商业意义。
本发明所达到的有益效果是:
本发明根据大肠杆菌密码子的偏好性对Genebank中发表的鸡α干扰素基因序列进行了密码子优化,人工合成该鸡α干扰素序列。通过基因工程的方法,把鸡α干扰素基因与促溶标签ProS2连接,构建原核表达载体pET-28b-ProS2- ChIFN-α。诱导表达后对包涵体进行变性、复性和镍柱亲和纯化,Broadford法测定蛋白浓度结果显示此重组鸡α干扰素的包涵体复性效率达73%,SDS-PAGE检测结果显示纯化后干扰素纯度在95%以上。本发明实现了干扰素的高效表达与纯化,通过细胞病变抑制法测定出此重组ChIFN-α的抗病毒效价达7.32×107UI/mg。本发明生产的鸡干扰素复性效率高,抗病毒活性较强,对于鸡病毒性传染病的防治具有重大的意义。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
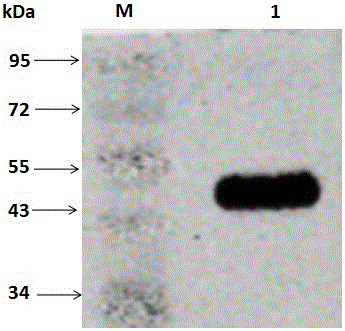
图1 为Western-blot检测表达蛋白的包涵体,检测结果显示目的蛋白表达正确;
图2 为SDS-PAGE检测纯化蛋白,检测结果显示该电泳条带单一,干扰素的纯度在95%以上;
图3为细胞病变抑制法测定重组鸡α干扰素活性,结果显示该重组鸡α干扰素作用在细胞后可以有效的抑制水泡口炎病毒的繁殖。
具体实施方式
以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
一种制备融合表达重组鸡α干扰素的生产工艺,其包括以下步骤:
S1、根据大肠杆菌密码子的偏好性对Genebank中发表的鸡α干扰素基因序列进行密码子优化,人工合成该鸡α干扰素基因;优化后的基因由英潍捷基( 上海) 贸易有限公司合成。
S2、根据密码子优化后的鸡α干扰素基因,设计三条特异性的引物:
P1 CGCCATATGTGCAACCATCTGCGCCC;
P2 CGCGAATTCTCAGGTGCGGGTGTTGCCGG;
P3 CGCCCATGGATCACAAAGTGCATCA;
S3、首先用引物P1和P2,以优化后鸡α干扰素基因作为模板,通过PCR扩增得到鸡干扰素片段,纯化回收PCR产物,用NdeI和EcoRI对纯化的干扰素片段及pCold-ProS2-ChIFN-α载体进行酶切,纯化酶切产物后连接,转化大肠杆菌DH5a菌株,筛选阳性克隆,测序确认,得到载体pCold-ProS2-ChIFN-α;
之后用引物P3和P2,以pCold-ProS2-ChIFN-α质粒为模板进行PCR扩增,得到带标签的鸡干扰素片段,对PCR产物进行纯化,之后用NcoI和EcoRI内切酶分别对pET28及PCR产物进行酶切,纯化回收后进行连接,连接产物转化大肠杆菌DH5a菌株,筛选阳性克隆,测序确认,得到目的载体pET-28b-ProS2-ChIFN-α;
S4、将测序正确的pET-28b-ProS2-ChIFN-α重组质粒转化BL21(DE3)感受态细胞,经氨苄青霉素抗性平板筛选、NdeI、EcoRI 双酶切鉴定,进一步验证该重组阳性质粒;
S5、将再次鉴定的BL21(DE3)E.coli/pET-28b-ProS2-ChIFN-α,接种于液体LB培养基,37℃震荡培养。OD值为0.6时,培养物中加终浓度为1mM的IPTG诱导表达。继续培养5h之后,离心收集菌体,进行SDS-PAGE分析,然后将SDS-PAGE凝胶上的蛋白转印至硝酸纤维素膜(NC),Western-blot检测目的蛋白。由于目的蛋白含有His标签,所以用His 标签抗体( 1∶2 000) 作为一抗,用辣根过氧化物酶标记的羊抗鼠( 1∶ 10 000) 作二抗。
进一步地,还包括以下步骤:
S6、表达产物的提取与蛋白复性纯化
S61、包涵体的提取与处理:
将1L 诱导表达的重组菌E.coli/pET-28b-ProS2- ChIFN-α 以10000 r/min离心收集菌体,按1:5的菌体超声缓冲液重悬菌体,在冰浴的条件下,充分超声破碎,其中所述超声缓冲液为50mM Tris,0.5mM EDTA,50mM NaCl,pH7.0;然后于4℃10 000 r/min 离心15 min 收集沉淀,该沉淀即为粗制包涵体;
离心收集的包涵体用洗涤缓冲液1充分悬浮,该洗涤缓冲液为150mM Tris-HCl,0.5% TritonX-100,0.5M NaCl,pH8.0,磁力搅拌30min后,以10 000 r/min,4℃,20min进行离心;
然后依次用洗涤缓冲液2和洗涤缓冲液3对包涵体进行洗涤;该洗涤缓冲液2为50mM Tris-HCl,2M Uera,1%巯基乙醇,2mM EDTA,0.15M Nacl,pH8.0;该洗涤缓冲液3为50mM Tris- HCl,4M Uera,5mM DTT,0.5M NaCl,pH8.0;
S62、包涵体的变性
按1:5的包涵体变性液比例将洗涤后的包涵体溶解于8M尿素的变性液中该变性液为50mM Tris-HCl,8M Uera,5mM DTT,pH8.0;室温磁力搅拌6小时,然后以12000rpm,4℃,20min离心,收集变性液上清,4℃保存;
S63、包涵体的复性
采取梯度稀释法进行蛋白复性,复性时采用滴管悬滴,分三次把变性液加入到预冷的中,该复性液为50mM Tris-HCl,0.15M NaCl,0.3M L-Arg,1mM GSSG,5mM GSH,10%甘油,pH7.0;每次加完后磁力搅拌5min,使变形液与复性液的比例达到1:10;完成后转入4℃冰箱,静置复性24h,通过Broadford法测定蛋白浓度,计算此重组鸡α干扰素的包涵体复性效率;
S64、镍柱亲和纯化
复性完成后,复性液经透析除去L-Arg,参照QIAGEN公司镍柱纯化说明书纯化His标签的目的蛋白进行,接着对纯化产物进行SDS-PAGE分析。
一种鸡α干扰素优化基因,其序列如SEQ ID NO:1所示。
一种鸡α干扰素的氨基酸,其序列如SEQ ID NO:2所示。
图1 为Western-blot检测表达蛋白的包涵体,检测结果显示目的蛋白表达正确;
图2 为SDS-PAGE检测纯化蛋白,检测结果显示该电泳条带单一,干扰素的纯度在95%以上。
其中,E.coli/DH5α、BL21(DE3)、VSV病毒由华南农业大学兽医学院动物传染病实验室保存;pET-28b、pCold-ProS2由华南农业大学兽医学院动物传染病实验室保存。限制酶EcoRI、NdeI及T4DNA连接酶等购置于宝生物工程(大连)有限公司。DNA片段快速回收试剂盒购于天根生化科技有限公司。
对于鸡α干扰素这一类具有治疗效果的生物制品来说,其本质是有生物活性的蛋白质,因此,对于这一类生物制品的开发利用,其重要的是以较低的成本生产出生物活性较高的产品,因此本研究的重点就是研究如何以较低的成本实现鸡干扰素的高效表达以及提高鸡干扰素的复性效率,从而获得较高生物活性的鸡干扰素。本发明用到的Protein S存在于粘细菌的孢子衣中,由173个氨基酸残基组成,是一种非常稳定的可溶性蛋白质。将两个Protein S的N-末端结构域串联,再结合ProS2 Tag的作用能够促进蛋白质的正确折叠,就能使融合目的蛋白的稳定性和可溶性得到提高。本发明通过基因工程方法把鸡α干扰素基因与促溶标签ProS2连接,构建原核表达载体pET-28b-ProS2- ChIFN-α,结果显示本发明实现了鸡干扰素的高效表达,Broadford法测定蛋白浓度结果显示此重组鸡α干扰素的包涵体复性效率达73%,SDS-PAGE检测结果显示纯化后干扰素纯度在95%以上。并且最终所得的鸡干扰素具有较高的生物学活性,有利于鸡干扰素的商业化生产,对于推动鸡干扰素的临床应用具有极大的商业意义。
本发明根据大肠杆菌密码子的偏好性对Genebank中发表的鸡α干扰素基因序列进行了密码子优化,人工合成该鸡α干扰素序列。通过基因工程的方法,把鸡α干扰素基因与促溶标签ProS2连接,构建原核表达载体pET-28b-ProS2- ChIFN-α。诱导表达后对包涵体进行变性、复性和镍柱亲和纯化,Western-blot、SDS-PAGE结果显示本发明实现了干扰素的高效表达与纯化,该重组鸡α干扰素的包涵体复性效率达73%,纯化后干扰素纯度在95%以上。通过细胞病变抑制法测定出此重组ChIFN-α的抗病毒效价达7.32×107UI/mg。本工艺生产的鸡干扰素复性效率高,抗病毒活性较强,对于鸡病毒性传染病的防治具有重大的意义。
通过细胞病变抑制法测定重组干扰素的活性:
将DF-1细胞接种于96孔细胞培养板,在37℃,5% CO2的饱和二氧化碳水汽培养箱中培养到细胞长成单层。每列加入4倍系列稀释的重组干扰素每孔100μL,同时设病毒对照和细胞对照,培养12h后,每孔加入1000TCID50的水泡口炎病毒,该水泡口炎病毒在DF-1上的TCID50为7.32。同时设定不加病毒的细胞对照。培养至24h后开始观察细胞病变,待阳性出现明显病变时进行结晶紫染色。弃细胞培养液,用无菌PBS洗1遍,于每孔中加入结晶紫染色液100μL,室温放置30min;弃染料,双蒸水冲洗没着色染料,然后每孔中加入脱色液100μL,室温放置10min脱色;运用酶标仪测定OD570值并记录;数据处理:以能抑制50%细胞病变的干扰素含量定义为一个活性单位,运用Reed-Muench法计算干扰素效价,计算重组干扰素的活性单位为7.32×107UI/mg。
图3中,1,2,3,4,分别为410,411,412,413倍稀释的鸡干扰素作用于细胞后,对细胞的抗病毒效果图;5,6,分别为阳性病毒对照,阴性对照。根据水泡口炎病毒导致的DF-1细胞病变可以判断: 1,2,3, 细胞不发生细胞病变,说明410,411,412倍稀释的鸡干扰素作用于细胞后细胞抗病毒效果显著;4出现明显细胞病变,说明在413倍这个稀释度的干扰素对细胞抵抗病毒作用不明显;5阳性对照组成立(发生细胞病变);6阴性对照组成立(不发生细胞病变)。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!