使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与流程
领域
本公开有关于使用与表面偶联的单特异性四聚抗体复合物来分离细胞的方法。
背景
在许多应用中,需要富集或者去除生物样品中的某些细胞群体。血液学、免疫学和肿瘤学领域依赖于外周血样品和来自相关组织(诸如骨髓、脾脏、胸腺和胎肝)的细胞悬浮液。从这些非均质样品中分离出特定的细胞类型对于这些领域中的研究是关键的。纯化的免疫细胞(诸如T细胞和B细胞)群体对于研究免疫功能是必需的,并且被用于免疫疗法中。对细胞、分子和生物化学过程的研究需要分析分离的某些细胞型。已经使用多种技术来分离或去除红细胞、诸如T细胞、B细胞和天然杀手(NK)细胞之类的淋巴细胞亚组和诸如嗜中性粒细胞、嗜碱性粒细胞和嗜酸性粒细胞之类的粒细胞。
已经基于诸如密度之类的物理性质和通过用单克隆抗体和诸如磁性颗粒之类的固体表面直接靶向而分离出造血细胞和免疫细胞。使用单克隆抗体从外周血和相关细胞悬浮液中分离细胞群体有两种基本方法。其不同之外在于用抗体区别/标记需要的还是不需要的细胞。在阳性选择技术中,用抗体标记所需要的细胞,且从其余未标记/不 需要的细胞中移出。在阴性选择中,标记并移出不需要的细胞。抗体和补体处理以及使用免疫毒素是阴性选择技术,而荧光辅助细胞分选(FACS)和大多数分批免疫吸附技术可以适用于阳性选择和阴性选择两者。在免疫吸附技术中,用单克隆抗体选择细胞且优先结合可以从其余细胞中移出的表面,例如珠柱、烧瓶、无磁性颗粒和磁性颗粒。免疫吸附技术已经在临床上和研究中赢得了支持,因为其保持了用单克隆抗体靶向细胞的高特异性,但不同于FACS,其可以扩大规模以直接处理临床收集物中的大量细胞,而且其避免了使用诸如免疫毒素之类的细胞毒性试剂和补体所带来的危险。
磁性分离是用于在磁场梯度下将磁性物质选择性地保留在诸如离心管或柱之类的容器内的方法。可以通过经由特异性相互作用(包括免疫亲和相互作用)使磁性颗粒与靶标表面结合而对诸如特定生物学细胞、蛋白质和核酸之类的感兴趣的靶标进行磁性标记。其他可用的相互作用包括药物-药物受体、抗体-抗原、激素-激素受体、生长因子-生长因子受体、碳水化合物-凝集素、核酸序列-互补核酸序列、酶-辅因子或酶-抑制剂结合。然后将处于合适的容器内的含有感兴趣的靶标的悬浮液暴露于具有足以使悬浮液中的靶标与其他实体分离的强度的磁场梯度。然后可以用合适的流体洗涤容器以去除未经标记的实体,从而获得感兴趣的靶标的纯化悬浮液。
针对细胞表面抗原的单克隆抗体的出现大大扩展了区别和分离不同的细胞类型的可能性。大多数磁性标记系统使用表面上共价结合有单克隆抗体或链霉亲和素的超顺磁颗粒。在细胞分离应用中,这些颗粒可以用于对需要的细胞进行磁性标记的阳性选择或对大多数不需要的细胞进行磁性标记的阴性选择。感兴趣的靶标是蛋白质或核酸的磁性分离应用将被视为阳性选择方法,因为典型地将感兴趣的靶实体捕获在磁性颗粒上。
可利用若干种市售细胞分离产品,其利用直接与抗体偶联的磁性颗粒(Miltenyi Biotec Inc.,Gladbach,Germany;Life Technologies Corp.,Carlsbad,USA;BD Biosciences,San Jose,USA)。其他方法利用以与生物素缀合的特异性抗体标记靶细胞,随后加入能结合生物素化抗体的经过链霉亲和素涂布的磁性颗粒(Miltenyi Biotec,Inc.;Life Technologies;BD Biosciences;和STEMCELL Technologies Inc.,Vancouver,Canada)。另一个例子是EasySepTM细胞分离系统(STEMCELL Technologies Inc.),其中使用双特异性四聚抗体复合物使磁性颗粒与感兴趣的细胞交联。四聚抗体复合物(TAC)是由被来自第二物种且结合来自第一物种的抗体Fc片段的两个抗体保持在四聚阵列中的来自第一物种的两个单克隆抗体构成(参见授予Lansdorp的美国专利No.4,868,109,该专利中关于TAC和其制备方法的描述以引用的方式并入本文中)。
在制备双特异性TAC时,可以形成三种不同的TAC,由此构成最终抗体组合物。如果将相等浓度的来自第一动物物种的两种不同的抗体(A和B)与等摩尔量的来自第二动物物种的交联抗体(C)组合,则25%将是针对抗体A的单特异性TAC,25%将是针对第二抗体B的单特异性TAC,且50%将是针对抗体A和B的双特异性TAC。可以控制来自第一物种的各抗体的比率以使单特异性TAC与双特异性TAC的比率偏向对其相应靶抗原具有特异性的第一或第二抗体。
如本发明中所使用,单特异性TAC对单一靶实体具有特异性。在一个实施方案中,所述单特异性TAC含有识别相同抗原表位的来自第一动物物种的两个同一的抗体,所述抗体被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。在另一个实施方案中,所述单特异性TAC含有识别相同靶抗原上的不同表位的来自第一动物物种的两个不同的抗体克隆,所述抗体克隆被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。在又一实施方案中,所述单特异性TAC含有识别相同靶实体上所表达的不同抗原的来自第一动物物种的两个不同的抗体克隆,所述抗体克隆被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。
单特异性TAC可以增加复合物对其靶实体的价态,因为TAC将具有四个抗原结合位点,相较之下,单个IgG抗体分子仅具有两个抗原结合位点。
描述直接地或经由中间受体-配体相互作用(其中受体或配体之一首先与磁性颗粒偶联)间接地与颗粒偶联的抗体的专利已经描述于美国专利US3970518A、US4230685、US8298782B2、US 7160723B2和US5543289A中,所述专利以引用的方式并入本文中。在这些例子中的每一个中,使用本领域技术人员容易显而易见的常规技术,诸如物理吸附或化学缀合来使单个或多个能识别靶实体的抗体与颗粒偶联。
诸如抗体之类的配体物理吸附至固体表面上在许多自然过程中起重要作用且在生物材料应用中保持较大效用。尽管在理解固体表面上的蛋白质吸附现象方面取得了诸多成就和进展,但关于所观察到的当蛋白质吸附至诸如烧瓶、珠柱或颗粒之类的固体表面上时发生的现象的解释迥然不同而又矛盾[1]。蛋白质吸附至固体表面上可能受许多因素影响,包括反应缓冲液的pH值和离子强度、反应温度以及蛋白质等电点。另外,尺寸、表面电荷、表面上的反应性部分也在很大程度上有助于蛋白质吸附。在蛋白质初步吸附或集中至表面上后,其可以与所述表面共价缀合。
取决于吸附条件或缀合化学反应,抗体的取向可能被约束在不允许其与其靶抗原进行功能性结合的构象下。可以通过更改吸附或缀合反应条件或通过使用首先与表面缀合的中间物来控制抗体的取向,所述表面可有助于使抗体呈以下取向:反应性Fab结合域呈从所述表面向外的取向(参见US8298782B2或US4,230,685)。即使在偶联诸如蛋白A或链霉亲和素之类的抗体结合中间物的情况下,所述中间物的偶联也可能无效,从而导致达不到理想偶联效率。
鉴于上文,在本领域中需要提供简单而又新颖的方法来改进良抗 体偶联方法,以便制备靶实体特异性表面以用于分离靶实体与非靶实体的混合物。
概述
本发明的发明人已经开发了一种将单特异性四聚抗体复合物偶联至表面上以用于分离靶实体与非靶实体的混合物的方法。发明人已经证明使单特异性四聚抗体复合物与表面偶联是对将诸多单克隆抗体以相等抗体浓度偶联至表面上以用于分离靶实体与非靶实体的混合物的现有方法的改进。
针对细胞表面抗原的单克隆抗体的出现大大扩展了区别和分离不同的细胞类型的可能性。四聚抗体复合物(TAC)是由被对第一动物物种的Fc片段具有特异性的来自第二动物物种的两个抗体保持在四聚阵列中的来自第一动物物种的两个抗体构成(参见授予Lansdorp的美国专利No.4,868,109,该专利中关于TAC和其制备方法的描述以引用的方式并入本文中)。本公开的方法说明与诸如磁性颗粒之类的表面偶联的单特异性TAC用于分离由靶实体与非靶实体构成的样品的用途。
单特异性TAC对诸如细胞之类的单一类型靶实体具有特异性。在一个实施方案中,所述单特异性TAC含有识别相同抗原表位且被识别第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中的来自第一动物物种的两个同一的抗体。在另一个实施方案中,所述单特异性TAC含有识别相同靶抗原的不同表位且被识别第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中的来自第一动物物种的两个不同的抗体克隆。在又一实施方案中,所述单特异性TAC含有识别相同靶实体(诸如细胞)上所表达的不同抗原且被识别第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中的来自第一动物物种的两个不同的抗体克隆。
本发明的方法是对现有方法的出乎意料的改进,因为对于从含有 靶实体和非靶实体的样品中分离出靶实体来说,与表面偶联的单特异性TAC比与表面偶联的单克隆抗体更有效。
在相等浓度的靶实体特异性抗体下,单特异性TAC偶联的表面在从靶实体与非靶实体的混合物中分离出靶实体时更有效。
在一个实施方案中,本公开的方法可以有效地从诸如人全血之类的复杂样品中标记和去除红细胞。
因此,在一个实施方案中,本公开提供一种在包括靶实体和非靶实体的样品中使靶实体与非靶实体分离的方法,所述方法包括:
(a)提供至少一种与表面偶联的单特异性四聚抗体复合物(TAC),其中所述TAC对所述靶实体具有特异性;
(b)在允许所述TAC偶联的表面与所述靶实体结合的条件下使所述样品与所述TAC偶联的表面接触;和
(c)从所述样品中分离出所述靶实体-TAC偶联的表面,以使所述靶实体与所述非靶实体分离。
在一个实施方案中,所述表面是颗粒,诸如磁性颗粒。磁性颗粒方法的一个益处在于因为它是免疫磁性细胞分离方法,所以它可以完全自动化,从而进一步减少样品处理并且将对诸如病毒或寄生虫之类的血液传播病原体的暴露减至最少。
所述靶实体可以是细胞、细菌、病毒、细胞器、蛋白质或核酸。
在一个实施方案中,所述靶细胞是选自由以下各项组成的群组:红细胞、淋巴细胞、单核细胞、粒细胞、肿瘤细胞、干细胞、造血祖细胞、间充质细胞、乳腺上皮细胞、神经细胞、内皮干细胞、内皮祖细胞和胚胎干细胞。
根据以下详细描述,本公开的其他特征和优点将显而易知。然而, 应该理解,详细描述和具体实施例尽管指出了本公开的优选实施方案但仅仅是以说明的方式给出,因为根据此详细描述,在本公开的精神和范围内的各种变化和更改对于本领域技术人员将显而易知。
附图简述
现在将相对于附图描述本公开,其中:
图1示出了使用与单特异性抗血型糖蛋白ATAC或抗血型糖蛋白A抗体偶联的羧基右旋糖酐磁性颗粒从人外周全血去除红细胞。
图2比较利用使用单特异性TAC偶联的磁性颗粒的免疫磁性红细胞去除法或红细胞氯化铵裂解法时对人外周血有核细胞的富集。
图3示出了使用与磁性颗粒偶联的单特异性抗CD66b TAC从人外周全血中对CD66b+粒细胞进行阳性选择。
详述
本发明的组合物和方法
本公开有关于一种与表面偶联的单特异性TAC的组合物,其用于从含有靶实体和非靶实体的样品中分离出靶实体的方法。
在一个方面,本公开提供一种在包括靶实体和非靶实体的样品中使靶实体与非靶实体分离的方法,所述方法包括:
(a)提供至少一种与表面偶联的单特异性四聚抗体复合物(TAC),其中所述TAC对所述靶实体具有特异性;
(b)在允许所述TAC偶联的表面与所述靶实体结合的条件下使所述样品与所述TAC偶联的表面接触;和
(c)从所述样品中分离出所述靶实体-TAC偶联的表面,以使所述靶实体与所述非靶实体分离。
所述方法可以用于阳性选择方案和阴性选择方案中。在阳性选择方案中,将需要的实体从样品中移出。在一个阴性选择方案中,按照选择方案将需要的实体保留在样品中,以便针对需要的实体对其余样品进行富集。
如本文中所使用,术语“靶实体”是将要通过本文中所描述的方法从样品中移出的实体。在一个优选实施方案中,所述靶实体是细胞。在一个阳性选择方案中,需要的细胞是靶细胞。在一个阴性选择方案中,需要的细胞不是靶细胞。相反,需要的细胞是非靶细胞。
在一个实施方案中,所述表面是颗粒。所述颗粒可以是磁性的或无磁性的。可用于本文中所描述的方法中的无磁性颗粒的一个例子是易浮颗粒。当被放在适当的缓冲液中时,易浮颗粒将浮动,从而允许从样品中分离出靶细胞-TAC偶联的颗粒复合物。
在一个阴性选择细胞分离方案中,需要的细胞没有用偶联的颗粒加以标记并且保留在样品中,随后移出偶联的颗粒标记的靶细胞。因此,不需要的细胞是欲从样品中去除的“靶细胞”,而需要的细胞是“非靶细胞”。在一种阴性选择细胞分离方案中,单特异性TAC将含有希望从样品中去除的靶细胞特异性抗体。因此,本公开提供一种用于在含有需要的细胞和不需要的细胞的样品中富集和回收需要的细胞的阴性选择细胞分离方法,其包括:
(a)提供至少一种与诸如颗粒之类的表面偶联的单特异性TAC,其中所述TAC对不需要的细胞具有特异性;
(b)在允许所述TAC偶联的颗粒与所述不需要的细胞结合的条件下使所述样品与所述TAC偶联的颗粒接触;和
(c)从所述样品中分离出所述靶细胞-TAC偶联的颗粒复合物,以获得富含所述需要的细胞的样品。
在一个阳性选择方案中,需要的细胞是靶细胞。在一个阳性选择 中,所述抗体组合物将含有至少一种希望从样品中去除的对需要的细胞具有特异性的抗体。因此,本公开提供一种用于从含有需要的细胞和不需要的细胞的样品中回收需要的细胞的阳性选择方法,其包括:
(a)提供至少一种与表面偶联的单特异性TAC,其中所述TAC结合需要的细胞颗粒;
(b)在允许所述TAC偶联的颗粒与所述需要的细胞结合的条件下使所述样品与所述TAC偶联的颗粒接触;
(c)从所述样品中分离出所述需要的细胞-TAC偶联的颗粒复合物,以获得富含与所述偶联的颗粒结合的所述需要的细胞的第二样品;和
(d)洗涤所述需要的细胞-TAC偶联的颗粒复合物,以获得针对与所述偶联的颗粒结合的所述需要的细胞进行纯化的样品。
在一个实施方案中,所述阳性选择方法包括对需要的细胞-TAC偶联的颗粒复合物进行解聚,以使需要的细胞与偶联的颗粒分离。所述复合物可以使用多种方法进行解聚,包括但不限于竞争、物理、化学、酶促或热离解。
可以使用多种技术将以上用于阴性或阳性选择的步骤(b)中所形成的与颗粒结合的靶细胞与无磁性非靶细胞分离。
在优选实施方案中,所述颗粒是磁性颗粒并且将含有经磁性颗粒标记的靶细胞的样品放入磁场中。经磁性颗粒标记的靶细胞向磁场迁移并且被固定就位,从而允许容易地分离无磁性非靶细胞与经磁性颗粒标记的靶细胞。
本公开的方法可以用于处理含有红细胞的生物样品,包括血液(具体来说,脐带血和全血)、骨髓、胎肝、白膜层悬浮液、白细胞去除术样品、胸膜和腹膜积液,以及胸腺细胞和脾细胞的悬浮液。所述 方法可以用于从诸如全血或完整骨髓之类的含有红细胞的生物样品中去除红细胞。
本公开的方法可以用于制备任何细胞类型的富集样品,所述细胞类型包括但不限于T细胞、B细胞、NK细胞、树突状细胞、单核细胞、嗜碱性粒细胞、肥大细胞、祖细胞、干细胞和肿瘤细胞。
在一个实施方案中,本公开的方法可以用于由诸如血液和骨髓之类的样品制备细胞制剂,所述细胞制剂富含所选分化细胞类型,诸如T细胞、B细胞、NK细胞、单核细胞、树突状细胞、嗜碱性粒细胞和浆细胞。这将使得能够研究特定的细胞与细胞相互作用,包括生长因子产生和对生长因子的反应。其还将允许对特定的细胞类型进行分子和生物化学分析。富含NK细胞、树突状细胞和T细胞的细胞制剂还可以用于针对某些恶性病的免疫疗法中。
抗体和颗粒组合物
本公开包括用于本文中所描述的方法中的抗体和颗粒组合物。
单特异性TAC将含有(a)结合靶细胞上的抗原的第一抗体,其间接地键联至(b)结合相同靶细胞的第二抗体。该两种抗体可以是同一的,或是识别相同抗原上的不同表位或相同靶细胞上所表达的不同抗原的属于相同动物物种的不同抗体克隆。
在一个优选实施方案中,将使用本领域技术人员容易显而易知的诸如物理吸附或化学缀合之类的常规技术使至少一种单特异性TAC直接与颗粒偶联。
术语“第一抗体”和“第二抗体”意指抗体组合物包括至少一种抗体类型(与一种抗体分子相反)。一种抗体类型意指结合抗原上的特定表位的抗体。举例来说,结合抗原CD3的抗体被视为一种抗体类型。
在一个方面,本公开的单特异性TAC包括(a)对靶细胞具有特异 性的一种抗体,其间接地键联至(b)对相同靶细胞具有特异性的第二抗体。“间接地键联”意指抗体(a)和抗体(b)彼此不是直接共价键联,而是通过诸如免疫学复合物之类的键联部分连接。在一个优选实施方案中,所述抗体组合物含有至少一种针对靶细胞的抗体(a),其通过制备单特异性四聚抗体复合物而间接地键联至对相同靶细胞具有特异性的第二抗体(b)。单特异性四聚抗体复合物可以通过混合来自第一动物物种的能够结合靶细胞的单克隆抗体与等摩尔量的针对第一动物物种的抗体Fc片段的属于第二动物物种的单克隆抗体来制备。来自第一动物物种的抗体还可以与约等摩尔量的针对第一动物物种的抗体Fc片段的属于第二动物物种的单克隆抗体的全长或F(ab')2片段反应。
术语“至少一种单特异性TAC”意指至少一种TAC直接偶联至单一颗粒。在一个优选实施方案中,单特异性TAC对诸如细胞之类的单一靶实体类型具有特异性。在一个实施方案中,所述单特异性TAC含有识别相同抗原表位的来自第一动物物种的两个同一的抗体,所述抗体被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。在另一个实施方案中,所述单特异性TAC含有识别相同靶抗原上的不同表位的来自第一动物物种的两个不同的抗体克隆,所述抗体克隆被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。在又一实施方案中,所述单特异性TAC含有识别相同靶细胞上所表达的不同抗原的来自第一动物物种的两个不同的抗体克隆,所述抗体克隆被识别所述第一动物物种的Fc片段的来自第二动物物种的两个抗体保持在四聚阵列中。
在允许至少一个TAC偶联的颗粒与一个靶细胞结合的条件下将TAC偶联的颗粒与样品混合。
在一个优选实施方案中,将使用本领域技术人员容易显而易知的诸如物理吸附或化学缀合之类的常规技术使至少一种靶细胞特异性 单特异性TAC直接与颗粒偶联。
在本公开的上下文内,抗体应理解为包括单克隆抗体和多克隆抗体、抗体片段(例如Fab和F(ab')2)、嵌合抗体、双功能或双特异性抗体。抗体应理解为如果它们以适当的亲和力(缔合常数),例如大于或等于107M-1结合,则对靶细胞或红细胞表面上的所选抗原具有反应性。
在本公开的抗体组合物中,优选地使用单克隆抗体。对有核细胞表面上的所选抗原具有特异性的单克隆抗体可以使用本领域技术人员容易显而易知的常规技术容易地获得或生成。
本公开还涵盖适体或嵌合抗体衍生物,即,组合了非人动物可变区与人恒定区的抗体分子。嵌合抗体分子可以包括例如来自小鼠、大鼠或其他物种的抗体的抗原结合域与人恒定区。已经描述了多种用于制造嵌合抗体的方法,并且可用于制造含有识别分化细胞或肿瘤细胞表面上的所选抗原的免疫球蛋白可变区的嵌合抗体。参见例如Kim和Hong[2]。
以下非限制性实施例说明本发明:
实施例
实施例1
四聚抗体复合物的制备
为了制备用于本公开的方法中的单特异性四聚抗体复合物,可以使用以下方案:(a)取1mg对靶细胞上的抗原具有特异性的抗体(例如抗红细胞(血型糖蛋白A)、CD8、CD16、CD19、CD36、CD56、CD66b等);(b)加入1mg P9抗体或0.68mg P9F(ab')2抗体片段。在37℃下孵育过夜。关于制备四聚体的更多信息,参见授予Lansdorp的美国专利No.4,868,109,其以引用的方式并入本文中。分开制备并入了针 对不同靶细胞上所表达的抗原的不同抗体的单特异性四聚抗体复合物。
分开地将用不同的抗体制备的单特异性TAC与颗粒偶联。通过组合不同的偶联颗粒来制备偶联颗粒混合液,这取决于希望去除哪些细胞。各种单特异性TAC的浓度不同:典型地,针对有核细胞上所表达的抗原的抗体是以2.5-400ug/mL处于单特异性TAC中。然后将偶联颗粒组合物1/20稀释至细胞中,故各抗细胞抗体在细胞悬浮液中的最终浓度在0.125-20ug/mL之间。各颗粒的最终浓度在0.05-5mg/mL之间。
实施例2
与磁性颗粒偶联的单特异性TAC的制备
为了制备用于本公开的方法中的偶联有单克隆抗体或单特异性TAC的颗粒,可以使用以下方案:(a)取单独200ug抗血型糖蛋白A抗体,或与200ug P9抗体结合而呈四聚抗体复合物形式的200ug抗血型糖蛋白A抗体;(b)加入80mg羧基右旋糖酐磁性粒子;和(c)在15℃至37℃下孵育隔夜,以促进抗体或单特异性TAC被动吸附至磁性颗粒上。然后将组合物1/20稀释至样品中,故抗血型糖蛋白A抗体的最终浓度在1-10ug/mL之间。磁性颗粒的最终浓度在0.4-4mg/mL之间。
在另一个实施方案中,使用本领域技术人员容易显而易知的常规技术进行抗体或TAC与磁性颗粒的化学交联。说明本公开的非限制性例子将是抗血型糖蛋白A单特异性TAC与羧基右旋糖酐磁性颗粒的EDC-NHS交联。然后将抗血型蛋白A单特异性TAC偶联颗粒1/20稀释至样品中,故抗血型糖蛋白A抗体在单特异性TAC中的最终浓度在1-10ug/mL之间。
实施例3
使用直接与磁性颗粒结合的对抗血型糖蛋白A具有特异性的单特异性四聚抗体复合物从人外周全血中对外周血有核细胞进行免疫磁性阴性细胞富集的方法。
以下阐述使用磁性细胞分离从人外周全血中富集外周血有核细胞的阴性选择方案。
1.每毫升人外周全血加入50uL与磁性颗粒偶联的单特异性血型糖蛋白A TAC。
2.在室温下孵育5分钟。
3.用与起始全血样品相等体积的磷酸盐缓冲盐水(PBS)稀释样品并且轻轻混合。
4.将含有样品的管子放入磁铁中。
5.在室温下孵育5分钟。
6.在将样品管保留在磁铁内的同时从样品中移出富集的细胞。
7.将与步骤1中相等体积的偶联颗粒加入经过稀释的富集样品中。
8.在室温下孵育5分钟。
9.将含有样品的管子放入磁铁中。
10.在室温下孵育5分钟。
11.在将样品管保留在磁铁内的同时从样品中移出富集的细胞。
12.需要的细胞现在处于新的管子中且随时可使用。
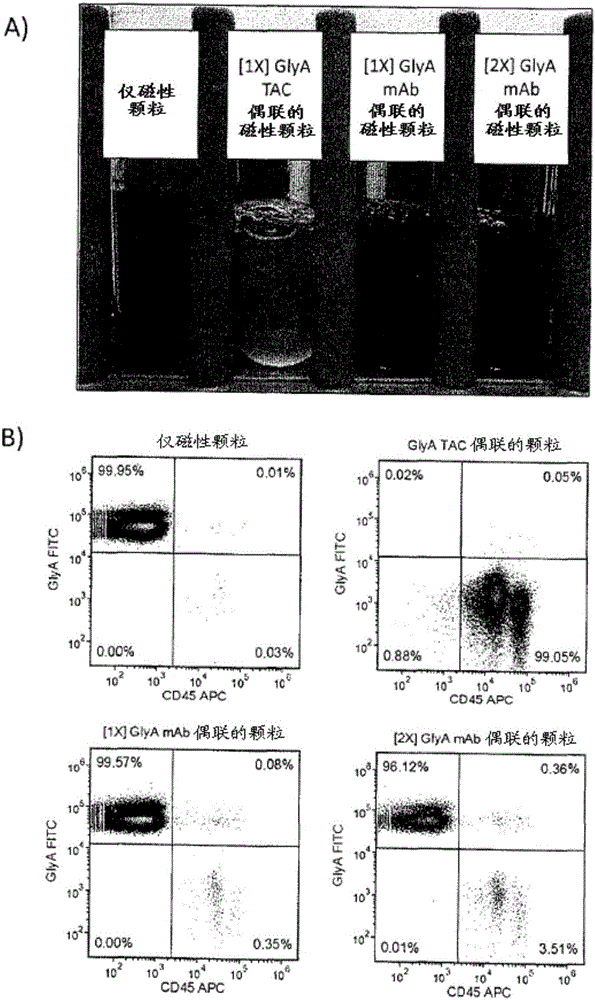
本实施例说明,可以使用上述方法,使用与磁性颗粒偶联的抗血 型糖蛋白A单特异性TAC去除作为人全血的主要组分的红细胞。如图1B)中所示,在使用以上所描述的方法,使用与磁性颗粒偶联的血型糖蛋白A单特异性TAC进行红细胞去除后,99.05%的富集细胞是CD45+GlyA-,相比之下,当向人全血中加入单独磁性颗粒时,99.95%是CD45-GlyA+。
实施例4
使用直接与磁性颗粒结合的对抗CD66b具有特异性的单特异性四聚抗体复合物从人外周全血中对粒细胞进行免疫磁性阳性选择的方法。
以下阐述使用磁性细胞分离从人外周全血中分离出粒细胞的阳性选择方案。
1.每毫升人外周全血加入5uL与磁性颗粒偶联的单特异性抗CD66b TAC。
2.在室温下孵育5分钟。
3.用与起始全血样品相等体积的PBS稀释样品并且轻轻混合。
4.将含有样品的管子放入磁铁中。
5.在室温下孵育5分钟。
6.在将含有需要的细胞的样品管保留在磁铁内的同时从样品中移出含有不需要的细胞的上清液。
7.从磁铁中移出含有需要的细胞的管子并且用PBS对含有需要的细胞的样品管进行再悬浮。
8.将步骤4-7再重复两次,总计三次5分钟磁性分离。
9.经偶联颗粒标记的需要的细胞现在随时可使用。
本实施例说明,可以使用与磁性颗粒偶联的抗CD66b单特异性TAC从人全血中阳性选择粒细胞。如图3中所示,可以使用以上所描述的方法阳性选择粒细胞且富集至74.7%。
实施例5
在存在与磁性颗粒偶联的抗血型糖蛋白A抗体对比与磁性颗粒偶联的抗血型糖蛋白A单特异性TAC的情况下的人红细胞去除的比较。
本实施例说明使用与抗血型糖蛋白A抗体或抗血型糖蛋白A单特异性TAC偶联的磁性颗粒从人全血中对红细胞进行免疫磁性去除(图1)。使用实施例3中所描述的方法,使用血型糖蛋白A特异性单克隆抗体或单特异性TAC偶联磁性颗粒去除人全血中的红细胞。如实施例1中所描述来制备抗血型糖蛋白A单特异性TAC。如实施例2中所描述来制备抗血型糖蛋白A单克隆抗体或单特异性TAC偶联磁性颗粒。A)最终样品的图像,其比较(从左至右)无任何抗体的单独磁性颗粒、与磁性颗粒偶联的单特异性抗血型糖蛋白A TAC、与相等量的磁性颗粒偶联的相等浓度的抗血型糖蛋白A单克隆抗体、和与相等量的磁性颗粒偶联的双倍浓度的抗血型糖蛋白A单克隆抗体。对于单特异性TAC,如果考虑使抗小鼠IgG1抗体交联,则使抗血型糖蛋白A的浓度加倍会产生相等的总抗体浓度。有效地去除了红细胞的唯一样品是用与磁性颗粒偶联的单特异性抗血型糖蛋白A TAC分离的样品。B)用抗血型糖蛋白A(GlyA)FITC和抗CD45APC对富集的样品进行染色,且通过流式细胞术加以分析,以通过评估CD45+/GlyA-细胞在富集的样品中的百分比来确定红细胞去除程度。单独磁性颗粒获得0.03%的CD45+/GlyA-细胞。单特异性抗血型糖蛋白A TAC偶联的磁性颗粒获得99.05%CD45+/GlyA-细胞。相比之下,相等浓度的与磁性颗粒偶联的单克隆抗血型糖蛋白A抗体仅获得0.35%CD45+/GlyA-。将血型糖蛋白A单克隆抗体的浓度加倍使CD45+/GlyA-细胞微增至3.51%。
实施例6
使用单特异性血型糖蛋白A TAC对红细胞进行免疫磁性去除相较于对人外周全血中的红细胞进行氯化铵低渗裂解后的富集的外周血有核细胞的比较。
本实施例说明,与标准氯化铵裂解程序相比,使用与磁性颗粒偶联的单特异性血型糖蛋白A TAC对人外周血有核细胞进行免疫磁性富集获得类似频率的细胞群体(图2)。使用根据实施例3的方法或标准氯化铵低渗裂解和洗涤来去除红细胞。用抗CD4或CD19FITC、抗CD8或CD56PE、抗CD3PerCP-Cy5.5和抗CD45APC对富集的样品进行染色,且通过流式细胞术加以分析。基于CD45+细胞对样品进行闸选,且通过FSC/SSC闸选或通过细胞表面标记物的表达来鉴别群体(n=6)。
实施例7
使用与磁性颗粒偶联的抗CD66b单特异性TAC从人外周全血中对粒细胞进行免疫磁性阳性选择。
本实施例说明根据实施例4中所描述的方法使用与磁性颗粒偶联的单特异性抗CD66b TAC从人全血中对粒细胞进行免疫磁性阳性选择(图3)。用抗CD45对氯化铵裂解的全血和阳性选择的样品进行染色,且通过流式细胞术加以分析。基于CD45+细胞对样品进行闸选且基于高FSC和SSC闸选来鉴别粒细胞。在起始全血样品中,54.8%的CD45+细胞是粒细胞。在免疫磁性阳性选择后,74.7%的CD45+细胞是粒细胞。
尽管已经参考目前被视为优选实施例的内容描述了本发明,但应理解本发明不局限于所公开的实施例。相反,本发明意图涵盖所附权利要求书的精神和范围内所包括的各种修改和等效配置。
所有出版物、专利和专利申请都以全文引用的方式并入本文中, 其程度就如同明确地且个别地指出各个别出版物、专利或专利申请是以引用的方式并入。
参考文献
1.Rabe,M.,Verdes,D.and SeegerS.(2011).Understanding protein adsorption phenomena at solid surfaces.Advances in Colloid and Interface Science.162.87-106.
2.Kim,J.H.,and Hong,H.J.(2012).Humanization by CDR Grafting and Specificity-Determining Residue Grafting.In P.Chames(Ed.),Antibody Engineering:Methods and Protoco/s(2nd Edition.pp.237-245).New York:Humana Press。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺