一种规模化质粒纯化的联合液相层析分离方法与流程
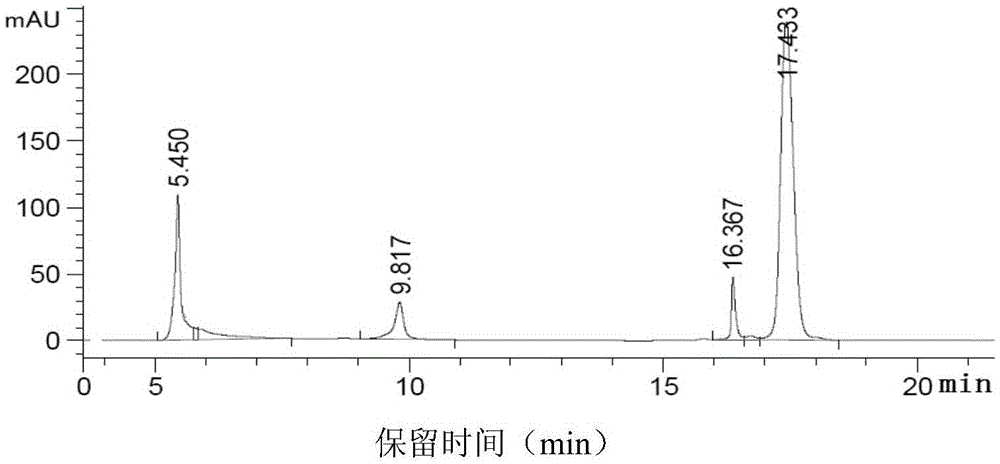
本发明涉及生物医药领域,具体涉及基因疫苗、基因治疗所用质粒的纯化分离工艺,更具体地说,涉及规模化质粒纯化的联合液相层析分离方法。技术背景质粒(pDNA)核酸疫苗是正在开发的新型疫苗,具有诱导机体产生细胞免疫应答的优点,对于治疗目前没有有效疫苗的慢性乙型肝炎、艾滋病、结核病、癌症等需要诱导细胞免疫力的疾病具有良好应用前景,质粒纯化技术也从实验室阶段向实用产业化阶段发展。质粒是大肠杆菌细胞内能独立于染色体进行复制和表达的环形DNA。工程质粒是将大肠杆菌质粒经基因工程改造,在其中插入了编码病原体保护性抗原蛋白的编码基因,和/或优选的免疫增强性细胞因子编码基因等。将纯化的工程质粒注射入人体肌肉等部位,能在相关抗原加工处理细胞(AntigenPresentCell,APC)或肌肉细胞中表达所编码的抗原,诱导机体产生体液和细胞免疫应答反应来抵御消灭病原体和癌细胞。迄今较好而实用的质粒纯化方法的发展主要有:1)采用Qiagen公司首先提出的硅胶吸附法质粒提取试剂盒进行纯化,该方法必须采用得自牛胰腺的牛RNAse酶和能专一结合内毒素将其除去的化学试剂,主要用于实验室研究的小量质粒提取或兽用核酸疫苗的制备[1];2)由美国通用(GE)公司(原安玛西亚Amersham-Pharmarcia)创立并于2003-2005年逐步完善的颗粒介质中压液相多步(琼脂糖凝胶过滤+疏水层析+阴离子交换)层析分离法;和3)近年由欧洲BIA公司(总部位于奥地利的BIASeparations公司)创立推出的氯化钙沉淀+整体柱二步(阴离子交换+疏水层析)中压液相层析分离法。后两种方法不用牛RNAse酶和可能有毒的化学试剂,而细菌内毒素基本上不结合这类介质,可在多步层析分离过程中被逐步洗涤去除无须专门处理,从而适合于规模化药物级核酸疫苗的制备,但这两种方法各有自己的优点和缺点,详述于下。目前,液相层析分离介质的基质材料可分为二大类,一类是已运用多年的颗粒或多孔颗粒分散园球状琼脂糖基质,如美国通用(GE)公司使用的,以及后续改进的理化稳定性和刚性更强的高度交联琼脂糖基质系统材料,它们具有更高的分离效率,更好的稳定性和更快的流速;另一类是固定相整体柱(Monoliths)层析分离基质系统CIM(ConvectiveInteractionMedia,对流性相互作用介质)材料。Monoliths为单一连续整体结构,是以大量紧密相联的均一孔径(1.2-1.5微米)放射状网络通道(形同硬质海棉块)基质(甲基丙烯酸缩水甘油酯-co-乙二醇二甲基丙烯酸酯)组成的园盘状、园桶状或管状整体柱,通道壁骨架含有大量反应基团,可进行各种需要的化学修饰高密度地连接不同配基,通道孔高度互联无盲端和死腔,流动相在其中可高速对流传输,分子动态结合能力(dynamicbindingcapacity,DBC)和分辨率受流速的影响很小,分离速度比多孔颗粒球形介质的经孔扩散渗透快10-20倍,其单一连续的整体结构导致稳定性极高和耐压,可耐受2-10Mpa高压,而颗粒介质低于0.5Mpa。从而,可实现生物大分子如核酸、蛋白质等的低压和高通量高效分离纯化。与颗粒介质柱相比,整体柱体积小,动态结合能力(载量)高,高流速高通量缩短了生产时间减少了超螺旋质粒的变构或降解,且携带使用方便,没有颗粒介质柱的装填柱、测柱效、预防和排气泡、拆柱再装填等烦恼,操作人员更乐于使用。颗粒液相层析分离系统有:凝胶过滤(又称分子筛)层析,阴阳离子交换层析,疏水层析和亲和层析四大类介质;Monoliths液相层析分离系统没有凝胶过滤而有其他三类层析分离介质。此二系统均已成功地建立了自身体系的质粒纯化方法,并且在继续研发新的氨基酸-DNA亲和介质改进提高开环与超螺旋质粒的分离效果。目前从培养的工程菌制备pDNA时,第一步普遍采用碱裂解法裂解含pDNA的大肠杆菌。此法可使大肠杆菌碎片、细菌的几乎全部基因组gDNA和细胞壁、绝大部分细菌蛋白质、脂类、多糖等形成大块凝聚物,通过离心或过滤而除去,遗留在裂解上清液中的主要成分为细菌自身的RNA,内毒素及少量细菌蛋白质和pDNA。其中与分子量较大的均一pDNA相比,细菌RNA是分子量较小而大小不均一的混合物,在凝胶电泳中呈现为位于pDNA单一致密条带下方的云雾状弥散带,但其含量比pDNA高8-12倍,是纯化pDNA时要去除的主要杂质。BIA公司当前推荐的正式pDNA纯化方法包括以下基本步骤[2,3]:1)第一步:用碱裂解法裂解含质粒的大肠杆菌,在裂解上清液中加入终浓度0.5-1.0M的氯化钙(CaCl2),通过Ca++离子结合大部分RNA形成沉淀而离心去除,然后取上清液用德国产SartobrainP0.45/0.22μm囊式过滤器过滤又去除一部分Ca++离子结合的RNA,同时除去伴随的内毒素;2)第二步:向澄清裂解液加入数倍TE(10-50mMTris-HCl+10mMEDTA,pH7.2)液或纯净水使其电导率降至35-40ms/cm,然后不浓缩直接加载(上样)到CIMDEAE弱阴离子交换柱上,pDNA和剩余的RNA均结合于柱内孔道壁的配基,用0.6MNaCl-TE液洗涤除去结合不牢固的RNA,再用1.0MNaCl-TE液洗脱得到pDNA组分。此二步主要作用是去除RNA和收集pDNA组分;3)第三步:在收集的pDNA组分中加入终浓度3.0M的硫酸铵混合溶解均匀,加载(上样)到CIMC4(丁基)疏水层析分离柱使质粒吸附,然后用1.7M硫酸铵-TE液洗涤除去开环(oc)质粒和残留的内毒素等所有其他杂质,再用0.4M硫酸铵-TE液洗脱得到纯化的超螺旋(sc)质粒组分,其纯度的各项指标,包括细菌gDNA\RNA\内毒素等均可达到GMP(生产质量管理规范)的要求;将该纯化组分用常规法脱盐、浓缩、过滤除菌得到最终的药物级质粒。本发明人在采用BIA推荐的正式方法纯化质粒的数十次实验中,对裂解液沉淀所用的氯化钙浓度,两个整体柱的洗涤、洗脱液浓度等对纯化质粒的质和量的影响进行了仔细研究,发现:1)裂解液中加入CaCl2结合RNA形成的沉淀颗粒有大有小,大的可离心除去,小的需通过0.45/0.22μm囊式过滤器过滤才能除去,因此对所用过滤器的质量要求高,否则这些小颗粒可能堵塞柱体中的孔道减少其使用寿命。2)CaCl2沉淀去除RNA不完全,而且会同时去除相当部分的质粒,严重减少其回收。3)BIA方法依仗其整体柱的高通量高流速对裂解澄清液不浓缩,还因含0.5-1.0MCaCl2而需要加数倍体积的TE液稀释降低电导率,从而使CIMDEAE柱的上样体积大大增加而未能缩短加工时间;并且质粒依靠所带电荷或疏水基团与介质配体的结合在高速水流(如8ml整体柱允许的最高流速为100ml/min)的冲击下不够牢固而可能部分丢失。4)CIMDEAE弱阴离子交换柱标示的核酸载量为6-8mg/ml(8ml柱48-64mg),由于CaCl2处理过的裂解液仍含有不少RNA,它们竞争占据柱中的结合位点而减少了pDNA的结合和回收,即该柱不能满载回收pDNA。本发明人用8mlCIMDEAE柱进行了多次实验,其pDNA回收大都为16-18mg仅为其载量的1/3,未能充分发挥CIMDEAE柱的载量优势。5)采用高灵敏HPLC分析用上述BIA推荐的二步层析分离方法获得的最终纯化质粒,仍含有微量的细菌RNA。因此需要对BIA推荐的质粒纯化方法进行改进,本发明人通过大量实践研究从而完成了本发明。因此,本发明目的是提供一种在超滤浓缩细菌裂解液大大减少处理量后联合应用颗粒基质层析柱与整体层析柱的规模化质粒纯化方法。技术实现要素:本发明提供一种用于药物级核酸pDNA疫苗规模化制备的质粒纯化方法,该方法联合应用颗粒介质液相分离系统与整体柱液相层析分离系统,包括以下步骤:1)对宿主大肠杆菌的碱裂解液进行超滤浓缩,2)在中压液相层析分离装置中,将浓缩裂解液加载到颗粒介质凝胶过滤柱进行层析分离,收集第一峰质粒组分,去除后续的RNA大峰;3)将所得质粒组分加载到CIMC4疏水整体柱或氨基酸-DNA亲和整体柱进行层析分离,洗涤去除主要杂质,洗脱收集超螺旋质粒组分;4)将所得超螺旋质粒组分加载到CIMDEAE离子交换整体柱进行层析分离,洗涤去除残留杂质,洗脱收集得到纯化的超螺旋质粒组分。本发明方法中,第1)步的超滤浓缩可采用截留分子量100kD-500kD的常规超滤装置,将细菌碱裂解液浓缩5-10倍,较佳为浓缩过程中通过渗滤洗滤浓缩8-10倍。所述常规超滤装置选自PES(聚醚砜)或改性PES材质制成的切向流中空纤维超滤装置。本发明方法中,第2)步采用的颗粒介质凝胶是高度交联的琼脂糖凝胶介质,凝胶柱的平衡和洗涤液为TE液,加载的浓缩裂解液体积为柱体积的10-35%。本发明方法中,第3)步和第4)步先分别测定所加载质粒组分液体中的质粒含量,根据CIMC4疏水整体柱或氨基酸-DNA亲和整体柱和CIMDEAE离子交换整体柱的核酸总载量,分别计算出所加载的上一步质粒组分液的体积,再将该体积的质粒组分液加载相对应整体柱进行层析分离去除杂质。具体地说,这两步中所加载的上一步所得质粒组分液的体积略高于按各柱核酸总载量计算出的体积。较佳的是,第3)步先在所得质粒组分中加入固体或高浓度硫酸铵溶解至硫酸铵终浓度2.5-3.0M,再加载到2.5-3.0M硫酸铵-TE液平衡的CIMC4疏水整体柱或氨基酸-DNA亲和整体柱,采用相对中浓度的硫酸铵-TE液洗涤去除杂质,采用相对低浓度的硫酸铵-TE液洗脱收集超螺旋质粒组分。更佳的是,第3)步采用CIMC4柱时,先在所得质粒组分中加入固体或高浓度硫酸铵液溶解成2.5-3.0M硫酸铵浓度后再加载到已用该浓度硫酸铵-TE液平衡的CIMC4疏水整体柱上,采用1.5-1.7M硫酸铵-TE液洗涤去除杂质,采用0.2-0.4M硫酸铵-TE液洗脱收集超螺旋质粒组分;采用氨基酸-DNA亲和整体柱时,按照出品该整体柱公司提供的资料制备平衡、洗涤和洗脱液后,平衡该柱,洗涤除去oc质粒,洗脱收集sc质粒组分。较佳的是,第4)步中,将第3)步收集的sc质粒组分液用纯净水或TE液稀释后,加载TE液平衡的CIMDEAE离子交换整体柱,采用低浓度NaCl-TE液洗涤去除所有残留杂质,采用中浓度NaCl-TE液洗脱收集得到纯化的超螺旋质粒组分。更佳的是,第4)步采用0.5-0.6MNaCl-TE液洗涤去除所有残留杂质,采用0.8-1.0MNaCl-TE液洗脱收集得到纯化的超螺旋质粒组分。在第3)步中,除去的主要杂质包括开环质粒和内毒素;第4)步中,去除的残留杂质包括所有残留杂质。本发明方法中,所有装置(包括超滤浓缩装置、颗粒介质凝胶过滤柱、CIMC4疏水整体柱、氨基酸-DNA亲和整体柱和CIMDEAE离子交换整体柱)分别连续使用2-3次,然后经“清洁”和“再生”处理后重新使用。本发明的一个优选实施方案是提供一种用于药物级核酸pDNA疫苗规模化制备的联合中压液相层析分离方法,在用碱裂解法裂解含质粒的大肠杆菌收集澄清裂解液后,包括以下步骤:第一步采用载留分子量100kD-500kD的超滤装置快速浓缩大肠杆菌碱裂解澄清液,所述超滤装置优选PES(聚醚砜)或改性PES材质做的切向流中空纤维超滤浓缩装置,并在超滤时加入纯净水或TE液渗滤,降低裂解液的盐浓度,将裂解液浓缩5-10倍,优选浓缩过程中通过渗滤洗滤浓缩8-10倍,以大大减少下一步所用的层析分离柱体积和操作时间;然后,在中压液相层析分离装置,如BIO-RAD公司的NGC系统、GEHealthcareLifeScience公司的Akta系统或其他简易中压液相层析分离装置上,进行下述第二、第三和第四步:第二步采用高度交联琼脂糖凝胶颗粒层析分离柱,例如Bestrose6FF凝胶柱,将10-35%柱体积的浓缩裂解液加载到已用TE液平衡的该柱上进行层析分离,以TE液洗涤,收集洗涤下来的第一峰pDNA组分,丢弃第二大峰细菌RNA和其他杂质,继以TE液平衡此柱;如此连续重复进行第二、第三次浓缩裂解液层析分离,合并各次的pDNA组分;然后对该柱进行清洁和再生处理后,可重新用于下一轮层析分离。第三步采用Monoliths整体结构的CIMC4层析柱或氨基酸-DNA亲和整体柱,将固体硫酸铵或4.0M硫酸铵液加入第二步得到的质粒pDNA组分液中均匀溶解至硫酸铵终浓度2.5-3.0M,然后将计算出所加载的上一步质粒组分液的体积加载到已用2.5-3.0M硫酸铵-TE液平衡的CIMC4柱上进行高通量快速液相层析分离,加载完毕继续以1.5-1.7M硫酸铵-TE液洗涤除去开环(oc)质粒,再以0.2-0.4M硫酸铵-TE液洗脱并收集超螺旋(sc)质粒组分;然后用TE液洗涤,继以2.5-3.0M硫酸铵-TE液平衡;如此对第二步得到的质粒pDNA组分液连续进行第二、第三次层析分离,合并各次的超螺旋质粒组分;采用氨基酸-DNA亲和整体柱时,按照出品该整体柱公司提供的资料制备平衡、洗涤和洗脱液后,平衡该柱,洗涤除去oc质粒,洗脱收集sc质粒组分并合并;然后对该柱进行清洁和再生处理后,可重新用于下一轮层析分离。第四步采用Monoliths整体结构的CIMDEAE层析柱,在第三步得到的sc质粒组分合并液中加入纯净水或TE液稀释使其电导率降至38-40ms/cm,取计算出所加载的上一步质粒组分液的体积加载到已用TE液平衡的CIMDEAE层析柱上,进行高通量快速液相层析分离,用0.5-0.6MNaCl-TE液洗涤除去所有残存杂质后,再用0.8-1.0MNaCl-TE液洗脱并收集超螺旋(sc)质粒组分;然后以TE液洗涤并平衡后可对第三步得到的sc质粒组分液连续重复进行第二、第三次层析分离,合并已纯化的各次超螺旋质粒组分;然后对该柱进行清洁和再生处理后,可重新用于下一轮层析分离。此后是常规程序,将第四步得到的已纯化的超螺旋(sc)质粒组分液合并,用常规超滤浓缩器材和方法,优选合格的切向流中空纤维超滤浓缩装置对其进行洗滤脱盐、更换液体并浓缩至所需浓度。这最后一步处理的是已高度纯化的质粒,对处理用的仪器、管道、用水、容器、环境等清洁净化的GMP要求非常严格,应避免再带入内毒素造成污染。BIA公司推荐方法是先用CIMDEAE柱后用CIMC4柱。本发明先用CIMC4柱或将来上市的新型氨基酸-DNA亲和整体柱,后用CIMDEAE柱,这样所得纯化的超螺旋质粒液含0.8-1.0MNaCl,对其除用超滤法脱盐并浓缩外,也可采用常规酒精或异丙醇沉淀质粒,高速离心后收集无盐的沉淀质粒组分,用生理盐水或适当缓冲液复溶至所需浓度。便于生产厂家根据自己的设备条件进行选择。经脱盐更换液体并浓缩至所需浓度后,再按GMP要求常规过滤除菌、分装、(或冷冻干燥)制成纯化质粒产品。正式生产时,上述各步骤应在GMP设施中一切按照国家的GMP要求进行,这是现代生物制药业技术人员熟知的共识和基本要求,在此不作赘述。术语细菌“湿重”指离心收集培养的大肠杆菌,倒尽离心罐中的液体后,对罐底沉淀的含少许水份的(湿)细菌秤取的重量。术语“浓缩x倍”指通过超滤减少溶液保留溶质使溶液的体积缩小到原先的几分之一,如原先的五分之一即为浓缩了五倍,原先的十分之一即为浓缩了十倍,优选浓缩8-10倍。术语“渗滤”指裂解液浓缩过程中,当浓缩到原始体积的约1/5或1/6时,在该初步浓缩液中加入大约等体积的纯净水或TE液再继续浓缩,可渗透去除一些盐份和小分子RNA,如此2-3次。“洗滤”指渗滤浓缩后从进水管注入一些纯净水,将中空纤维小管壁上贴附的质粒冲洗下来增加回收,如此2-3次。最后浓缩8-10倍。“中压液相层析装置”是一种现代高科技生物制药用装置,其结构包括计算机控制的水泵、管路、接头、阀门;和压力、流速、紫外及电导检测器及荧光显示屏等等。将层析柱连接入该装置管路后,通过水泵灌注各种液体,荧光屏可实时以连续曲线和数字方式显示流经管道出口处液体的压力、流速、体积、紫外吸收度和电导等数据,当核酸或蛋白质流出时,显现紫外吸收峰,可在出口处收集紫外峰包括的液体体积。术语“凝胶过滤”和“分子筛”二者含意相同,指层析分离时,所用介质颗粒不会结合液体中的任何成分,这些成分只是依据其分子量,先大分子后小分子依次流出而分离。“氨基酸-DNA亲和整体柱”是欧洲(葡萄牙和斯洛文尼亚)科研人员近年正在研发的已在国际杂志上公开发表的新型整体柱,其分离oc与sc质粒的效率比C4整体柱更好。这类整体柱的通道壁骨架分别连接了组氨酸、精氨酸、赖氨酸、辛胺,或羰基二咪唑(CDI)等配基,兼有疏水作用+离子交换+亲和多种功能,可发挥不同程度的选择性,其核酸动态结合载量可高达5-11mg/ml。科研人员初步研究了他们各自的层析分离条件。例如,对L-组氨酸配基或1-苄基-L-组氨酸配基整体柱,可用1.3MNaCl-柠檬酸(或乙酸)缓冲液pH5.0平衡和1.7MNaCl-(50mM)柠檬酸缓冲液pH5.0洗涤去除oc质粒,以2.08NaCl-柠檬酸缓冲液pH5.0洗脱得到sc质粒,再以3.0MNaCl-柠檬酸缓冲液pH5.0洗涤除去RNA(离子交换条件);也可用2.9或2.0M硫酸铵-TEpH8.0液平衡和洗涤去除oc质粒,以1.32M硫酸铵-TE液pH8.0洗脱得到sc质粒,再以1.29MNaCl-TE液pH8.0洗涤去除RNA(疏水条件)[4,5]。对于精氨酸配基整体柱,可用0.56MNaCl-TE液pH8.0平衡和洗涤除去oc质粒,以2MNaCl-TEpH8.0洗脱得到sc质粒[6]。预计经过进一步改进后,在不久的将来就会在市场上正式推出这类整体柱产品和相应的优选层析分离条件。术语“加载”,“上样”和“上柱”含意相同,指在液相层析时,将准备好的液体(也称为样品液)加入层析柱中,进行层析分离其中诸成分。术语“洗涤”或“洗去”指离子交换、疏水及亲和层析分离时,灌注的液体使弱贴附或弱结合于层析柱介质(配基)的杂质成分洗下而去除;术语“洗脱”指灌注的液体使结合于层析柱介质(配基)的所需成分,如质粒脱离而流出收集之。术语“高通量”和“高流速”二者含意基本相同,指层析分离时单位时间内灌注进出层析柱的液体量大流速快,从而缩短加工时间减少超螺旋质粒的变构变性。整体离子交换层析柱、疏水层析柱或氨基酸-DNA亲和柱的“核酸载量”或“动态载量”指生产厂家标示的该柱介质在液体流动状态下所能结合的最大核酸(包括RNA和DNA)量,包括每ml介质能结合的核酸mg量,和该柱所能结合的核酸总量(总载量)。本发明第3)步和第4)步中所述的“计算出所加载的上一步质粒组分液的体积”指对上一步准备好的样品液测定其质粒浓度后,以略高于BIA公司CIM各种层析柱产品所标示的核酸总载量,计算出要加入此柱的各样品液的体积。例如,样品液质粒含量80μg/ml,某柱的标示总载量为64mg,可加载820-850ml(含65.6-68mg质粒)的该样品液。本发明第3)步和第4)步中所述的“相对中浓度”、“相对低浓度”、“中浓度”和“低浓度”是相对于“2.5-3.0M的高浓度”而言,即低于2.5-3.0M浓度或更低,如1.2-2.0M为中浓度;0.2-0.8M为低浓度等。术语“清洁”指中空纤维超滤浓缩装置、6FF凝胶柱、CIM各种整体柱连续使用2-3次后,必须分别以3-5倍或10-20倍柱体积(CV)的0.5-1.0MNaOH液洗涤清除残留的内毒素等杂质,再以纯净水或TE液洗去NaOH液,称为“清洁”。每轮分离采用清洁后的装置和层析柱,方能保证最终纯化的质粒液内毒素水平低于10EU/mg,否则将受前次用后残留的内毒素污染而超过此标准。以相应的平衡液平衡层析柱后,使其能接受下一次或下一轮层析的样品液称为“再生”此层析柱。附图的简单说明图1显示20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml浓度的纯化HG85abA质粒液和两个裂解液样品的层析峰图,及峰高与浓度的标准曲线。图2为BIA氯化钙沉淀法CIMDEAE层析步骤用0.7MNaCl洗脱HG85abA质粒组分的HPLC分析。图3为本发明方法CIMC4层析步骤所得HG85abA质粒组分的HPLC分析。图4为本发明方法含HG85abA质粒的DH5α大肠杆菌浓缩澄清裂解液经6FF凝胶柱液相层析分离图。图5为本发明方法含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液经6FF凝胶柱液相层析分离图。图中细线为缓冲液的电导线,粗线是紫外吸收线,以下同此。图6为氯化钙(终浓度0.2M)沉淀后含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液经6FF凝胶柱液相层析分离图。图7为氯化钙(终浓度0.4M)沉淀后含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液经6FF凝胶柱液相层析分离图。图8为BIA法用0.5-1.0M不连续NaCl梯度液洗脱CIMDEAE结合组分的层析分离图。图9为说明图8洗涤去除RNA组分和收集洗脱质粒DNA组分的示意图。图10为BIA法CIMC4液相层析步骤采用不连续递减浓度硫酸铵梯级液洗涤或洗脱的层析分离图。具体实施方式下面结合实施例与附图和表格,更具体地说明本发明的内容,并对本发明作进一步阐述,但这些实施例绝非对本发明有任何限制。本领域技术人员在本说明书的启示下对本发明实施中所作的任何变动都将属于本发明权利要求书的范围内。主要实验装置和材料BIO-RAD公司的NGC中压液相层析分离装置GELifeScience公司的NanoVuePlus超微量核酸测定仪Agilent(安捷伦)Technologies公司的1260HPLC高效液相色谱仪用含抗结核杆菌治疗基因的HG85abA质粒(4.4kb)转化DH5α大肠杆菌的发酵罐培养物(菌),该质粒衍生自Invitrogen公司的pVAX1原始质粒[7]。用含广谱抗肿瘤治疗基因的SVK-CAVA质粒(15kb)转化XL10-gold大肠杆菌的发酵罐培养物(菌)[8,9,10]。分析纯Tris、EDTA、NaOH、乙酸钾(KAC)、氯化钙(CaCl2)、NaCl、硫酸铵、浓HC1等化学制剂购自中国医药集团化学试剂公司。实施例1:碱裂解法裂解细菌和中空纤维超滤浓缩的基本方法用纯净水配制以下三种液体:P1液:50mMTris-HC1+10mMEDTA,pH8.0;P2液:0.2MNaOH+1%SDS;P3液:3MKAC用冰乙酸调节至pH5.5。离心沉降收集发酵罐培养的质粒转化大肠杆菌,称湿重。在刻度大玻璃或塑料瓶中按每克菌加入P1液10ml均匀重悬细菌,继加入P2液20ml快速搅拌8-10秒钟裂解细菌,静置6-8分钟呈淡黄色胶状液,移至冰浴中加入经4-10℃预冷的P3液15ml(每克湿重菌也可采用P1:P2:P3=15ml:15ml:15ml比例)搅拌8-10秒钟静置20分钟,出现漂浮的大块黄白色凝聚物(如采用BIA的氯化钙法,观看刻度所示裂解液体积,据此计算出终浓度0.5-1.0M所需氯化钙用量,称取该量的固体氯化钙边搅拌边逐步加入裂解液中溶解;静置30分钟左右)。将裂解液全部移入离心罐内5000-10000rpm离心20-30分钟,弃沉淀取上层清液用国产0.45μm囊式过滤器或德国产SartobrainP0.45/0.22μm囊式过滤器过滤后测量体积。用载留分子量100kD或300kD的中空纤维(材质为PVDF或PES)超滤浓缩装置(上海蓝景膜工程技术公司专制)超滤,浓缩缩小体积5-10倍,优选通过渗滤洗滤浓缩8-10倍。得到的全部浓缩裂解液再经0.45μm滤器过滤澄清才能上层析柱,这是各种液相层析分离法对上柱液的普遍要求。实施例2:测定各步骤诸组分的pDNA含量和分析核酸各组分比例的方法(1)用小6FF柱检测裂解液和浓缩裂解液中质粒含量的方法采用博格隆公司的4.4mlBestrose6FF小柱和配制1.0MKAC液a)制作质粒浓度标准曲线取事先纯化的质粒液用GE公司的NanoVuePlus超微量核酸测定仪测定准确浓度后,用1.0MKAC液制作20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml浓度的系列稀释液各1.2ml。在BioRadNGC中压层析仪上用1.0MKAC液平衡6FF小柱至基线;取上述一份稀释液1.0ml上样,流速1.0ml/min,电脑屏上出现峰后隔4-5分钟再上样第二份稀释液;5个浓度液体全部跑完出峰后,电脑屏幕上显示各自对应的峰高与面积,用仪器内的相应软件制作峰高(或峰面积)与对应质粒浓度的标准曲线。b)测样品中的质粒含量:用1.0MKAC液平衡6FF柱后,取裂解液样品1.0ml上样,流速1.0ml/min;如果预计其质粒含量较高(如浓缩裂解液),可先用1.0MKAC液作适当稀释。裂解液产生两个相连的峰,前面的较小峰为质粒峰,根据其峰高或峰面积,查标准曲线得出质粒的浓度。每种质粒需制作自身的标准曲线。图1A为20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml浓度的纯化HG85abA质粒液和两个裂解液样品的层析峰图;图1B为峰高与浓度的标准曲线。(2)测定第二、三、四步各组分核酸含量的方法采用NanoVuePlus超微量核酸测定仪,开通电源→选择LifeScience→选择测定DNA→选择稀释系数1.000→在样品检测点滴加3μl纯净水→按下100%T键调零→再滴加3μl样品用的同一缓冲液,按下100%T键调零→在样品检测点滴加3μl样品液,按下100%T键屏幕显示核酸浓度μg/ml和260/280nm比值(1.75-1.85为质粒纯度合格)。此法适合不含或含很少RNA的第二、三、四步组分的质粒(DNA)含量测定。(3)用HPLC分析样品中核酸组分的组成比例采用Agilent(安捷伧)Technologies公司1260高效液相色谱(HPLC)仪和日本TOSOH公司的TSKgelDNA-NPR分析柱(W00039)(4.6mmIDx7.5cm,2.5μm),流速0.5ml/min,上样体积20μl,流动相A:20mMTris-HCL(pH=9),流动相B:20mMTris-HC1+1MNaCl(pH=9),检测波长260mm,所有检测液预先经过0.45μm滤膜过滤后上分析柱。图2是BIA氯化钙沉淀法CIMDEAE层析步骤用0.7MNaCl洗脱HG85abA质粒组分的HPLC分析图。图中,保留时间5.5min左右的峰为溶液电解质峰,9.5min左右的峰为RNA峰,16min左右的峰为OC质粒峰,17min左右的峰为SC质粒峰。该图显示0.7MNaCl洗脱质粒组分含有少量RNA,大部分为pDNA(oc+sc质粒)。图3是本发明方法CIMC4层析步骤所得HG85abA质粒组分的HPLC分析图,该图显示本发明方法CIMC4层析步骤所得质粒组分几乎没有RNA,全部都是pDNA,其中oc质粒峰很小,比例低于5%。实施例3:裂解液通过凝胶过滤液相层析分离pDNA组分去除RNA的基本方法在BIO-RAD公司的NGC中压液相层析分离装置上,采用博格隆(上海)生物技术公司的1升或0.5升Bestrose6FF凝胶柱,以TE(10-50mMTris-HC1+10mMEDTA,pH7.2)液平衡后,加载中空纤维超滤浓缩后经0.45μm滤器过滤的澄清裂解液。加载量经预实验确定。上样完毕继续用TE洗涤,收集先下来的大分子第一峰即为pDNA组分,然后下来的RNA大峰丢弃之,二者的峰面积比通常为1:8-12之间。继以TE液洗涤至电脑屏上出现平直基线后,再进行第二、第三次上样分离收集pDNA组分。然后需用3CV(柱体积)的0.5MNaOH液清洁(主要目的是去除残留的内毒素)该柱,用洁净水洗尽NaOH以TE液平衡后再用,或灌入20%酒精保存。所述预实验目的是确定能使pDNA第一峰与后续RNA大峰明显分开的最大上样量,视宿主大肠杆菌和质粒种类不同而不同,通常为10%-35%柱体积。经预实验确定,DH5α大肠杆菌培养的含4.4kbHG85abA质粒细菌裂解液上样量为柱体积(CV)的30-35%(见图4);XL10-gold大肠杆菌培养的含15kbSVK-CAVA质粒细菌裂解液上样量为柱体积的10-15%(见图5、6、7)。图4为本发明方法含HG85abA质粒的DH5α大肠杆菌浓缩澄清裂解液(上样体积为柱体积的35%)经6FF凝胶柱液相层析的分离图,显示前面的pDNA峰与后面的RNA大峰明显分开,可分别收集或丢弃。图5为本发明方法含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液(上样体积为柱体积的20%)经6FF凝胶柱液相层析的分离图,显示前面的pDNA峰与后面的RNA大峰融合,表明上样液体积过多二峰不能分开。图6为氯化钙(终浓度0.2M)沉淀后含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液(上样体积为柱体积的12%)经6FF凝胶柱液相层析的分离图,显示前面的pDNA峰与后面的RNA大峰(比图5不用氯化钙沉淀的RNA大峰小许多)分开,表明上样液体积适当。图7为氯化钙(终浓度0.4M)沉淀后含SVK-CAVA质粒的XL10-gold大肠杆菌浓缩澄清裂解液(上样体积为柱体积的12%)经6FF凝胶柱液相层析的分离图,显示前面的pDNA峰与后面的RNA大峰分开,表明上样液体积适当。与图6相比RNA峰更小,表明采用更高浓度氯化钙沉淀去除了更多的细菌RNA,但RNA峰后退不明显,提示上样液体积不能增加过多(也许可以增加到15%)。以含SVK-CAVA质粒的XL10-gold大肠杆菌裂解液为例,用6FF凝胶过滤层析分析BIA法裂解液加氯化钙沉淀去除RNA的效果,比较了分离的pDNA:RNA峰面积,不加氯化钙为1:11.3,加终浓度0.2M氯化钙为1:6.9,加终浓度0.4M氯化钙为1:3.74,加终浓度1.0M氯化钙为1:1.5。表明BIA法氯化钙沉淀去除RNA不够满意。本发明方法第一第二步质粒回收率实例:取HGAg85abA质粒转化的DH5α大肠杆菌45.5克经碱裂解后得到2430ml澄清裂解液。用小6FF柱测得其中质粒含量36μg/ml总量87.5mg。经中空纤维超滤浓缩至550ml,质粒含量140μg/ml总量77mg。此步质粒回收率88%。通过1L体积Bestore6FF柱液相层析分离二次,收集含质粒的第一峰合并约800ml,质粒含量87μg/ml总量69.6mg,此步质粒回收率90.4%。回收的质粒组分经凝胶电泳成像检测没有RNA条带。实施例4:BIA法中裂解液加入不同浓度氯化钙对pDNA回收的质和量的影响(1)分析BIA法裂解液中加入不同浓度氯化钙对pDNA回收量的影响每次取含HG85abA质粒(4.4kb)的DH5α大肠杆菌,或含SVK-CAVA质粒(15kb)的XL10-gold大肠杆菌同批培养菌各20克,按实施例1方法裂解,将DH5α菌裂解液不加或加0.9M氯化钙处理,浓缩后加载6FF凝胶柱过滤;XL10-gold菌裂解液不加或加不同浓度氯化钙处理,浓缩后或加载6FF凝胶柱过滤,或直接加载CIMDEAE柱进行液相层析分离,收集各自质粒组分用NanoVuePlus超微量核酸测定仪测定其质粒浓度(μg/ml),乘以体积计算出质粒总得量,并用HPLC分析部分样品中的RNA比例,表1列举几次实验的结果:表1从表1可见,裂解液中加氯化钙可造成相当部分的质粒同时被沉淀而损失,加氯化钙越多质粒损失越大,0.9-1.0M终浓度的氯化钙可导致50-65%的质粒损失。(2)分析BIA法裂解液中加不同浓度氯化钙对CIMDEAE步骤所得质粒组分纯度的影响取含HG85abA质粒的DH5α大肠杆菌20克一式多份,按实施例1方法分别裂解并在裂解液中加入不同终浓度的氯化钙,将所得裂解液浓缩后分别上CIMDEAE柱,用0.52MNaCl液洗涤去除吸附的大部分RNA后,用1.0MNaCl液洗脱收集质粒组分,取各质粒组分样品作HPLC分析,结果见表2。表2裂解液中加入的氯化钙终浓度(M)0.520.60.70.80.91.0质粒组分中的RNA比例(%)11.4813.4611.853.942.112.34质粒组分中的oc+scpDNA比例(%)88.5286.5488.1596.0697.8997.66可见BIA法在裂解液中加氯化钙虽可去除大部分RNA,再经CIMDEAE层析步骤中的0.5MNaCl液洗涤又去除了一些RNA,但遗留结合于柱上的RNA仍不少,它们与质粒一起被1.0MNaCl液洗脱。裂解液中加入的氯化钙浓度越高(0,8-1.0M),CIMDEAE层析所得质粒组分含有的RNA比例越低,如此看来裂解液应加入高浓度的氯化钙为好,但本实施例中(1)的结果又说明加入高浓度氯化钙造成的pDNA损失更大。因此,需对加入的氯化钙量权衡利弊,这是BIA法难以解决的矛盾。实施例5:BIA法CIMDEAE层析步骤中采用不连续递增浓度NaCl梯级液洗脱所得pDNA组分的纯度分析取含HG85abA质粒的DH5α大肠杆菌20克,按实施例1方法裂解并加1.0M终浓度的氯化钙,将所得裂解液上CIMDEAE柱,用0.5MNaCl液洗涤后,依次用0.52、0.54、0.56、0.6、0.7、0.8、0.9、1.0M的NaCl梯级液分段洗脱质粒,图8为该层析的分离图,并对所得各组分取样作HPLC,分析各核酸的比例,结果如表3所示。表3洗脱用的梯级NaCl液浓度(M)0.50.520.540.560.60.70.80.91.0所得组分的oc+scpDNA比例(%)016.339.246.496.796.478.7670所得组分的RNA比例(%)10083.660.853.63.33.621.333100图9为说明图8洗涤去除RNA组分和收集洗脱质粒DNA组分的示意图,显示残留的极少量RNA拖尾到最后才被洗下来。将表3与图8各峰面积结合分析,显示0.5MNaCl液洗下来的是RNA,从0.52M开始到0.56M浓度的NaCl液洗脱下小部分质粒但含较高比例的RNA,0.6-0.7MNaCl液才洗脱下大部分的高纯度质粒。0.8和0.9MNaCl洗下的质粒极少但RNA比例很高,说明有极少的RNA与DEAE配基结合很牢,图9显示洗脱时这种极少量的RNA拖尾一直到0.9-1.0MNaCl液才被洗下来混入质粒DNA组分中。CIMDEAE柱去除RNA的效果不大好,需要下一步的CIMC4柱继续去除这些残留的RNA。实施例6:BIA法CIMC4疏水层析步骤中采用不连续递减浓度硫酸铵梯级液洗涤或洗脱所得组分的超螺旋质粒比例和纯度分析培养GH85abA质粒转化的DH5α大肠杆菌,裂解液中加入终浓度0.9M氯化钙,澄清并浓缩的裂解液经CIMDEAE柱去除RNA,收集的质粒组分加入终浓度3.0M的硫酸铵后上CIMC4柱,用不连续递减浓度硫酸铵梯级液洗涤或洗脱。图10是该液相层析的分离图,表4是收集的梯级液所含核酸成分的HPLC分析。表4洗涤或洗脱液硫酸铵浓度(M)1.81.61.41.21.00.80.60.40所得组分的RNA比例(%)00003.06.565.2N/A100所得组分的sc质粒比例(%)0093.897.495.893.134.8N/A0所得组分的oc质粒比例(%)1001006.22.61.20.40N/A0将层析分离图10中的各峰面积与表4中核酸各组分的比例结合分析,可见1.8-1.6M硫酸铵液洗出的微小峰为少量oc质粒,1.4-1.2M硫酸铵液洗脱的两个大峰为占总量80%以上的高纯(90%以上)sc质粒,1.0-0.8M硫酸铵液洗脱的两个小峰为占总量10%左右的高纯sc质粒但仍含少量(3.0-6.5%)RNA,而0.6M硫酸铵液洗脱的小峰除sc质粒外还含有65.2%但量极少(峰很小)的RNA。将1.4-0.6M硫酸铵液洗脱的质粒组分合并后取样作HPLC分析,仍有占比例约1%的RNA小峰,sc质粒峰比例为92-95%,其余为oc质粒。实施例7:用本发明方法提取不同大小质粒的实例A.提取DH5α大肠杆菌产生的4.4kbHG85abA质粒取50克菌按实施例1所述方法裂解,不加氯化钙,得到2250ml裂解液,用实施例2(1)所述小6FF柱方法测定质粒含量为38μg/ml,总量85.5mg。经中空纤维装置超滤浓缩至约400ml,分二次共加入约800ml纯净水再超滤浓缩至350ml;取约100ml纯净水冲洗并透滤中空纤维管腔,收集可能附着在管壁上的质粒,共得450ml浓缩裂解液,经0.45μm滤器过滤澄清,同法测得质粒含量160μg/ml,总量72mg。中空纤维超滤浓缩装置使用三次后以0.5MNaOH液洗涤除去可能残留的内毒素等杂质,再以TE液洗去NaOH液后(再生)可重复使用。在BIO-RAD公司的NGC中压液相层析分离装置上进行以下三步:1.采用博格隆(上海)生物技术公司的0.5升Bestrose6FF凝胶柱,以TE液平衡后,加载150ml上述浓缩裂解液,上样完毕继续用TE洗涤,收集第一峰pDNA组分,丢弃后下来的RNA大峰,继以TE液洗涤至电脑屏上出现平直基线。如此进行第二、第三次各150ml浓缩裂解液上样、分离收集其pDNA组分,流速25ml/min。合并三次收集的pDNA组分液共620ml,用实施例2(2)所述装置和方法测定其质粒含量为109.6μg/ml,总量68mg。然后灌注3个CV(柱床体积)的0.5MNaOH液清洁6FF柱,继用洁净水洗尽NaOH后以TE液平衡,此柱可再使用三次。不算NaOH液清洁和TE液平衡耗时,三次上样浓缩裂解液分离pDNA组分耗时3小时多。2.采用BIA公司的CIMC4(8ml,标示核酸载量2-2.5mg/ml,总载量16-20mg)整体柱。秤取245g分析纯固体硫酸铵一点一点地加入620mlpDNA组分液中搅拌溶解(硫酸铵终浓度约3.0M),然后每次取约200-210ml(约含22mg质粒)该液加载到已用3.0M硫酸铵-TE液平衡的CIMC4柱上,加载完毕以20CV的1.6M硫酸铵-TE液洗涤除去大部分开环(oc)质粒,再以0.4M硫酸铵-TE液洗脱收集超螺旋(sc)质粒组分,每次约40ml(4CV),然后用15CV的TE液洗涤,继以10CV的3.0M硫酸铵-TE液平衡,流速30ml/min,如此三次。合并三次所得sc质粒组分液共约120ml,测得质粒浓度0.49mg/ml,总量58.8mg。三次层析分离共耗时2小时。然后用10CV的0.5MNaOH液灌洗清洁该柱,再以15-20CV的TE液洗去NaOH再生此柱,流速30ml/min。3.采用BIA公司的CIMDEAE(8ml,标示核酸载量6-8mg/ml,总载量48-64mg)整体柱。在上一步得到的120mlsc质粒组分液中加入约二倍体积的纯净水稀释使电导率降至38-40ms/cm,然后一次加载到已用TE液平衡的CIMDEAE柱上。加载完毕用约20CV的0.52MNaCl-TE液洗涤去除可能残留的所有杂质,再以0.9MNaCl-TE液洗脱收集sc质粒组分68ml,用实施例2(2)方法测定纯化质粒浓度为0.80mg/ml,总量约54.56mg,接近此柱的总载量,流速为30ml/min,由于其载量比CIMC4柱大约三倍,仅作一次层析分离即可,耗时0.5小时。取样作HPLC分析,几无RNA峰,sc质粒峰95%,gDNA和内毒素等检测达标,全程质粒回收率63.8%。B.提取XL10-gold大肠杆菌生产的15kbSVK-CAVA质粒此质粒比HG85abA质粒大三倍多,宿主大肠杆菌也不同,为检验本发明方法是否也适合不同菌种产生的较大质粒的纯化,进行了该实验。其程序与A所述基本相同,仅将要点简述如下:50克菌裂解得到2200ml裂解液,质粒含量为20μg/ml,总量44.8mg。经中空纤维装置超滤并渗滤洗滤浓缩共得210ml浓缩裂解液,质粒含量181μg/ml,总量38mg。经6FF凝胶柱三次分离得到合并的质粒液450ml,质粒含量77.8μg/ml,总量35mg。经CIMC4(8ml)柱三次后所得sc质粒组分液共约110ml,测得质粒浓度0.280mg/ml,总量约30.75mg。再经CIMDEAE(8ml)柱(以0.54MNaCl-TE液洗涤,0.8MNaCl-TE液洗脱)后收集到sc质粒组分45ml,浓度为0.68mg/ml,总量约30.6mg。全程sc质粒组分回收率68.3%。表明本发明方法也可成功用于规模化纯化不同大肠杆菌产生的较大质粒,但这两种整体柱对该较大质粒的结合载量偏低约30%,不如小质粒。实施例8:本发明方法与BIA和GE推荐方法的简要比较本发明人自2005年来一直使用颗粒介质三步层析分离法来纯化质粒,起初用GE公司产品,后来用国产(博格隆公司)同类产品效果基本相同,并对该方法进行了改进,加入了中空纤维超滤浓缩步骤,将原来需要多个大凝胶柱减少为一个,获得了经验积累了资料数据。2010年起使用BIA公司整体柱甚感兴趣,认为不愧为更新换代的创新型液相层析分离工具,携带使用维修方便,高通量快速省时又省力,但美中不足是氯化钙沉淀去除RNA不佳影响了整个方法的效果。以下依据我们多次具体实施结果对三种方法作一简要的大致比较。以在准备工作充分和操作顺利的状态下,按每次提取获得50mg左右纯化质粒的规模进行衡量,分别采用每克菌含1.2-1.4mgHG85abA质粒的DH5α大肠杆菌55-150g。时间的计算包括一个柱(因载量较低)需连续使用三次提取质粒时,每次用后再平衡的时间。层析时颗粒介质柱采用各柱允许的最大流速的一半,8ml整体柱采用30ml/min流速(允许的最高流速为100ml/min)进行,所计时间是各步骤的最短时间。比较结果见表5。表5说明:[1]BIA法的氯化钙沉淀步骤造成质粒损失一半以上,需要用约2.1-2.3倍菌量才能最终获得50mg左右的质粒。[2]BIA法所用菌量多,裂解液也多2.1-2.3倍,离心过滤时间延长至4h;加上不浓缩且需用水稀释4.6倍降低电导至38-40ms/cm才能上CIMDEAE柱,使得整个上柱液体积很大。[3]我们尝试在BIA法中加入超滤浓缩裂解液以减少CIMDEAE柱上样的体积和时间,但因裂解液多2.1-2.3倍还要加4.6倍水稀释故浓缩耗时增加到约4h。[4]16h为不浓缩裂解液的耗时。3h为采用超滤浓缩裂解液减少上柱液体积后的耗时,由于BIA法该柱的核酸载量(48-64mg)一大半被氯化钙未能去除的RNA占据,每次只能得到16-18mg质粒,需连续使用三次才能得到50mg以上质粒,耗时3h。而本发明方法只需一次0.5h。[5]由于CIMC4柱的核酸载量(16-20mg)只有CIMDEAE柱(48-64mg)的1/3,需连续使用三次才能处理50mg左右纯化质粒,耗时2h。若按我们提议BIA公司生产了25ml的CIMC4柱则只需一次0.5h。讨论:1.颗粒介质层析系统与monoliths层析系统都已成功地建立了自身体系的质粒纯化方法,但迄今未见将这二类系统联合应用于质粒纯化的报道[11]。由于Monoliths是创新开发的更具优势的低压、高通量高效层析分离材料,我们认为应以其为基础积极采用,以站在更高起点创造出更优良的质粒规模纯化技术。我们分析,碱裂解法产生的裂解液中pDNA和RNA为主要成分,后者含量为前者的8-12倍。就理化性质而言,pDNA和RNA在溶液中的带电性质相似,它们与Ca++离子结合和与DEAE阴离子交换介质或氨基酸-DNA亲和介质配基的结合没有专一选择性,主要是二者结合力的差异。然而分子量均一的pDNA与分子量高度不均一的RNA混合物在大小上差别较大,较小的4.4kb的HG85abA质粒分子量就大于2000kD,比裂解液中最大的细菌RNA分子还大,因此采用颗粒介质层析独有的凝胶过滤(分子筛)层析可分离二者。本发明首先考虑采用近年发展的中空纤维切向流超滤装置浓缩裂解液。碱裂解法每克菌可产生约45ml裂解液,100克菌产生4.5L裂解液,GE推荐的三步液相层析分离质粒纯化方法的第一步是采用交联琼脂糖颗粒凝胶柱过滤(不浓缩)裂解液除去细菌RNA,上样量为柱体积的10-35%;按30%算,100克菌的裂解液需要三个5L凝胶柱,或一个5L柱使用三次。我们先用载留分子量200-300kD的中空纤维超滤装置浓缩裂解液8-10倍以0.45微米滤膜过滤后上凝胶柱,100克菌获得约500ml浓缩液用一个5L凝胶柱足够有余或一个1L柱用二次,既节约凝胶柱又节约操作时间甚为经济。而且,GE法中为了与第二步疏水性PlasmidSelect柱层析分离相衔接,凝胶过滤柱的平衡、洗涤、再生液都采用三倍柱体积的2.1M硫酸铵-TE液。若不浓缩裂解液需使用多个大柱,大规模生产时硫酸铵用量很大,废液污染环境会产生严重问题需专门处理;本发明方法此步采用TE液则无问题。我们先用中空纤维超滤将不加CaCl2的裂解液浓缩8-10倍后,以凝胶过滤柱过滤,只要上样体积适当(柱体积的10-35%,视宿主菌的不同而不同),收集的pDNA第一峰与后续的RNA大峰可分开,回收的pDNA组分几乎完全不含RNA,此为充分利用以后步骤的CIMDEAE柱和CIMC4柱或氨基酸-DNA亲和配基整体柱的功能和核酸载量创造了有利条件。本发明方法的优点是:1)采用中空纤维超滤浓缩裂解液大大减少了下一步凝胶过滤柱的体积和操作时间及成本,其质粒损失和获得同等量纯化质粒需要处理的细菌和裂解液量比BIA法的氯化钙沉淀少得多;2)6FF凝胶过滤可基本上除尽细菌RNA,为下一步的整体柱高通量疏水层析或氨基酸-DNA亲和层析省略去除RNA步骤并满载结合回收质粒创造了条件;3)虽然增加了凝胶过滤步骤,但本发明的联合液相层析方法的总耗时比即使采用了超滤浓缩的BIA推荐方法还少,比不采用超滤浓缩的BIA法或颗粒介质柱层析法则少得多(参见实施例8的表5),有利于sc质粒的保存和回收。2.BIA公司目前提供的质粒纯化产品为:现有配套的各装8ml,80ml或800ml的CIMDEAE和CIMC4两个整体柱,但这二种柱的核酸载量不同,CIMDEAE为6-8mg/ml而CIMC4为2-2.5mg/ml。选择8mlCIMDEAE柱与8mlCIMC4柱配套,是因为他们知道CIMDEAE柱加载的经氯化钙处理的稀释裂解液中仍含不少RNA将占据其约2/3核酸载量,剩下的1/3可结合的质粒量正好与CIMC4柱的载量相当。按照本发明方法用凝胶过滤先除尽RNA后,CIMDEAE柱的载量将全部提供给质粒,我们将建议BIA公司生产总核酸载量相当的二种整体柱,即8mlCIMDEAE柱与25mlCIMC4柱配套;或80mlCIMDEAE柱与250mlCIMC4柱配套。3.欧洲的科研人员还制备了同时包含疏水性C4(或C8)和离子交换DEAE二种配基的整体柱,采用0.6MNaCl-TEpH7.2洗涤除去RNA,以3M硫酸铵-TE液pH7.2激发疏水结合然后用3M硫酸铵+1MNaCl-TE液pH7.2最大程度减少离子交换反应,最后以1MNaCl-TE液洗脱收集质粒组分[12]。他们希望用这类整体柱对经初步处理的澄清裂解液作一步层析就能得到纯化的sc质粒,但加载的仍是用氯化钙沉淀等方法初纯的裂解液,氯化钙沉淀质粒损失大,最多只能去除80%左右的RNA及其伴随的内毒素。要求一步即能兼顾去除RNA、去除oc质粒和去除内毒素并尽量多回收sc质粒等多项任务对这类整体柱来说可能难以实现,因为一步法去除内毒素的洗涤过程显然不足,难以将其残留量降到低于10EU/mg质粒的要求。本发明方法的第二步采用颗粒凝胶柱过滤可以去除几乎全部RNA及其伴随的内毒素,比氯化钙沉淀去除的内毒素更多;第四步的CIMDEAE层析目的是通过其洗涤过程保证彻底去除残余的内毒素等杂质。如果第三步采用上述二种配基整体柱或氨基酸-DNA亲和整体柱时将去除RNA的步骤变更为洗涤去除内毒素步骤能使内毒素残留量降到低于10EU/mg质粒,也许有可能省略掉第四步的CIMDEAE层析。我们期待这类新产品尽快上市以便进一步尝试省略掉第四步的可能性。参考文献1)张平静,李忠明等;“一种简便易行核酸疫苗质粒纯化工艺的开发”,中国生物工程杂志,2011,31(4):1062)N.L.Krajncetal:“PurificationoflargeplasmidsfromE.coli”,JournalofChromatographyA,1218(2011)2413-2424.3)F.Smrekar,etal:“ANovelPlasmidPurificationProcess:FromLaboratorytoProductionScale”,Vaccine28(2010)2039-2045.4)SousaA,AlmeidaAM,etal:“HistaminemonolithversatilitytopurifysupercoiledplasmiddeoxyribonucleicacidfromEscherichiacolilysate”,JChromatogrA.2014Aug15;1355:125-33.5)AmorimLF,SousaF,QueirozJA,etal:“ScreeningofL-histidine-basedligandstomodifymonolithicsupportsandselectivelypurifythesupercoiledplasmidDNAisoform”,JMolRecognit.2015Jun;28(6):349-358.6)SoaresA,QueirozJA,SousaF,etal:“Purificationofhumanpapillomavirus16E6/E7plasmiddeoxyribonucleicacid-basedvaccineusinganargininemodifiedmonolithicsupport”,JChromatogrA.2013Dec13;1320:72-9.7)李忠明,吴雪琼等“结核杆菌Ag85ab嵌合基因疫苗、其制备方法及应用”,中国发明专利CN201010191243.X8)“一种复制子DNA疫苗载体及其构建方法与应用”,中国发明专利CN20131017958.89)“黑色素瘤治疗性质粒DNA疫苗pSVK-CAVA的制备方法及其专用工程菌及发酵培养基”,中国发明专利CN201310131566.310)YinX等;“SynergisticantitumorefficacyofcombinedDNAvaccinestargeting,Tumorcellsandangiogenesis”,BiochemBiophysResCommun.,2015,465(2):239-24411)GhanemA,HealeyR,AdlyFG:“CurrenttrendinseparationofplasmidDNAvaccines:Areview”,AnalChimActa760(2013)1-15.12)SmrekarV,SmrekarF,StrancarA,etal:“SinglestepplasmidDNApurificationusingmethacrylatemonolithbearingcombinationofion-exchangeandhydrophobicgroups”,JChromatogrA.2013Feb8;1276:58-64.当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1