EDOT官能化的共轭聚合物和包含其的光电探测器的利记博彩app
本发明一般涉及有机半导体材料领域,特别地涉及含有作为侧链的3,4-乙撑二氧噻吩(3-4-ethylenedioxythiophene:EDOT)的给体-受体型共轭聚合物,和含有其的光电探测器。
背景技术:
作为一类可将所检测到的光转换成电信号的半导体器件,光电探测器对于各种各样的应用具有重大的意义,如图像传感、数据通信、远程控制等。目前,商业上可以获得的用于光电探测器的活性材料主要是基于无机半导体材料,如氧化锌、硅、GaAs和PbS。这些材料的探测率通常大于1012Jones,但其价格较昂贵以及对工作环境要求相对苛刻(例如,GaAs探测器需要在非常低的温度下工作)。此外,这些无机材料是脆弱的、非可折叠的并且延展性低,这限制了其在新型高需求领域的应用。因此,这种商业材料具有在低成本、温和工作条件和新特性(诸如柔性和半透明性)方面的优点的替代材料是被期望并且需要的。
共轭聚合物作为一类新型半导体材料,由于其具有成本低、加工简单、柔性和半透明性的优势,引起了学术界和工业界的广泛关注。已经证明了聚合物光电探测器中的高外量子效率、快速的响应以及近红外(NIR)范围(1450nm)的检测。此外,聚合物光电探测器适用于大面积检测,并且可以在室温下工作,还适用于柔性衬底,这些给传感或检测技术提供了新的机会。与聚合物太阳能电池相似,采用本体异质结结构构建聚合物光电检测器,其中共轭聚合物作为电子给体,而富勒烯衍生物作为电子受体。这样的结构有利于光子吸收和电荷分离,获得高的外量子效率。然而,这种结构通常会导致在负偏压下相对高的暗电流密度,以及在正向/反向偏压下低的整流比,难以从紫外(UV)到近红外(NIR)的宽光谱范围内实现高的探测率。开发具有高探测率的新型聚合物光电探测器有很多种方法,包括界面工程、活性层形貌的控制以及改进结构,然而所报道的工作几乎没有与分子结构设计相关的。
技术实现要素:
技术问题
本发明的目的是提供一种具有重复的给体-受体单元的、高探测率有机共轭聚合物,其包含作为侧链的EDOT。
本发明的另外一个目的是提供一种通过将3,4-乙撑二氧噻吩(EDOT)作为侧链接入主链来提高给体-受体聚合物的探测率的方法。
本发明的另一个目的是提供一种光电探测器器件,其包含含有有机共轭聚合物的光活性层。
技术方案
根据本发明的实施方案,提供了一种给体-受体型共轭聚合物,其包含作为侧链连接到聚合物的主链上的式(I)的3,4-乙撑二氧噻吩(EDOT),
其中R1选自由C1-C20烷基、C1-C20烷氧基和C1-C20烷基硫醇基团组成的组。
根据优选的实施方案,R1选自由CH3、C2H5、C4H9、C6H13、C8H17、C12H25、2-乙基己基、2-丁基辛基、2-己基癸基和2-辛基十二烷基组成的组。
根据本发明的另一实施方案,提供了一种光活性层,其包含与富勒烯衍生物共混的共轭聚合物,其中共轭聚合物在侧链中具有上述式(I)的EDOT功能单元。
具体地,根据实施方案的富勒烯衍生物选自由PC61BM和PC71BM组成的组。
根据本发明的实施方案,式(I)的3,4-乙撑二氧噻吩(EDOT)环连接到聚合物的主链上一侧或两侧的每个给体单元,即共轭共聚物中EDOT与给体单元的摩尔比为1:1或2:1。
根据本发明的实施方案,提供了一种光电探测器器件,其包括与富勒烯衍生物共混、作为光活性层的半导体共轭聚合物。半导体共轭聚合物在侧链上具有上述式(I)的EDOT功能单元,它可以有效降低暗电流,而对光电流没有明显的影响。
根据本发明的另一实施方案,提供了一种通过将作为侧链的上述式(I)的3,4-乙撑二氧噻吩接入聚合物的主链的给体单元来提高给体-受体聚合物的探测率的方法。
有益效果
根据本发明的实施方案,与不含EDOT侧链的聚合物制成的参考器件相比,EDOT或其衍生物的引入大大降低了光电探测器件的暗电流约2个数量级,并且提高了光电探测率超过1个数量级。此方法可以应用到各种给体-受体型半导体聚合物,其光响应覆盖从UV到NIR。
附图说明
将附图并入本文并且构成说明书一部分,其显示出本发明的实施方案。
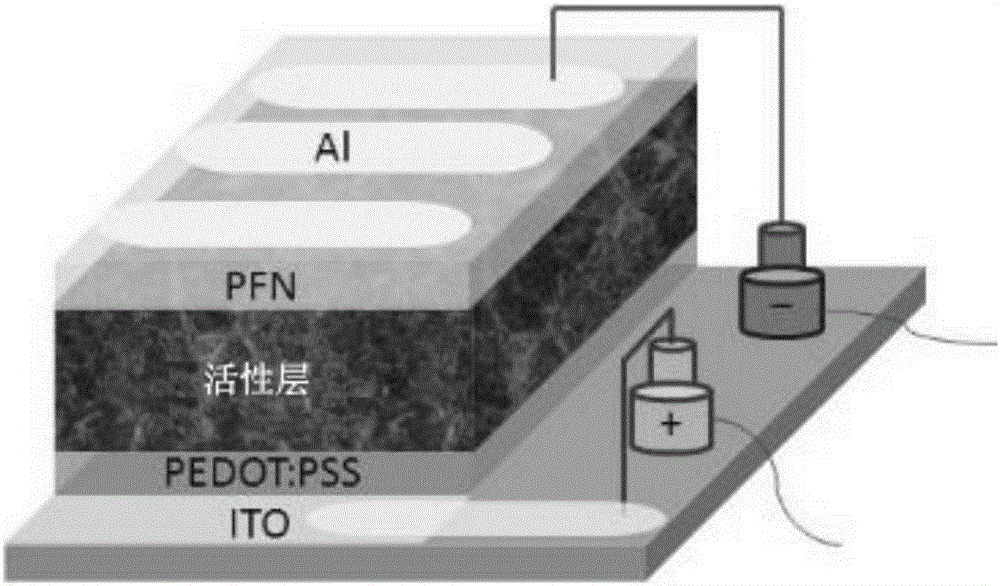
图1给出了根据本申请一个实施方案的光电器件的结构示意图。
图2给出了根据本申请一个实施方案的聚合物在溶液(a)和固体膜(b)中的吸收光谱。
图3给出了根据本申请一个实施方案的电子给体、电子受体、界面层和电极的能级水平。
图4-8给出了根据本申请一个实施方案的器件的J-V(电流-电压)测量结果。
具体实施方式
以下仅通过举例的方式对优选实施方案进行描述,而不限于实施本发明所需特征的组合。
本申请提供了一种给体-受体型共轭聚合物,其包含连接到主链的给体单元的下式(I)的3,4-乙撑二氧噻吩(EDOT)单元,
其中R1选自由C1-C20烷基、C1-C20烷氧基和C1-C20烷基硫醇基团组成的组。优选地,R1选自由CH3、C2H5、C4H9、C6H13、C8H17、C12H25、2-乙基己基、2-丁基辛基、2-己基癸基和2-辛基十二烷基组成的组。更优选地,R1为2-乙基己基基团。
根据本申请的实施方案,可以有一个或两个EDOT单元连接到聚合物的主链上的每个给体单元。优选地,有两个EDOT单元连接到聚合物的主链上的每个给体单元的两侧。
根据本申请的实施方案,共轭共聚物具有给体-受体结构的主链,其中主链中给体单元与受体单元的摩尔比(D/A比值)是1:1,如下所示。
根据本申请的实施方案,主链中重复的给体-受体单元的数目为10到100。
根据本申请实施方案的共轭聚合物中的给体单元可以是有机光电材料领域的常用的给体单元。优选地,给体单元可以选自由苯并[3,4-b]二噻吩、噻吩、苯及其衍生物组成的组。
根据本申请的优选实施方案,共轭共聚物的给体单元可以是以下结构的任何一种,
其中R1为如式(I)中所描述的相同基团。更优选地,该共聚物的给体单元是苯并[3,4-b]二噻吩或其衍生物。
根据本申请的实施方案,共聚物的主链上的受体单元可以是下列结构表示的环的任一种,
特别地,共聚物的主链上的受体单元可以选自由苯并[c][1,2,5]噻二唑、苯并[c][1,2,5]噁二唑、异靛-1,3-二酮、喹喔啉、苯并[d][1,2,3]三唑、噻吩并[3,4-c][1,2,5]噻二唑、噻吩并[3,4-b]吡嗪类、噻吩并[3,4-b]噻吩、苯并[1,2-c:4,5-c']-双([1,2,5]噻二唑)、含噻二唑环[3,4-g][1,2,5]喹喔啉、吡嗪[2,3-g]喹喔啉、[3,3'-双吲哚满叉]2,2'-二酮及其衍生物组成的组、其中R选自由H、CH3、C2H5、C4H9、C6H13、C8H17、C12H25、2-乙基己基、2-丁基辛基、2-己基癸基和辛基十二烷基组成的组。
优选地,共轭聚合物中受体单元是含有二酮吡咯并吡咯(DPP)或其衍生物的化合物。
根据本申请的优选实施方案,将DPP和噻吩并吡咯二酮(TPD)用作受体单元,因为它们可以赋予所获得的共聚物良好的光电性能。
以下示例对本申请进行了详细说明,但不限于其范围。在以下的示例中仅对含有BDT(苯并[1,2-b:4,5-b']二噻吩)的共聚物作为给体单元而DPP、TPD或噻吩并异靛(TIIDG)作为受体单元进行了说明,然而含有以上列出的其它给体单元和受体单元的共聚物可以通过与示例1-3中方法相似的方法合成。
以下描述将EDOT(EH)作为侧链接入D-A共聚物的一些示例,然而本领域技术人员应该理解式(I)所示的EDOT的其它衍生物都适合连接到共聚物的主链上的给体单元。
示例1 BDT-EDOT-DPP的合成
1.作为给体单元的Sn2-BDT-EDOT(EH)的制备
按照以下步骤进行Sn2-BDT-EDOT(EH)的合成:
首先利用2-乙基己基链使3,4-乙撑二氧噻吩(EDOT)官能化,得到5-(2-乙基己基)-2,3-二氢噻吩并[3,4-b][1,4]二噁英(EDOT(EH))。然后将此EDOT(EH)与苯并[1,2-b:4,5-b']双噻吩-4,8-二酮反应,得到EDOT取代的苯并[1,2-b:4,5-b']双噻吩(BDT-EDOT(EH))。通过与二异丙胺锂(LDA)进行锂化继而以Me3SnCl进行锡化而进一步对得到的BDT-EDOT(EH)进行官能化,得到标题化合物。
5-(2-乙基己基)-2,3-二氢噻吩并[3,4-b][1,4]二噁英(EDOT(EH))的合成:将EDOT(8.17克,57.46毫摩尔)放在预先干燥好的250毫升瓶中,加入无水THF(115毫升)配制成溶液,将该溶液冷却到-78℃。然后将溶解在正己烷(37.7毫升)中的正丁基锂(1.6摩尔)的溶液在氩气保护下逐滴加入,将得到的混合物在-78℃的温度下保持1.5小时,然后将2-乙基己基溴化铵(22.2克,114.95毫摩尔)缓缓加入。该反应持续过夜,然后用水淬取,用二氯甲烷提取,并用水洗涤3次。得到的有机层用硫酸镁干燥,然后进行减压浓缩。在(0.1兆帕,80-85℃)蒸馏后,得到目标产物(5.49克),产率为37.55%。1H核磁共振谱(500MHz,CDCl3,δ):6.09(s,1H)、4.14(s,4H),2.54(d,2H)、1.53(m,1H),1.35-1.25(m,8H),0.87(m,6H)。
BDT-EDOT(EH)的合成:将EDOT(EH)(5.49克,21.58毫摩尔)放入预干燥的250毫升瓶中,加入无水THF(87毫升)配制成溶液,将该溶液冷却到0℃,然后将溶解在正己烷(14.8毫升)中的正丁基锂(1.6摩尔)在氩气保护下逐滴加入。将得到的混合物在室温下保持1.5小时,再冷却至0℃,然后在一部分中加入苯并[1,2-b:4,5-b']双噻吩-4,8-二酮(1.95克,8.85毫摩尔)。该反应在80℃进行1.5小时。再次冷却到0℃后,引入溶解在10%盐酸(50毫升)中的SnCl2·2H2O(12.17g,53.93毫摩尔)溶液,将得到的混合物在80℃另外搅拌2个小时。冷却到环境温度后,将混合物浸入到冰水中。用EtOAc提取有机层、并且水冲洗至少3次。用二氯甲烷/正己烷(v/v,3:7)作为洗脱剂进行柱层析进行进一步纯化。最终产产物(5.04克)通过在乙醇中重结晶获得,经减压干燥,产率为81.94%。1H核磁共振谱(500MHz,CDCl3,δ):7.43(s,4H)、4.23(q,8H),2.68(d,4H)、1.65(m,2H),1.48-1.32(m,16H),0.90(m,12H)。
Sn2-BDT-EDOT(EH)的合成:将先前步骤中获得的BDT-EDOT(EH)(1.5克,2.16毫摩尔)溶解在装有无水THF(33毫升)的100ml充氩气的瓶中,然后在-78℃下加入二异丙基氨基锂(2摩尔,3.24毫升)。该反应混合物在该温度(-78℃)下搅拌1.5小时。随后,加入溶解在四氢呋喃(7.12毫升)中的三甲基甲锡烷基氯化铵(1.0M)溶液,将得到的混合物在室温下搅拌过夜。有机层用乙醚提取,用水洗涤2次,浓缩得到粗产物。标题化合物(1.35克)是通过将粗产物在异丙醇重结晶而获得,产率达到60.94%。1H核磁共振谱(500MHz,CDCl3,δ):7.46(s,2H)、4.24(dd,8H),2.70(m,4H),1.68(m,2H),1.57-1.35(m,16H),0.92(m,12H),0.39ppm(s,18H)。
2.作为受体单元的Br2-DPP(BO)的制备
根据E.J.Zhou等人(E.J.Zhou,S.P.Yamakawa,K.Tajima,C.H.Yang,K.Hashimoto,Chem.Mater.2009,21,4055)报道的方法合成出3,6-双(5-溴噻吩-2-基)-二(2-丁基辛基)吡咯并[3,4-c]吡咯-1,4(2H、5H)-二酮(Br2-DPP(BO))。
3.给体-受体共聚物的制备
以Pd(PPh3)4为催化剂而以甲苯/DMF混合物作为反应溶剂通过双锡烷化BDT基给体单元与二溴化受体单元之间的Stille缩聚反应制备出给体-受体共聚物。
BDT-EDOT-DPP的制备方法总结如下:
向25毫升的预干燥瓶子里装上Sn2-BDT-EDOT(EH)(250毫克,0.245毫摩尔),Br2-DPP(BO)(194.68毫克,0.245毫摩尔)以及Pd(PPh3)4(11.3毫克,0.010毫摩尔)。瓶子先抽真空然后充进氩气,这个过程重复了3次。然后加入甲苯(9.8毫升)与DMF(0.98毫升)。将得到的混合物在120℃保温24小时。粗产物经硅藻土过滤,和丙酮沉淀收集。然后将得到的固体在索氏提取器中先后经MeOH、丙酮、正己烷和氯仿漂洗。将在氯仿中的产物浓缩,然后在正己烷中沉淀。减压干燥后,得到标题共聚物(301毫克),产率为92.55%。
对比例1 BDT-T-DPP的合成
1.作为给体单元的Sn2-BDT-T(EH)制备
按照L.Huo等人(L.Huo,S.Zhang,X.Guo,F.Xu,Y.Li,J.Hou,Angew.Chem.Int.Ed.2011,50,9697)报道的步骤进行(4,8-双(5-(2-乙基己基)噻吩-2-基)苯并[1,2-b:4,5-b']双噻吩-2,6-二基)双(三甲基锡)(Sn2-BDT-T(EH))的合成。
2.作为受体单元的Br2-DPP(BO)的制备
以与示例1中相同的方法制备出Br2-DPP(BO)。
3.给体-受体共聚物的制备
以与示例1中制备BDT-EDOT-DPP的相同步骤进行由Sn2-BDT-T(EH)和Br2-DPP(BO)合成BDT-T-DPP。获得了标题共聚物,其产率为82.36%。
示例2 BDT-EDOT-TPD的合成
1.作为给体单元的Sn2-BDT-EDOT(EH)的制备
以与示例1中相同的方法得到了给体单元Sn2-BDT-EDOT(EH)。
2.作为受体单元的Br2-TPD的制备
按照Y.P.Zou等人(Y.P.Zou,A.Najari,P.Berrouard,S.Beaupre,B.R.Aich,Y.Tao,M.Leclerc,J.Am.Chem.Soc.2010,132,5330)报道的步骤合成出受体单元1,3-二溴-5-辛基-4H-噻吩并[3,4-c]吡咯-4,6(5H)-二酮(Br2-TPD)。
3.给体-受体共聚物的制备
根据以下步骤进行BDT-EDOT-TPD的合成。
BDT-EDOT-TPD的合成:向25毫升的预干燥瓶内装入Sn2-BDT-EDOT(EH)(250毫克,0.245毫摩尔),Br2-TPD(103.64毫克,0.245毫摩尔)和Pd(PPh3)4(11.3毫克,0.010毫摩尔)。将瓶子抽真空然后充填氩气,这个过程重复3次。然后加入甲苯(9.8毫升)与DMF(0.98毫升)。将得到的混合物在120℃保温24小时。粗产物经硅藻土过滤,和丙酮沉淀收集。将得到的固体在索氏提取器中先后经MeOH、丙酮、正己烷和氯仿漂洗。将氯仿中的产物浓缩,然后在正己烷中沉淀。减压干燥后,得到了标题产物,产率为98.16%。
对比例2 BDT-T-TPD的合成
以如示例2中合成BDT-EDOT-TPD的相同步骤进行由Sn2-BDT-T(EH)和Br2-TPD合成BDT-T-TPD。得到了标题共聚物,其产率为79.65%。
示例3 BDT-EDOT-TIIDG的合成
为进一步证实了EDOT单元的功能的普遍性,还合成了侧链含EDOT单元的窄带隙聚合物,并将它用于根据本申请聚合物光电探测器的制备。低能带隙聚合物BDT-EDOT-TIIDG的分子结构由式(II)所示
1.作为给体单元的BDT-EDOT-TIIDG的制备
以示例1中相同的方法得到了给体单元Sn2-BDT-EDOT(EH)。
2.Br2-TIIDG的制备
按照G.W.P.Van Pruissen等人(G.W.P.Van Pruissen,F.Gholamrezaie,M.M.Wienk,R.A.J.Janssen,J.Mater.Chem.2012,22,20387)报道的步骤合成出噻吩并异靛化合物,2,2'-二溴-4,4'-双(辛基十二烷基)-[6,6'-二噻吩并[3,2-b]吡咯亚基]-5,5'(4H,4'H)-二酮(Br2-TIIDG)。
3.给体-受体共聚物的制备
根据以下步骤进行BDT-EDOT-TIIDG的合成。
BDT-EDOT-TIIDG的合成:通过与示例1中制备BDT-EDOT-DPP相同的步骤获得该共聚物,除了将Br2-DPP(BO)换成Br2-TIIDG。得到了标题产物,其产率为71.5%。
示例4含有BDT-EDOT-DPP的光电器件的制备与测试
制备了如图3中所示的具有ITO/PEDOT:PSS/活性层/PFN/Al结构的光电器件,其中铟锡氧化物(ITO)是底层。该器件包括透明金属氧化物电极(即ITO)和作为阳极的PEDOT:PSS层,共轭聚电解质PFN改性的Al为阴极,而EDOT聚合物与PCBM制备而成的光活性层则置于两电极之间。在本示例中,EDOT聚合物为BDT-EDOT-DPP,PCBM为PC71BM;而在对比例中,EDOT聚合物为BDT-T-DPP,PCBM与本示例中相同。
制备光电器件的方法总结如下。ITO衬底先后经洗涤剂、去离子水、丙酮、异丙醇超声清洗。然后,将ITO衬底在烘箱中干燥,并在紫外臭氧室处理4分钟。PEDOT:PSS[聚(3,4-乙烯二氧噻吩):聚(苯乙烯磺酸)]水溶液经0.22μm滤膜过滤,然后在ITO电极上以2500转进行旋涂30s,继而将衬底在空气150℃下烘烤10分钟。PEDOT:PSS层厚度为约40nm。随后,将由
ITO层和PEDOT:PSS层组成的衬底转移到充有氮气的手套箱中。将示例1中制备的BDT-EDOT-DPP与PC71BM(1:2,w/w)(PC71BM:[6,6]-苯基C71丁酸甲酯)混合,然后将混合物溶于氯仿/1,2-二氯苯(95:5,v/v)中。PC71BM的分子结构可以表示为式(III)所示,
将得到的溶液在手套箱内旋涂在PEDOT:PSS层上,以形成活性层(DPP膜),其厚度为约130nm。在沉积Al电极前,先在活性层上覆盖聚[(9,9-二(3′-(N,N-二甲基氨基)丙基)-2,7-芴)-alt-2,7-(9,9-二辛基芴)](PFN)层。最后,将得到的结构转移到真空室,然后在3×10-6mbar的基准压力下在PFN层上热沉积约100nm的Al。所得到的器件的光活性层面积为0.16cm2。
对所获得器件的电流密度-电压(J-V)的测量是在AM1.5G太阳模拟器光照下(100mWcm-2)由计算机控制的Keithley 2400源测量单元在空气中测量得到。器件的暗导J-V特性曲线则在手套箱中由计算机控制的Keithley 236源测量单元测量的。单色外量子效率是在室温环境下使用DSR100UV-B光谱仪与SR830锁相放大器测量的。本测试中采用溴钨灯作为光源。
对比例4含有BDT-T-DPP的光电器件的制备与测试
本对比例中,参考器件的制造方法与示例4中的制造方法相同,除了将活性层含有的EDOT替代为噻吩。将对比例1中制备的BDT-T-DPP与PC71BM(1:2,w/w)(PC71BM:[6,6]-苯基C71丁酸甲酯)混合,然后将混合物溶于氯仿/1,2-二氯苯(95:5,v/v)。将得到的溶液在手套箱内涂布在由ITO层和PEDOT:PSS层组成的衬底上,以形成活性层,其厚度为约130nm。
示例5含有BDT-EDOT-TPD光电器件的制备与测试
制备了如图3所示的具有ITO/PEDOT:PSS/活性层/PFN/Al结构的光电器件,其中ITO为底层。获得铟锡氧化物(ITO)衬底,先后经洗涤剂、去离子水、丙酮、异丙醇超声清洗。然后,将ITO衬底在烘箱中干燥,并在紫外臭氧室处理4分钟。将经0.22μm滤膜过滤的PEDOT:PSS水溶液以2500转在ITO衬底上旋涂30s,然后在空气中150℃下烘烤10分钟。所获得的PEDOT:PSS层厚度为约40nm。随后,将由ITO层和PEDOT:PSS层组成的结构转移到充有氮气的手套箱中。将示例2中制备的的BDT-EDOT-TPD与PC61BM(1:1,w/w)(PC61BM:[6,6]-苯基C61丁酸甲酯)混合,并将混合物溶于氯仿/1,8-二碘辛烷(97:3,v/v)中。PC61BM的分子结构可以表示为式(IV),
将得到的溶液旋涂在PEDOT:PSS层上,以形成活性层,其厚度为约100nm。在活性层上覆盖聚[(9,9-双(3′-(N,N-二甲基氨基)丙基)-2,7-芴)-alt-2,7-(9,9-二辛基芴)](PFN)层。最后,将得到的结构转移到真空室,然后在3×10-6mbar的基准压力下在PFN层上热沉积约100nm的Al。所得到的器件的光活性层面积为0.16cm2。
以与示例4中相同的方法对所获得的器件进行J-V测试。
对比例5含有BDT-T-TPD的光电器件的制备与测试
本示例中器件的结构和方法与示例5中是相同的,除了将活性层中含有的BDT-EDOT-TPD替代为BDT-T-TPD。该器件的制备方法总结如下:将ITO衬底先后经洗涤剂、去离子水、丙酮、异丙醇超声清洗。然后,将ITO衬底在烘箱中干燥,并在紫外臭氧室处理4分钟。在ITO衬底上涂布40nm的PEDOT:PSS层。将对比例2中制备的BDT-T-TPD与PC61BM(1:1,w/w)(PC61BM:[6,6]-苯基C61丁酸甲酯)混合,然后将它们溶于氯仿/1,8-二碘辛烷(97:3,v/v)中。将该溶液涂布在PEDOT:PSS层上,以形成100nm的活性层。将PFN层覆盖在活性层上,然后在PFN层上沉积100nm的Al层。该器件的光活性面积为0.16cm2。
以与示例4中相同的方法对所获得的器件进行J-V测试。
示例6
制备出图3中所示的具有ITO/PEDOT:PSS/活性层/PFN/Al结构的光电器件,其中ITO为底层,而活性层包括示例3中制备的BDT-EDOT-TIIDG。本示例中器件的制备方法与示例中的方法相同,除了活性层中BDT-EDOT-TPD被替换为示例3中制备的BDT-EDOT-TIIDG。
以与示例4中相同的方法对所获得的器件进行J-V测试。
结果
图2给出了示例1-2与对比例1-2中制备的聚合物的吸收光谱,其中图(2a)为聚合物在氯仿(CF)中的吸收光谱,而图(2b)为聚合物在固体薄膜的吸收光谱。
从图2可以看出,EDOT改性的共轭聚合物(示例1的BDT-EDOT-DPP、示例2的BDT-EDOT-TPD)与噻吩为侧链的参考聚合物(对比例1-2)具有相似的吸收光谱。对于溶解在氯仿(CF,浓度为0.005mg·mL-1)中的DPP聚合物的结果,BDT-EDOT-DPP相比噻吩改性的BDT-T-DPP具有更高的峰(768nm)/肩(700nm)吸收比。TPD聚合物(BDT-EDOT-TPD与BDT-T-TPD比较)也有类似的趋势。同时,EDOT较噻吩类聚合物的吸收光谱显示出蓝移,这种趋势在TPD聚合物(BDT-EDOT-TPD)更为明显。
示例4与对比例4中实验性聚合物的能级水平通过循环伏安法(CV)测定,其最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的数据在图3中给出。从图中可见,将EDOT作为侧链引入共轭聚合物导致聚合物带隙相比于引入噻吩聚合物略有增加。图3还表明EDOT聚合物比噻吩类聚合物具有更高的HOMO能级。
示例4-5和对比实例4-5中制备的聚合物光电探测器的电流电压特性如图4所示,其中图(4a)给出BDT-EDOT-DPP器件的短路电流密度与BDT-T-DPP器件的短路电流密度是可比较的,表明载流子在这两体系中都可以有效产生。而图(4b)则给出了BDT-EDOT-TPD和BDT-T-TPD的测量结果。然而,在反向电压下从BDT-EDOT-DPP器件观察到的暗电流比从BDT-T-DPP器件观察到的暗电流低约2个数量级,在±2V产生的整流比达到106。从BDT-EDOT-DPP器件观察到的良好二极管特性表明在侧链引入EDOT单元可以显著地抑制二极管在暗导条件下的本征漏电流。这种现象在较大的带隙TPD聚合物体系中也被观察到。EDOT聚合物在-2V具有暗电流7.5×10-8A/cm2,而噻吩聚合物的暗电流则为3.1×10-5A/cm2(图5b)。BDT-EDOT-TPD器件在AM1.5G光照下的短路条件时光电流密度为8.23mA/cm2,说明此EDOT改性的聚合物中电荷载流子的产生是高效的。
图5给出了在示例4-5和对比例4-5中制备的聚合物光电探测器的外量子效率(EQE),参数表示其光子-电荷的转换能力。可以看出,BDT-EDOT-DPP器件与BDT-T-DPP器件光电转换能力很好,而BDT-EDOT-TPD器件与BDT-T-TPD器件也可以有效地捕获相应光并有效地产生光电流。
在本领域,有几个参数,可用于评估实验性光电探测器的质量和有效性。其中的一个参数是噪声等效功率(NEP),它可以计算为:
NEP=(AΔf)1/2/D*
其中A为探测器的有效面积,单位是cm2,Δf是电带宽,单位是Hz,和D*为探测率,单位是Jones。在这里,我们使用等式:
D*=EQE×(λ/1240)/(2qJd)1/2
计算D*值,其中q是绝对的电荷量1.60×10-19C,Jd是器件的暗电流,单位为A/cm2,λ是波长。图6给出了聚合物光电探测器的探测率,其中器件在0V下的暗电流为3.125×10-11A/cm2。从中可见,BDT-EDOT-DPP器件在波长775nm达到8×1013Jones。然而,这BDT-T-DPP器件在其响应谱范围内最高只有1.7×1012Jones的探测率。对于TPD聚合物,该器件具有与DPP聚合物探测器类似的特征。因为侧链中EDOT的存在,BDT-EDOT-TPD探测器在605nm具有约2.7×1013Jones。但是,BDT-T-TPD器件在响应范围内均低于1.9×1012Jones。这些结果表明EDOT侧链的引入能够提供用于具有高探测率的光电探测器件的高效聚合物。
示例3中制备的BDT-EDOT-TIIDG薄膜的光学吸收光谱如图7所示。可以看出,BDT-EDOT-TIIDG最强吸收峰处在840nm处,其吸收覆盖从400nm到1000nm,而吸收边延伸到1085nm。从其吸收光谱中计算出的BDT-EDOT-TIIDG的光学带隙约为1.14eV。
图8给出了BDT-EDOT-TIIDG基-光电探测器在光导和暗导下的J-V特性(a),以及BDT-EDOT-TIIDG基-光电探测器的外量子效率和探测率(b)。与上述两类EDOT基-聚合物类似,BDT-EDOT-TIIDG器件也表现出很好的二极管特性,在±2V电压下的整流比在106。在0V下,暗导下BDT-EDOT-TIIDG器件的电流密度为5.4×10-10A/cm2,表现出器件中很低的散粒噪声(散粒噪声是来源于电荷离散性的电子噪声)尽管BDT-EDOT-TIIDG的带隙小至1.14eV。BDT-EDOT-TIIDG器件的探测率从380nm到975nm超过1012Jones,在1085nm超过1011Jones。最高的探测率在波长830nm处,接近6.3×1012Jones。这样高的探测率可与以前报道的结果相媲美。所有这些结果进一步证明,在侧链引入EDOT单元可以有效地抑制器件中的暗电流,进而提高光电探测器的探测率。
显而易见的是,上述的描述目的是为了说明、解释、描述本发明。对这些具体例子的修改和改进对于那些熟悉本领域的研究人员来说是简单易懂的,并且可以不偏离本发明的范围或内涵。
- 还没有人留言评论。精彩留言会获得点赞!