菊科类型环肽化合物作为cGAS‑STING信号通路抑制剂的应用的利记博彩app
本发明属于药物技术,具体地涉及一种菊科类型环肽作为cgas-sting信号通路抑制剂的应用,以及其在制备治疗相关疾病药物中的应用。
背景技术:
固有免疫是宿主机体免疫系统的第一道防线。在漫长的生物进化过程中,宿主细胞中的模式识别受体能够识别入侵病原微生物的保守组分病原相关分子模式,如核酸分子、lps等,感知到病原微生物的入侵,侵染信号通过下游接头蛋白、激酶和转录因子传递,诱导i型干扰素和促炎症细胞因子的表达,最终清除入侵的病原微生物。过去几十年的研究已经详细解析了宿主细胞识别以及清除“非己”rna的信号转导机制,而最近几年才开始对识别“非己”dna的信号转导机制进行研究,特别是cgas-sting信号通路。
sting(stimulatorofinterferongenes),又名为tmem173,mita,eris或mpys,作为胞内应答dna入侵的关键节点分子,在胞质dna刺激下,它响应来自胞质dna受体的信号,对于诱导产生干扰素的过程中发挥了关键性的作用。宿主细胞的dna识别受体识别外源或内源的“非己”dna后将信号传递给内质网上的节点分子sting,随后sting迅速二聚化并从内质网转移到核外周小体上。在这个过程中,激酶tbk1也会被招募并转移到核外周小体上激活,被激活的tbk1磷酸化转录因子irf3,随后irf3发生二聚化并进入细胞核激活多种靶基因的转录表达,参与多种生物效应,包括抗病毒、炎症反应、免疫应答及肿瘤发生发展等重要的生理病理过程。
正常激活的cgas-sting信号通路有助于机体识别和清除入侵的dna病原微生物,但是异常过度激活的cgas-sting信号通路会造成机体发生炎症及自身免疫性疾病等,如aicardi-goutieres综合征、系统性红斑狼疮或狼疮样疾病。因此研究调控cgas-sting信号通路以维持固有免疫处于正常稳定的状态至关重要。目前的研究主要集中在cgas-sting信号通路关键分子的翻译后修饰以及寻找新的调控分子,而小分子化合物参与调控cgas-sting信号通路的研究还比较少,但具有十分重要的应用价值,这也成为重点关注的研究方向之一。
现有技术中未见cgas-sting信号通路抑制剂的报道,亦未见菊科类型环肽作用于该通路和制备治疗自身免疫性疾病药物的报道。菊科类型环肽在菊科植物中存在的种类不多,目前仅从菊科紫菀属植物紫菀(astertataricusl.f.)中分离得到15个。菊科类型环肽类化合物的提取分离具有一定的特点,主要是因为该类化合物的极性小、溶解性不好且含量较低,难以得到纯度较高的环肽类成分。近年来,从紫菀属植物中分离环肽类成分已有若干方法公开发表,如徐会敏等报道,用甲醇回流提取菊科紫菀属植物紫菀的根茎后,得甲醇浸膏,加水混悬后,用乙酸乙酯和正丁醇反复萃取,乙酸乙酯部分反复利用正反向硅胶柱层析、sephadexlh-20富集得到总环肽部位,再结合hplc对其进行分离纯化,得到一系列环肽。参见xu,h.m,etal.astinsk-p,sixnewchlorinatedcyclopentapeptidesfromastertataricus,tereahedron2013,69,7964-7969。专利cn102174083b也公开了类似的制备方法。但是这些方法普遍存在提取效率低,过程复杂,样品损失量较大,重复性和可控性差等缺点。
技术实现要素:
本发明的目的在于提供一类菊科类型环肽化合物作为cgas-sting信号通路抑制剂的应用;以及其在制备治疗cgas-sting信号通路异常激活的疾病的药物中的应用。
为了实现本发明的上述目的,本发明提供了如下技术方案:
菊科类型环肽化合物或其药理学上容许的盐作为cgas-sting信号通路抑制剂的应用。
菊科类型环肽化合物或其药理学上容许的盐作为cgas-sting信号通路抑制剂在制备治疗cgas-sting信号通路异常激活的疾病的药物中的应用。
其中,所述菊科类型环肽化合物优选为下述结构式所示的菊科类型环肽astinsa-h(1-8)和astinsk-p(9-14),
进一步优选的,所述菊科类型环肽为astinc。
所述菊科类型环肽化合物或其药理学上容许的盐能够抑制isd刺激下cgas-sting信号通路下游基因ifnβ、ifnα4和cxcl10的表达,从而达到抑制cgas-sting信号通路。
所述的药理学上容许的盐包括与无机酸、有机酸、碱金属、碱土金属或者碱性氨基酸形成的盐。
进一步的,本发明的所述菊科类型环肽或其药理学上容许的盐,可以列举例如与盐酸、硝酸、硫酸、磷酸、氢溴酸等无机酸,或者马来酸、富马酸、酒石酸、乳酸、柠檬酸、乙酸、甲磺酸、对苯甲磺酸、己二酸、棕榈酸、单宁酸等有机酸,锂、钠、钾等碱金属,钙、镁等碱土金属,赖氨酸等碱性氨基酸形成的盐。
本发明所述的治疗cgas-sting信号通路异常激活的自身免疫性疾病的药物,可以由菊科类型环肽化合物或其药理学上容许的盐,与药学上可接受的载体组合后制备而成。制备的药物剂型可以为片剂、胶囊、口服液、针剂、注射用冻干剂或粉针剂等。由于菊科类型环肽可从紫菀中提取分离,而片剂、胶囊、口服液、针剂、注射用冻干剂或粉针剂等药物剂型的制备也是本领域的常规知识。因此,由菊科类型环肽化合物与相应载体制备的各种药物剂型也能够由本领域技术人员实现。
上文中所述的药学上可接受的载体是指药学领域常规的药物载体,例如:稀释剂、赋形剂如水等,填充剂如淀粉、蔗糖等;黏合剂如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如琼脂、碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如十六烷醇;吸附载体如高岭土和皂黏土;润滑剂如滑石粉、硬脂酸钙和硬脂酸镁、以及聚乙二醇等。另外还可以在组合物中加入其它辅剂如香味剂、甜味剂等。
本发明化合物可以以组合物的形式通过口服、鼻吸入、直肠或肠胃外给药的方式施用于需要这种治疗的患者。用于口服时,可将其制成常规的固体制剂如片剂、粉剂、粒剂、胶囊等,制成液体制剂如水或油悬浮剂或其他液体制剂如糖浆、酏剂等;用于肠胃外给药时,可将其制成注射用的溶液、水或油性悬浮剂等。本发明药物组合物的各种剂型可以按照药学领域的常规生产方法制备。例如使活性成分与一种或多种载体混合,然后将其制成所需的剂型。
所述药物中,优选含有重量比为0.1%~99.5%的活性成分菊科类型环肽或其药理学上容许的盐,最优选含有重量比为0.5%~95%的活性成分。
本发明所述药物的施用量可根据用药途径、患者的年龄、体重、所治疗的疾病的类型和严重程度等变化,其日剂量可以是0.01~10mg/kg体重,优选0.1~5mg/kg体重,可以一次或多次施用。
本发明是通过在mef细胞中检测astinsa-h(1-8)和astinsk-p(9-14)对dna类似物isd刺激激活的cgas-sting信号通路下游基因表达的影响,以及在hsv-1诱导的小鼠血清中ifnβ蛋白表达的影响;发现菊科类型环肽能在体内外抑制cgas-sting信号通路,是该通路的第一个抑制剂,可用于制备治疗相关疾病的药物。所述cgas-sting信号通路异常激活的疾病包括自身免疫性、炎症性疾病和癌症等,如aicardi-goutieres综合症、系统性红斑狼疮等。
本发明中所述的astinsa-h(1-8)和astinsk-p(9-14)的制备方法可参照xu,h.m,etal.astinsk-p,sixnewchlorinatedcyclopentapeptidesfromastertataricus,tereahedron2013,69,7964-7969,以及专利cn102174083b中公开的类似的制备方法。但是上述方法普遍存在提取效率低,过程复杂,样品损失量较大,重复性和可控性差等缺点,本申请中对制备方法做了改进,改进后的制备方法概括地说就是,甲醇浸膏直接经硅胶柱层析,勿需萃取,既简化了分离过程,又减少了样品损失;通过正反相硅胶柱层析可以简便的除去部分色素及其它低极性成分;利用sephadexlh-20凝胶色谱,可分开一部分与环肽分子量相差很大的小分子成分,同时快速富集环肽;利用高效液相色谱(hplc)纯化及重结晶技术,即可成功分离得到环肽。另外,本方法仅利用实验室或工业上常规的层析材料,包括正反相硅胶、sephadexlh-20等。总之,本发明提取分离方法可控性和重现性好,样品损失少,成本较低,操作方便,可分离得到微量环肽,溶剂可以反复回收利用,适用于工业生产。具体制备见实施例部分。
有益效果:本发明首次揭示了菊科类型环肽化合物是一种cgas-sting信号通路抑制剂,能够有效抑制dna类似物isd刺激下cgas-sting信号通路下游基因ifnβ、ifnα4和cxcl10的表达;由此可应用于制备治疗cgas-sting信号通路异常激活的疾病的药物,由于本发明所述的菊科类型环肽化合物为天然化合物,其剂型和用药方式多样化,具有广泛的临床应用前景。
附图说明
图1为本发明的菊科类型环肽化合物的制备方法流程图;
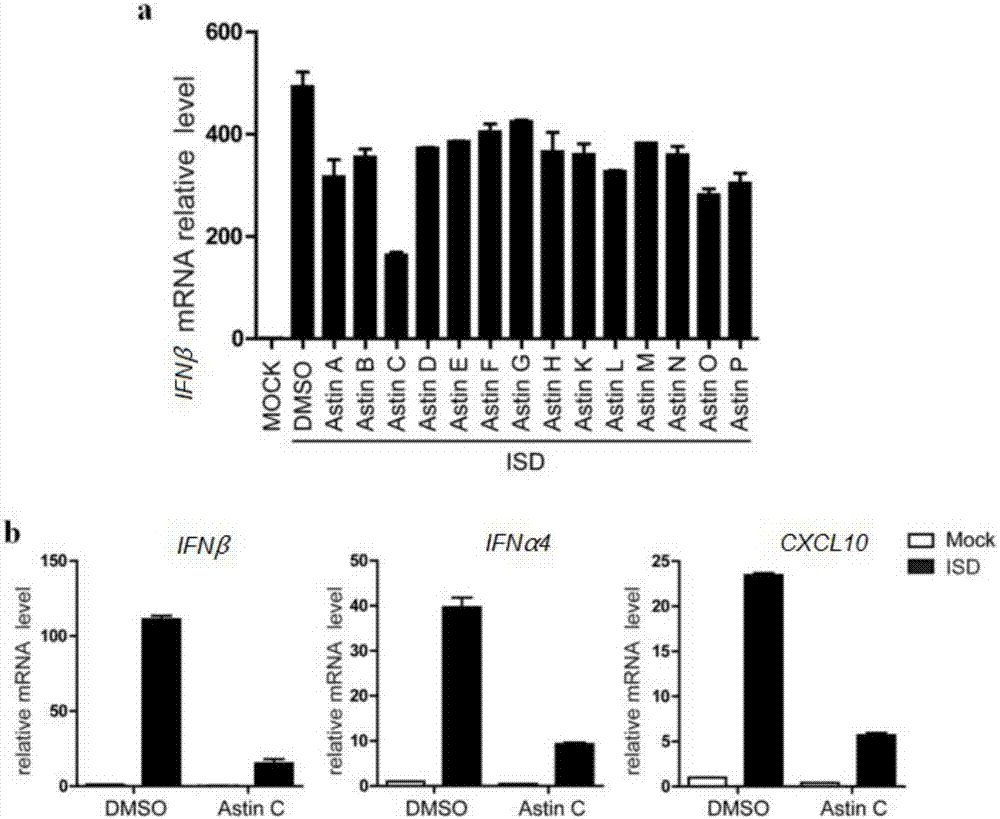
图2a为本发明的菊科类型环肽化合物astinsa-h(1-8)和astinsk-p(9-14)在mef细胞中对dna类似物isd刺激激活的ifnβmrna表达的抑制作用;
图2b为astinc(3)在mef细胞中对dna类似物isd刺激激活的cgas-sting信号通路下游基因ifnβ,ifnα4和cxcl10的表达的影响;
图3为本发明的菊科类型环肽化合物astinc(3)对hsv-1诱导的小鼠血清中ifnβ蛋白表达的影响。
具体实施方式
下面结合具体实施例来进一步说明本发明的实质性内容。
本实施例中使用的设备、材料、试剂除有特殊说明以外,均可以通过市场购买获取。
实施例1
菊科类型环肽化合物astinsa-h(1-8)和astinsk-p(9-14)的制备:(制备方法流程见图1所示)
取紫菀(astertataricusl.)干燥根及根茎10kg,经干燥、粉碎及甲醇浸泡过夜后,用甲醇热回流提取,共提取三次,第一次4小时,第二次4小时,第三次3小时,合并提取液,经减压浓缩得甲醇浸膏4.6kg。该浸膏经硅胶柱层析,用氯仿/甲醇(100:0,9:1,8:2,7:3,1:1,0:100)梯度洗脱,利用环肽tlc检测方法合并含环肽各馏分,得总环肽部位(212.6g);以下的每一过程都须结合环肽tlc检测方法来指导分离纯化。总环肽部位经硅胶柱层析,用100:1-8:2的氯仿/甲醇梯度洗脱,根据环肽点的不同合并为五个组分fr.1–fr.5。对fr.1(64g)经硅胶柱层析,12:1-1:1的石油醚/丙酮梯度洗脱,分离得到三个组分fr.1-1–fr.1-3;fr.1-2(10g)经sephadexlh-20凝胶柱层析,1:1的氯仿/甲醇为洗脱剂,所富集的含有环肽的部分再经硅胶柱层析,10:1-3:1的氯仿/乙酸乙酯梯度洗脱,得到三个组分fr.1-2-1–fr.1-2-3;fr.1-2-1(34mg)组分经odshplc半制备柱纯化,20%乙腈和5‰三氟乙酸为流动相,得到astinl(10)(5mg);fr.1-2-2(231mg)再经硅胶柱层析,1:3的氯仿/乙酸乙酯为洗脱剂,得到astink(9)(20mg)。对fr.2(15g)经硅胶柱层析,2:1-1:2的石油醚/丙酮梯度洗脱,得到五个组分fr.2-1–fr.2-5;其中fr.2-2(2.8g)再经硅胶柱层析,7:1的氯仿/甲醇等度洗脱,得到四个组分fr.2-2-1–fr.2-2-4;fr.2-2-1(786mg)经sephadexlh-20层析,1:1的氯仿/甲醇为洗脱剂,得环肽组分经odshplc半制备柱纯化,35%乙腈和5‰三氟乙酸为流动相,得到astinf(6)(10mg),astinh(8)(15mg)和astinm(11)(7mg);fr.2-3(1.1g)经sephadexlh-20层析,1:1的氯仿/甲醇为洗脱剂,得环肽组分再经硅胶柱层析,20:1-5:1的氯仿/甲醇梯度洗脱,得到四个组分fr.2-3-1–fr.2-3-4,其中fr.2-3-4(41mg)经odshplc半制备柱纯化得到astinn(12)(5mg);fr.2-4(789mg)经硅胶柱层析,20:1-5:1氯仿/甲醇梯度洗脱,得到astind(4)(200mg);fr.2-5(971mg)经sephadexlh-20层析,1:1的氯仿/甲醇为洗脱剂,得两组分fr.2-5-1–fr.2-5-2;其中fr.2-5-1(128mg)经硅胶柱层析,25:1的乙酸乙酯/甲醇等度洗脱,得到astina(1)(12.7mg);fr.2-5-2(78mg)经反复硅胶柱层析,用氯仿/丙酮洗脱分离得到astino(13)(3mg)。对fr.3(30g)经硅胶柱层析,1:1-1:2的石油醚/丙酮梯度洗脱,得到三个组分fr.3-1–fr.3-3;其中fr.3-1(8g)再经硅胶柱层析,3:1-5:1的氯仿/乙酸乙酯为洗脱剂进行梯度洗脱,合并得到五个组分fr.3-1-1–fr.3-1-5。其中fr.3-1-2(3g)经sephadexlh-20层析,1:1的氯仿/甲醇为洗脱剂,合并环肽部分,该部分经甲醇重结晶得到化合物astinc(3)(1.4g);fr.3-2(12g)经rp-18柱层析,10%-80%的甲醇/水梯度洗脱,得到三个组分fr.3-2-1–fr.3-2-3;fr.3-2-2(4.1g)经sephadexlh-20层析,1:1的氯仿/甲醇为洗脱剂,得到富集环肽的部分;该部分再经硅胶层析,20:1-5:1的氯仿/甲醇为洗脱剂梯度洗脱,得到四个组分fr.3-2-2-1–fr.3-2-2-4;fr.3-2-2-2(821mg)经odshplc半制备柱纯化,45%乙腈和5‰三氟乙酸为洗脱剂,得到astinp(14)(12mg)和astine(5)(200mg);fr.3-2-2-3(44mg)经odshplc半制备柱纯化,15%乙腈和5‰三氟乙酸为洗脱剂,得到asting(7)(12mg)。fr.3-2-2-4(1.3g)经硅胶柱层析,1:3-1:9的氯仿/乙酸乙酯梯度洗脱,将环肽部分富集,该部分经sephadexlh-20层析纯化后,再经硅胶柱层析,15:1-5:1氯仿/甲醇梯度洗脱,得到化合物astinb(2)(786mg)。
实施例2
实施例1制备所得菊科类型环肽化合物astinsa-h(1-8)和astinsk-p(9-14)在mef细胞中检测对dna类似物isd刺激激活的cgas-sting信号通路下游基因表达的影响。实验原理、方法和结果如下:
实验原理:在固有免疫信号转导通路中,cgas-sting信号通路能够识别入侵机体的外源dna病原微生物。外源dna刺激能够诱导下游i型干扰素基因和干扰素刺激基因的表达。因此,在外源dna(dna类似物isd)刺激下,通过检测通路下游基因ifnβ,ifnα4和cxcl10的表达可以反映cgas-sting信号通路的激活情况,从而评价化合物对cgas-sting信号通路激活的影响。
实验方法:(1)细胞培养:mef细胞使用含有10%胎牛血清(gibco)及含50u/ml盘尼西林和50μg/ml链霉素的dmem(invotrogen)培养。培养条件为37℃、5%的co2,每两天传代一次;(2)脂质体法转染与化合物处理:将mef细胞铺于12孔细胞培养板中,用10μm相应的化合物和等量的dmso预处理细胞6小时后,用lipo2000(invotrogen)转染5μgisd刺激细胞,6小时后弃去培养液,用pbs将细胞离心收集于ep管中;(3)rna抽提:用500μltrizol将(2)中细胞裂解,然后加入100μlchcl3萃取裂解液中的rna,4℃12000g离心15min,转移200μl最上层清液到新的ep管中,加入等体积的异丙醇将rna沉淀出来,静置10min后,4℃12000g离心10min,去掉上清,加入1ml含75%乙醇的depc水清洗沉淀,4℃7500g离心5min,去掉上清,并在室温干燥沉淀5min,然后用适量的depc水溶解rna进行后续实验;(4)实时荧光定量pcr检测下游基因表达:以(2)中抽提得到细胞总rna为模板,以oligodt为引物,通过逆转录得到cdna。使用powersybrgreenpcrmastermix(abi)试剂进行实时荧光定量pcr,以gadph作为内参基因。
实验结果见图2。其中,图2a为本发明的菊科类型环肽化合物astinsa-h(1-8)和astinsk-p(9-14)在mef细胞中对dna类似物isd刺激激活的ifnβmrna表达的抑制作用;图2b为astinc(3)在mef细胞中对dna类似物isd刺激激活的cgas-sting信号通路下游基因ifnβ,ifnα4和cxcl10的表达的影响。
实验结果显示,菊科类型环肽化合物能够抑制dna类似物isd刺激下cgas-sting信号通路下游基因ifnβ,ifnα4和cxcl10的表达,其中astinc活性最好,说明菊科类型环肽能抑制cgas-sting信号通路活性,是目前发现的第一个该通路的抑制剂。
实施例3
实施例1制备所得菊科类型环肽化合物astinc(3)对hsv-1诱导的小鼠血清中ifnβ蛋白表达的影响。
实验原理:机体内ifnβ蛋白的表达是固有免疫抗感染反应的标志事件,ifnβ表达后能够激活干扰素受体(ifnr)信号转导通路诱导干扰素刺激基因等细胞因子和炎症因子的表达,然后通过招募nk细胞或进一步激活适应性免疫反应等分子机制,最终清除入侵的病原微生物。因此,在dna病毒hsv-1感染小鼠后,通过检测小鼠血清中ifn-β的表达量可以反映机体抗固有抗感染免疫反应的激活情况,从而评价化合物对机体固有抗感染免疫反应活性的影响。
实验方法:(1)构建hsv-1感染小鼠模型:取6-8周龄的野生型小鼠,通过尾静脉注射的方式将100μl滴度为1×107的hsv-1注射入小鼠体内,6h后收集获得血清进行后续实验;(2)化合物处理小鼠方式:通过尾静脉注射的方式向野生型小鼠注射一定浓度的化合物,每隔一天注射一次,注射3次;(3)眼眶取血法收集小鼠血液获得血清:用毛细管刺破小鼠眼眶毛细血管,通过毛细管引流收集200μl外周血到ep管中,室温静置过夜,然后3000rpm离心10min,取上清;(4)elisa检测血清中ifnβ蛋白含量:根据verikine试剂盒(pblassayscience)的实验操作手册上的方法步骤检测小鼠血清中的ifnβ蛋白的含量。
实验结果见图3。
实验结果表明,菊科类型环肽化合物astinc(3)能够明显降低hsv-1诱导的小鼠血清中ifnβ蛋白含量,说明菊科类型环肽能在体内抑制cgas-sting信号通路活性。
实施例4
实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14),加入4%的硫酸乙醇溶液,ph=4,过滤,干燥,制成硫酸盐化合物1-14。
实施例5
实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14),加入4%的盐酸溶液,ph=4,过滤,干燥,制成盐酸盐化合物1-14。
实施例6
实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14),加入4%的酒石酸溶液,ph=4,过滤,干燥,制成酒石酸盐化合物1-14。
实施例7
实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14),加入4%的柠檬酸溶液,ph=4,过滤,干燥,制成柠檬酸盐化合物1-14。
实施例8
片剂:实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14)或实施例4-7所得的盐10mg,乳糖180mg,淀粉55mg,硬脂酸镁5mg。
制备方法:将化合物或其盐、乳糖和淀粉混和,用水均匀湿润,把湿润后的混合物过筛并干燥,再过筛,加入硬脂酸镁,然后将混合物压片,每片重250mg,化合物含量为10mg。
实施例9
安瓿剂:实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14)或实施例4-7所得的盐2mg,氯化钠10mg。
制备方法:将化合物或其盐和氯化钠溶解于适量的注射用水中,过滤所得溶液,在无菌条件下装入安瓿瓶中。
实施例10
注射用冻干剂:实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14)或实施例4-7所得的盐10mg,碳酸氢钠2mg,甘露醇252mg。
制备方法:将碳酸氢钠、甘露醇,加注射用水溶解,加活性碳吸附30分钟除热原,过滤除去活性碳,在滤液中加入化合物或其盐,超声处理使溶解,用1n盐酸调节ph为5.0-7.0,微孔滤膜滤过,加注射用水,分装,冷冻干燥,上塞,轧盖,即得。
实施例11
胶囊剂:实施例1所得化合物astinsa-h(1-8)和astinsk-p(9-14)或实施例4-7所得的盐10mg,乳糖187mg,硬脂酸镁3mg。
制备方法:将化合物或其盐与助溶剂混和,过筛,均匀混合,把得到的混合物装入硬明胶胶囊,每个胶囊重200mg,活性成分含量为10mg。
- 还没有人留言评论。精彩留言会获得点赞!