一种黄连素细粒剂及其制备方法与流程
本发明涉及药物领域,且特别涉及一种黄连素细粒剂及其制备方法。
背景技术:
目前,市场上的黄连素制剂因药物释放迅速、味苦、口服吸收差、胃肠道滞留时间短和生物利用度低等,用于降血糖和调血脂时需要大剂量频繁服药,患者顺应性差,不能满足长期用药的要求。
黄连素味极苦,现市场上口服剂型有片剂、胶囊剂、丸剂等形式,制成胶囊或片剂包衣后可以掩盖药物的气味,但是不适合老人儿童等吞服困难的人群服用,但制备成普通的颗粒剂对于儿童服药依从性差。
此外,现市场上对黄连素制剂大多是制作成微丸或细粒剂来掩盖气味,微丸主要是采用胃溶包衣材料进行包衣;细粒剂其中许多细粒剂通过喷雾干燥法制备造粒。以上方法制备的微丸或细粒剂表面不均匀和颗粒缝隙大,效果仍然不理想。
有鉴于此,提出本发明。
技术实现要素:
本发明的目的在于提供一种黄连素细粒剂的制备方法,先包一层包埋黄连素苦味的保护膜,再包一层肠溶衣膜的保护膜,既掩盖了黄连素的苦味又达到局部给药的效果。
本发明的另一目的在于提供一种黄连素细粒剂,具有粒径较小、圆整度好、均匀度好和收率较高等特点,适宜儿童直接口服或以水送服,顺应性较高。
本发明解决其技术问题是采用以下技术方案来实现的。
本发明提出一种黄连素细粒剂的制备方法,包括:
黄连素包合物、填充剂、粘合剂、崩解剂和润滑剂制成软材,将软材造粒和干燥得到细粒,将肠溶材料制成肠溶包衣液后,包衣于细粒。
本发明提出一种黄连素细粒剂,根据上述的黄连素细粒剂的制备方法制得。
本发明实施例的有益效果是:
本发明实施例的黄连素细粒剂的制备方法,先通过环糊精包合黄连素,掩盖黄连素的苦味;再通过包覆肠溶包衣膜,进一步掩盖黄连素的苦味,同时,实现在肠道中给药,减少黄连素对胃的刺激,提高用药的生物利用度。
本发明实施例的黄连素细粒剂,先包一层包埋黄连素苦味的保护膜,再包一层肠溶衣膜的保护膜,既掩盖了黄连素的苦味又达到局部给药的效果。同时,黄连素细粒剂具有粒径较小、圆整度好、均匀度好和收率较高等特点,适宜儿童直接口服或以水送服,顺应性较高。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
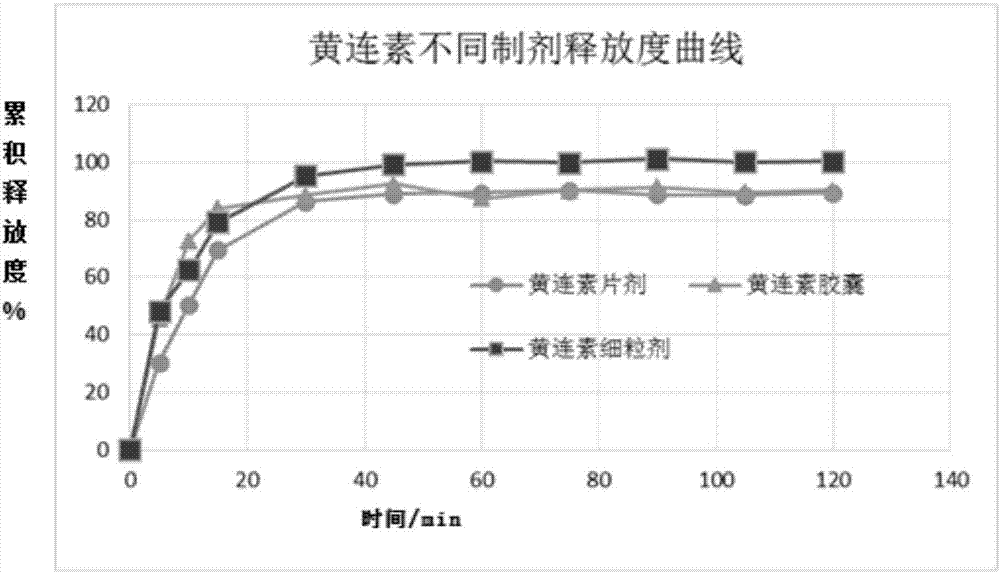
图1为本发明试验例1提供的黄连素不同制剂释放度曲线。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的黄连素细粒剂及其制备方法进行具体说明。
一种黄连素细粒剂的制备方法,包括:
制备黄连素包合物。
采用研磨法制备黄连素包合物。具体地,将水加入到胶体磨内后,向胶体磨内加入包合剂并和水相互研磨,使得水和包合剂混合均匀。之后,再向胶体磨内加入黄连素粉末研磨至糊状,在45~60℃的温度下搅拌1~3h使得包合剂将黄连素充分包合。将糊状的研磨产物采用静置的方式将温度降低至20~25℃,放置于1~5℃的温度下冷藏12~36h。对冷藏后的糊状的研磨产物在50~70℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%。再次,将其研磨至100~120目的粉末,得到黄连素包合物。
其中,包合剂选自环糊精。具体地,可以是α-环糊精、β-环糊精、甲基-β-环糊精和γ-环糊精中的至少一种。
可以理解,α-环糊精、β-环糊精、甲基-β-环糊精和γ-环糊精为主分子,黄连素为客分子。通过α-环糊精、β-环糊精、甲基-β-环糊精和γ-环糊精的包合作用,能够有效掩盖黄连素的苦味。
对黄连素包合物进行挤出造粒。
将黄连素包合物制备成软材。具体地,在18~26℃的温度和45~50%的相对湿度下,将10~70wt%的黄连素包合物、20~80wt%的填充剂、5~20wt%的粘合剂、2~7wt%的崩解剂和0~5wt%的润滑剂加入到高效湿法混合制粒机内进行干混,控制高效湿法混合制粒机的干混频率为35hz,并在该干混频率下将上述物料干混3~5min,以使得上述物料混合均匀,得到混合物。
其中,填充剂选自微晶纤维素、乳糖、糊精和甘露醇中的至少一种。可以理解,填充剂既可以选自上述四种填充剂中的至少一种,也可以选自上述四种填充剂中的至少两种的任意比例的混合物。
粘合剂选自聚乙烯基吡咯烷酮水溶液、明胶、羟丙基甲基纤维素和高取代羟丙基纤维素中的至少一种。可以理解,粘合剂既可以选自上述四种粘合剂中的至少一种,也可以选自上述四种粘合剂中的至少两种的任意比例的混合物。
崩解剂选自羧甲基纤维素钠、低取代羟丙基纤维素和交联聚乙烯吡咯烷酮中的至少一种。可以理解,崩解剂既可以选自上述三种崩解剂中的至少一种,也可以选自上述三种崩解剂中的至少两种的任意比例的混合物。
润滑剂选自硬脂酸镁、滑石粉和微分硅胶中的至少一种。可以理解,润滑剂既可以选自上述三种润滑剂中的至少一种,也可以选自上述三种润滑剂中的至少两种的任意比例的混合物。
润湿剂选自水或20~60vt%的乙醇溶液。
按照润湿剂与混合物的质量比为1:0.3~1,向混合物加入湿润剂进行湿混,控制高效湿法混合制粒机的湿混频率为37hz,并在该湿混频率下将润湿剂和混合物湿混3~4min,得到软材。
对软材进行挤出造粒。
将软材加入挤出滚圆机的挤出机内,软材在10~50r/min通过挤出设备的孔径为0.2~1.0mm的筛板,挤出为多个0.2~1.0mm的药条。
将药条加入到挤出滚圆机的滚圆内,在800~1500r/min的转速下滚圆10~30min,得到粒径为0.2~1mm的微粒。得到的微粒具有粒径较小、圆整度好、均匀度好和收率较高等特点。
对微粒进行干燥得到细粒。
在45~70℃的温度下对微粒进行干燥,直至微粒的水分含量为≤3wt%以达到恒重,得到细粒。
为了保证制备的黄连素细粒剂的均一性,对细粒进行过筛以选取粒径为125~850μm的细粒。优选地,细粒的粒径为180~500μm。
制备肠溶包衣液。
肠溶材料与所述细粒的质量比为0.05~0.5:1,备取肠溶原料。作为优选,按照肠溶材料与细粒的质量比为0.1~0.3:1,备取肠溶原料。
具体地,肠溶原料包括55~85wt%的肠溶包衣剂、5~30wt%的增塑剂和5~20wt%的抗粘剂。
将肠溶包衣剂和细粒的0.3~2质量倍数的溶剂混合均匀,并向其中加入增塑剂和抗粘剂进一步混合均匀,之后,使用100目的筛网过滤,取滤液得到肠溶包衣液。
其中,肠溶包衣剂选自尤特奇l30d-55、尤特奇l100和醋酸纤维素苯三酸酯中的至少一种。可以理解,肠溶包衣剂既可以选自上述三种肠溶包衣剂中的至少一种,也可以选自上述三种肠溶包衣剂中的至少两种的任意比例的混合物。
增塑剂选自柠檬酸三乙酯、单双硬脂酸甘油酯和聚乙二醇中的至少一种。可以理解,增塑剂既可以选自上述三种增塑剂中的至少一种,也可以选自上述三种增塑剂中的至少两种的任意比例的混合物。
抗粘剂选自滑石粉、二氧化硅和硬脂酸镁中的至少一种。可以理解,抗粘剂既可以选自上述三种抗粘剂中的至少一种,也可以选自上述三种抗粘剂中的至少两种的任意比例的混合物。
溶剂选自纯化水。纯化水为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水。
将肠溶包衣液包衣于细粒。
包衣在多功能流化床内进行。将细粒加入到多功能流化床,控制多功能流化床的进风温度为30~40℃,肠溶包衣液的雾化压力为0.1~0.4mpa,细粒的温度为25~30℃,蠕动泵的流量为1.5~5.0ml/min·kg-1。
亦即,肠溶包衣液在30~40℃的进风速度和0.1~0.4mpa的雾化压力下,喷涂于25~30℃的温度和1.5~5.0ml/min·kg-1的流量的细粒,在细粒的表面形成完成和均匀的肠溶包衣膜。之后,在40~65℃的温度对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化。
通过控制多功能流化床的包衣参数,使得肠溶包衣膜的厚度为10~60μm。即为表面光滑和均匀度好的肠溶包衣膜,既能够进一步掩盖黄连素苦味,还能够实现黄连素细粒剂在肠道中给药,减少对胃的刺激。
承上述,通过上述的黄连素细粒剂的制备方法制得的黄连素细粒剂。先通过β-环糊精或甲基-β-环糊精包合黄连素,掩盖黄连素的苦味;再通过包覆肠溶包衣膜,进一步掩盖黄连素的苦味,同时,实现在肠道中给药,减少黄连素对胃的刺激,提高用药的生物利用度。
进一步地,黄连素细粒剂通过包合、挤出和滚圆的方式造粒,其颗粒小,优选粒径在180~500um,在此粒径范围内药物溶出效果和掩味效果好;同时,采用肠溶包衣液进行包衣后,能够实现肠道定点释放,减少药物在胃中刺激,提高了药物的生物利用度。不仅能达到快速起效的目的,而且适宜儿童服用,依从性较高。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入2重量份的γ-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在47℃的温度下搅拌2.5h后静置,再放置于2℃的温度下冷藏24h。之后,对冷藏后的糊状的研磨产物在55℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至100目的粉末,得到黄连素包合物。
备取10重量份的黄连素包合物、79重量份的微晶纤维素、乳糖、糊精和甘露醇的混合物、8重量份的聚乙烯基吡咯烷酮水溶液、明胶、羟丙基甲基纤维素和高取代羟丙基纤维素的混合物以及3重量份的羧甲基纤维素钠、低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物加入高效湿法混合制粒机内,在35hz的频率干混3~5min,得到混合物,向混合物中加入0.3质量倍数的20~60vt%的乙醇,在37hz的频率下湿混4min得到软材。
将软材加入到挤出机内,在10~50r/min的挤出速度下挤成0.2~1.0mm药条后,将药条加入滚圆机内,在800~1500r/min的滚圆转速下滚圆10~30min,得到微粒。在45~70℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.12:1,备取肠溶原料。将肠溶材料的55wt%的尤特奇l30d-55、尤特奇l100和醋酸纤维素苯三酸酯的混合物与27.5重量份数的纯化水混合均匀后,加入肠溶材料的25wt%的柠檬酸三乙酯、单双硬脂酸甘油酯和聚乙二醇的混合物以及肠溶材料的20wt%的滑石粉、二氧化硅和硬脂酸镁的混合物再混合均匀,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在30℃的进风速度和0.4mpa的雾化压力下,喷涂于30℃的温度和5.0ml/min·kg-1的流量的细粒。之后,在47℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例2
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入3重量份的β-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在50℃的温度下搅拌1.5h后静置,再放置于2℃的温度下冷藏24h。之后,对冷藏后的糊状的研磨产物在50℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至120目的粉末,得到黄连素包合物。
备取30重量份的黄连素包合物、53重量份的微晶纤维素、乳糖、糊精和甘露醇的混合物、12重量份的聚乙烯基吡咯烷酮水溶液和明胶的混合物、4重量份的低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物以及1重量份的硬脂酸镁加入高效湿法混合制粒机内,在35hz的频率干混3~5min,得到混合物,向混合物中加入0.4质量倍数的水,在37hz的频率下湿混3min得到软材。
将软材加入到挤出机内,在24r/min的挤出速度下挤成0.3mm药条后,将药条加入滚圆机内,在850r/min的滚圆转速下滚圆28min,得到微粒。在68℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.15:1,备取肠溶原料。将肠溶材料的80wt%的尤特奇l30d-55和醋酸纤维素苯三酸酯的混合物与64重量份数的纯化水混合均匀后,加入肠溶材料的15wt%的柠檬酸三乙酯和单双硬脂酸甘油酯的混合物以及肠溶材料的5wt%的滑石粉再混合均匀,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在33℃的进风速度和0.25mpa的雾化压力下,喷涂于27℃的温度和2.0ml/min·kg-1的流量的细粒。之后,在50℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例3
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入3.5重量份的甲基-β-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在45℃的温度下搅拌3h后静置,再放置于1℃的温度下冷藏18h。之后,对冷藏后的糊状的研磨产物在50℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至110目的粉末,得到黄连素包合物。
备取45重量份的黄连素包合物、34重量份的微晶纤维素、乳糖、糊精和甘露醇的混合物、14重量份的聚乙烯基吡咯烷酮水溶液、明胶、羟丙基甲基纤维素和高取代羟丙基纤维素的混合物、5重量份的羧甲基纤维素钠、低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物以及2重量份的硬脂酸镁、滑石粉和微分硅胶混合物加入高效湿法混合制粒机内,在35hz的频率干混5min,得到混合物,向混合物中加入0.5质量倍数的水,在37hz的频率下湿混4min得到软材。
将软材加入到挤出机内,在18r/min的挤出速度下挤成0.6mm药条后,将药条加入滚圆机内,在1250r/min的滚圆转速下滚圆14min,得到微粒。在52℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.2:1,备取肠溶原料。将肠溶材料的70wt%的尤特奇l30d-55和尤特奇l100的混合物与84重量份数的纯化水混合均匀后,加入肠溶材料的12wt%的柠檬酸三乙酯和肠溶材料的18wt%的二氧化硅再混合均匀,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在307℃的进风速度和0.2mpa的雾化压力下,喷涂于27℃的温度和1.9ml/min·kg-1的流量的细粒。之后,在46℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例4
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入4重量份的β-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在50℃的温度下搅拌2h后静置,再放置于3℃的温度下冷藏36h。之后,对冷藏后的糊状的研磨产物在60℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至120目的粉末,得到黄连素包合物。
备取60重量份的黄连素包合物、30重量份的微晶纤维素和糊精的混合物、5重量份的聚乙烯基吡咯烷酮水溶液、羟丙基甲基纤维素和高取代羟丙基纤维素的混合物、2重量份的低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物以及3重量份的硬脂酸镁、滑石粉和微分硅胶混合物再加入高效湿法混合制粒机内,在35hz的频率干混3min,得到混合物,向混合物中加入0.6质量倍数的30vt%的乙醇,在37hz的频率下湿混4min得到软材。
将软材加入到挤出机内,在40r/min的挤出速度下挤成1.0mm药条后,将药条加入滚圆机内,在1100r/min的滚圆转速下滚圆20min,得到微粒。在50℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.24:1,备取肠溶原料。将肠溶材料的65wt%的尤特奇l30d-55与110重量份数的纯化水混合均匀后,加入肠溶材料的28wt%的单双硬脂酸甘油酯和聚乙二醇的混合物和肠溶材料的7wt%的二氧化硅和硬脂酸镁的混合物再混合均匀,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在35℃的进风速度和0.2mpa的雾化压力下,喷涂于26℃的温度和2.2ml/min·kg-1的流量的细粒。之后,在53℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例5
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入4.5重量份的甲基-β-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在60℃的温度下搅拌1.5h后静置,再放置于4℃的温度下冷藏20h。之后,对冷藏后的糊状的研磨产物在60℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至120目的粉末,得到黄连素包合物。
备取55重量份的黄连素包合物、25重量份的微晶纤维素、乳糖、糊精和甘露醇的混合物、10重量份的聚乙烯基吡咯烷酮水溶液、明胶、羟丙基甲基纤维素和高取代羟丙基纤维素的混合物、6重量份的羧甲基纤维素钠、低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物以及4重量份的硬脂酸镁、滑石粉和微分硅胶混合物加入高效湿法混合制粒机内,在35hz的频率干混3~5min,得到混合物,向混合物中加入0.7质量倍数的水,在37hz的频率下湿混3min得到软材。
将软材加入到挤出机内,在30r/min的挤出速度下挤成0.6mm药条后,将药条加入滚圆机内,在1000r/min的滚圆转速下滚圆20min,得到微粒。在65℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.28:1,备取肠溶原料。将肠溶材料的75wt%的尤特奇l30d-55、尤特奇l100和醋酸纤维素苯三酸酯的混合物与112.5重量份数的纯化水混合均匀后,加入肠溶材料的12wt%的柠檬酸三乙酯和单双硬脂酸甘油酯的混合物和肠溶材料的13wt%的滑石粉和硬脂酸镁的混合物再混合均匀,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在30℃的进风速度和0.3mpa的雾化压力下,喷涂于25℃的温度和4.0ml/min·kg-1的流量的细粒。之后,在40℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例6
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入5重量份的β-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在52℃的温度下搅拌2h后静置,再放置于5℃的温度下冷藏30h。之后,对冷藏后的糊状的研磨产物在50℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至120目的粉末,得到黄连素包合物。
备取15重量份的黄连素包合物、55重量份的微晶纤维素和甘露醇的混合物、20重量份的明胶和羟丙基甲基纤维素的混合物、5重量份的低取代羟丙基纤维素以及5重量份的硬脂酸镁加入高效湿法混合制粒机内,在35hz的频率干混3min,得到混合物,向混合物中加入0.8质量倍数的水,在37hz的频率下湿混4min得到软材。
将软材加入到挤出机内,在100r/min的挤出速度下挤成0.4mm药条后,将药条加入滚圆机内,在900r/min的滚圆转速下滚圆15min,得到微粒。在55℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.3:1,备取肠溶原料。将肠溶材料的60wt%的醋酸纤维素苯三酸酯与78重量份数的纯化水混合均匀后,加入肠溶材料的23wt%的单双硬脂酸甘油酯和聚乙二醇的混合物和肠溶材料的17wt%的二氧化硅再混合均匀后,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在32℃的进风速度和0.16mpa的雾化压力下,喷涂于28℃的温度和3.5ml/min·kg-1的流量的细粒。之后,在45℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
实施例7
制备黄连素包合物。将水加入到胶体磨内后,向胶体磨内加入6重量份的α-环糊精并和水相互研磨混合均匀。再向胶体磨内加入1重量份的黄连素粉末继续研磨至糊状。在48℃的温度下搅拌3h后静置,再放置于3℃的温度下冷藏25h。之后,对冷藏后的糊状的研磨产物在55℃的温度下进行干燥,直至糊状的研磨产物的水分含量为≤1.5wt%,将其研磨至120目的粉末,得到黄连素包合物。
备取20重量份的黄连素包合物、67重量份的微晶纤维素和乳糖的混合物、11重量份的聚乙烯基吡咯烷酮水溶液以及2重量份的低取代羟丙基纤维素和交联聚乙烯吡咯烷酮的混合物加入高效湿法混合制粒机内,在35hz的频率干混3.5min,得到混合物,向混合物中加入0.9质量倍数的36vt%的乙醇,在37hz的频率下湿混3.5min得到软材。
将软材加入到挤出机内,在40r/min的挤出速度下挤成0.8mm药条后,将药条加入滚圆机内,在1500r/min的滚圆转速下滚圆17min,得到微粒。在62℃的温度下对微粒进行干燥至水分≤3wt%,得到细粒。
制备肠溶包衣液。按照肠溶材料与细粒的质量比为0.19:1,备取肠溶原料。将肠溶材料的85wt%的尤特奇l30d-55和醋酸纤维素苯三酸酯的混合物与34重量份数的纯化水混合均匀后,加入肠溶材料的6wt%的柠檬酸三乙酯和单双硬脂酸甘油酯的混合物和肠溶材料的9wt%的二氧化硅再混合均匀后,使用100目的筛网过滤,得到肠溶包衣液。
将细粒加入到多功能流化床,肠溶包衣液在40℃的进风速度和0.35mpa的雾化压力下,喷涂于25℃的温度和1.5ml/min·kg-1的流量的细粒。之后,在65℃的温度下对包衣肠溶包衣液的细粒进行干燥,使肠溶包衣膜熟化得到黄连素细粒。
试验例1
黄连素细粒剂释放度试验:
细粒剂是在颗粒剂的基础上发展起来的一种剂型。在日本药典jp16中将全部通过18号筛(850um),在30号筛(500um)上残留物不超过全量的10%的颗粒称为细粒剂。细粒剂服用方便,可以直接吞服,也可冲入水中饮入,适用于不同年龄段的患者,溶出和吸收速度较快,生物利用度高。本制剂通过分子包合技术将黄连素包裹,通过挤出滚圆制粒并优选粒径范围合适的细粒进行肠溶包衣,现对本制剂制作的优势进行对比研究。
选取实施例3制备的黄连素细粒剂与现市场上黄连素制剂的对比试验。具体地。选取实施例3制备的黄连素细粒剂、市场上现售的黄连素片剂和市场上现售的黄连素胶囊剂,进行药物释放度比较,对比药物释放的有效含量。其中,市场上现售黄连素片剂和黄连素胶囊剂均为胃溶型制剂。
试验方法:取现市售的黄连素片剂、黄连素胶囊剂和实施例3制备的黄连素细粒剂适量,按照《中国药典》第四部0931第二法测定,其中黄连素片剂、黄连素胶囊剂采用人体胃液生理环境(含胃蛋白酶),以ph=1.2的盐酸溶液为溶出介质;而实施例3制备的黄连素肠溶细粒剂用小肠生理环境(含胰酶),以ph=6.8的磷酸盐缓冲液为溶出介质。设置转速100r/min,温度37℃±0.5℃,依法操作,进行释放度试验,分别于5、10、15、30、45、60、75、90、105和120min取样5ml溶液,滤过,取续滤液20ul注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算出药物累积释放量。不同剂型黄连素的释放度结果如表1;不同剂型黄连素的释放度曲线如图1。
表1黄连素不同制剂的释放度
从表1和图1可以看出,实施例3制备的黄连素细粒剂的释放度明显高于市售的黄连素片剂和黄连素胶囊剂。并且,黄连素细粒剂的释放度在肠道中30min可达到95%以上,2h内稳定在99~101%之间,均高于市售的黄连素片剂和黄连素胶囊的溶出度。
因此,可以看出黄连素制剂在胃中给药,可能受胃酸的强烈刺激影响药物的含量,明显降低有效释放量。再者,从表1还可以看出,实施例3制备的黄连素细粒剂虽然采用β-环糊精包合技术来掩盖黄连素的苦味,但同样30min即可全部释放并达到稳定。其与市售的黄连素片剂和黄连素胶囊剂相比,释放度高,优势明显。可以理解,本方案制成肠溶细粒剂,可提高用药的生物利用度和制剂稳定性。
试验例2
黄连素细粒剂释放度测定对比试验:
取实施例3制备的黄连素细粒剂适量,按照《中国药典》第四部中0931中的第二法测定,利用胃肠道生理ph阶梯,模拟人体胃生理环境(含胃蛋白酶)并以0.1mol/l盐酸为溶出介质;模拟小肠生理环境(含胰酶),以ph=6.8和ph=7.4磷酸盐缓冲液为溶出介质;同时再以纯化水(ph=5.8)为溶出介质;分别在胃液、小肠、水中来考察黄连素细粒剂的释放度。设置转速为75r/min,温度37℃±0.5℃,依法操作,分别于5、10、15、30、45、60、75、90、105和120min取样5ml溶液,滤过,取续滤液20ul注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算出药物累积释放量。黄连素细粒剂在不同介质中的释放度结果见表2。
表2黄连素细粒剂在不同介质中的释放度
从表2可以看出,实施例3制备的黄连素细粒剂在纯化水中不溶解;在ph=1的模拟人工胃液中几乎不溶解,在2小时内其药物含量小于2.86%,小于标示量的10%,符合相关标准的要求;在人工肠液ph=6.8和ph=7.4生理环境下药物的释放度相对集中,半小时内在肠道中药物释放量可达到90%,2h平均药物释放量在99~102%之间。因此,实施例3制备的黄连素细粒剂能够在小肠中安全释放,并且药物分布均匀;有效提高药物的生物利用度。
试验例3
黄连素细粒剂的加速稳定性试验:
取实施例3制备的黄连素细粒剂适量,置于温度为40±2℃,相对湿度为75%±5%的培养箱中放置6个月,分别于0、1、2、3和6个月取样,并测定样品的性状、干燥失重、有关物质和含量。其结果见表3。
表3加速稳定性试验数据
从表3可以看出,黄连素细粒剂在40±2℃,相对湿度为75%±5%条件下进行6个月的加速实验过程中,与0月下实施例3的样品相比,加速测定样品的性状、有关物质、干燥失重和含量均符合规定,各项检测指标无明显的变化。说明实施例3制备的黄连素细粒剂具有稳定性良好的特点。
综上所述,本发明实施例的黄连素细粒剂的制备方法,先通过环糊精包合黄连素,掩盖黄连素的苦味;再通过包覆肠溶包衣膜,进一步掩盖黄连素的苦味,同时,实现在肠道中给药,减少黄连素对胃的刺激,提高用药的生物利用度。
本发明实施例的黄连素细粒剂,先包一层包埋黄连素苦味的保护膜,再包一层肠溶衣膜的保护膜,既掩盖了黄连素的苦味又达到局部给药的效果。同时,黄连素细粒剂具有粒径较小、圆整度好、均匀度好和收率较高等特点,适宜儿童直接口服或以水送服,顺应性较高。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!