一种基于PD‑L1抗体的纳米粒子及其制备方法与应用与流程
本发明属于药物制剂技术领域,更具体地说,涉及一种纳米粒子及其制备方法与应用。
背景技术:
传统剂型的化疗药物受限于其非特异性的生物分布而对肿瘤的疗效有限,且对正常组织的副作用呈现出多样性和普遍性。随着人们对分子生物学和分子化学认识的不断深入,采用纳米剂型优化化疗药物的临床应用在近年来成为研究热点。几种紫杉类药物的纳米剂型已经完成了临床转化,如白蛋白紫杉醇(商品名abraxane)已经在美国等国家上市,聚合胶束型紫杉醇(商品名genexol-pm)已经在韩国上市。然而,上述已上市的药物均属于被动靶向制剂,其靶向效应多依赖于药物或其载体的尺寸效应,故上述药物的靶向效果并不甚理想。为此,基于抗原-抗体反应等原理的主动靶向剂型的药物设计策略应运而生,寻找合适的抗体对载药纳米材料的表面进行修饰,从而进一步提高纳米剂型对化疗药物的肿瘤靶向性投递效率,具有重要意义。
近年来的研究发现,程序性死亡受体-配体1(programmedcelldeath-ligand1,pd-l1)表达于多种肿瘤细胞表面,肿瘤浸润淋巴细胞表面的程序性死亡分子-1(programmedcelldeath-1,pd-1)与pd-l1结合后功能将被抑制,t细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号,这是肿瘤免疫逃逸的重要机制之一。抑制pd-1/pd-l1这一负性免疫调控通路,提高抗肿瘤免疫应答,促进效应t细胞对肿瘤杀伤的治疗策略在近两年中取得了长足的进步。例如,2014年9月4日,一种pd-1单克隆抗体pembrolizumab(商品名keytruda)获美国fda批准上市,用于晚期黑色素瘤和转移性黑色素瘤的治疗。2016年5月19日,fda提前四个月批准了罗氏旗下基因泰克的pd-l1抗体atezolizumab(商品名tecentriq),作为二线药物用于治疗最常见晚期膀胱癌中最常见的类型-尿路上皮癌。同时fda还批准了ventana的pd-l1伴随诊断试剂sp142。pd-1/pd-l1抗体自问世以来就备受药物研发者热切关注,据researchandmarkets2017年1月发布的报告显示,pd-1/pd-l1抑制剂2016年的全球市场份额达到了49.26亿美元,并且到2025年将以23.4%的复合年增长率增长,预计峰值能达到350亿美元,庞大的市场引发了国内外企业纷纷加入pd-1/pd-l1单抗的研究开发行列。但是,pd-l1单抗是单纯依赖t细胞杀死肿瘤细胞的,其能力毕竟有限,如何将pd-l1单抗与抗肿瘤化学药物结合起来,综合两者的优势成为目前本领域的重要研究方向。
载药纳米粒子是一类微观胶质的纳米微球和纳米微囊,药物分布在囊膜上的独立小孔中。不连接任何单抗的纳米粒子只能通过实体瘤的高通透性和滞留(enhancedpermeabilityandretentioneffect,epr)效应达到“被动靶向”,为了进一步提高载药纳米粒子的靶向性,可以对纳米粒子的表面进行适当的修饰,例如在纳米粒子的表面修饰上适合的抗体,利用抗原-抗体反应,纳米粒子可靶向性的聚集于表达相应抗原的肿瘤细胞,以实现“主动靶向”作用。但是该过程需要考虑纳米粒子与抗体之间的相互影响以及修饰方法对抗体的性能、生物活性等方面的影响。目前关于pd-l1单抗与纳米材料相结合的领域还未被充分认识到,也缺乏有效的手段将pd-l1单抗与纳米材料连接起来制备靶向性高的纳米药物。
技术实现要素:
因此,本发明要解决的技术问题在于克服现有技术中单纯依靠传统剂型的抗肿瘤化疗药物或pd-l1抗体治疗肿瘤效果有限的缺陷,从而提供一种基于pd-l1抗体的纳米粒子。
本发明要解决的另一个技术问题在于填补现有技术中缺少有效的手段将pd-l1单抗与纳米材料连接起来制备靶向性高的纳米药物的空白,从而提供一种基于pd-l1抗体的纳米粒子的制备方法。
为解决上述技术问题,本发明采用的技术方案如下:
一种基于pd-l1抗体的纳米粒子,所述纳米粒子是由pd-l1抗体与nh2-peg-pcl纳米粒子通过化学键连接而成。
优选的是,所述pd-l1抗体与所述nh2-peg-pcl纳米粒子的重量比为1:1~10。
优选的是,所述基于pd-l1抗体的纳米粒子的粒径为120~180nm。
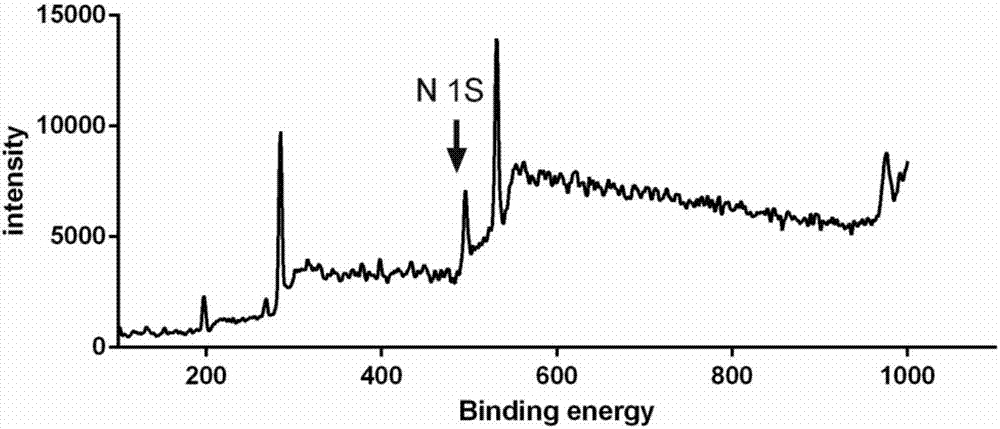
优选的是,所述基于pd-l1抗体的纳米粒子的xps图谱中c-n键中氮的1s电子结合能特征峰为496ev。
所述的基于pd-l1抗体的纳米粒子的制备方法,包括以下步骤:
s1、将nh2-peg-pcl纳米粒子分散于非质子性有机溶剂中得到悬浮液,将pd-l1抗体分散于ph=8.0~9.0的硼酸盐缓冲液中形成抗体溶液;
s2、将所述抗体溶液与所述悬浮液混合,并于不断搅拌条件下缓慢加入戊二醛溶液以进行反应,反应时间不少于10h;
s3、向步骤s2的反应体系中加入乙醇胺以终止反应,离心,收集沉淀物即可。
优选的是,所述硼酸盐缓冲液的ph值为8.4。
优选的是,所述非质子性有机溶剂为二氯甲烷、三氯甲烷、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺中的一种或几种。
优选的是,每100ml所述非质子性有机溶剂中分散有1g的所述nh2-peg-pcl纳米粒子。
优选的是,每100ml所述硼酸盐缓冲液中分散有1g的所述pd-l1抗体。
所述nh2-peg-pcl纳米粒子的制备包括:将peg-pcl、三乙胺和对甲苯磺酰氯溶于非质子性有机溶剂中,0~5℃下反应,待反应结束后收集沉淀,即为所述nh2-peg-pcl纳米粒子。
所述基于pd-l1抗体的纳米粒子在制备药物制剂中的应用。
本发明的技术方案,具有如下优点:
(1)本发明提供的基于pd-l1抗体的纳米粒子,是由pd-l1抗体与nh2-peg-pcl纳米粒子通过化学键连接而成,具体地讲是通过pd-l1抗体中的羧基与nh2-peg-pcl纳米粒子中的氨基形成酰胺键来实现二者的连接。本发明通过将pd-l1抗体修饰于peg-pcl纳米粒子表面,不仅能够进一步提高纳米载体的靶向性,而且还可发挥pd-l1抗体自身独特的细胞毒免疫治疗效果,所以说,本发明的纳米粒子成功结合了pd-l1抗体及纳米载体的优势,将其用于运载化疗药物、中药单体、microrna等,可显著增强药物的靶向效应,通过精准地控制给药时间、给药部位和给药剂量,从而降低组合用药的复杂性,同时还可发挥化疗药物与免疫治疗药物潜在的协同作用,且毒副作用小。
(2)本发明提供的基于pd-l1抗体的纳米粒子的制备方法,通过添加戊二醛溶液,有助于pd-l1抗体与nh2-peg-pcl纳米粒子之间的化学键连接,且二者间的结合能较大,结合作用力较强,从而易于实现对化疗药物的靶向性运载以更好地发挥其疗效。本发明所述的方法工艺简单,可操作性强、可重复性高。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为peg-pcl材料的xps谱图;
图2为本发明实施例1提供的基于pd-l1抗体的纳米粒子的xps谱图;
图3为本发明实施例1提供的基于pd-l1抗体的纳米粒子的电镜图;
图4为本发明实施例1提供的基于pd-l1抗体的纳米粒子、peg-pcl对胃癌细胞系bgc823的作用效果对比图;
图5为本发明实施例1提供的基于pd-l1抗体的纳米粒子、peg-pcl对肺癌细胞系a549的作用效果对比图。
具体实施方式
下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
实施例1:基于pd-l1抗体的纳米粒子的制备
(1)制备peg-pcl:将50gmpeg(mn=5000,10mmol)、1.15gε-cl(购自美国fluka公司,10mmol)和0.05g辛酸亚锡置于聚合管中,并用150ml干燥的二氯甲烷溶解原料,真空下封管,130℃下反应48小时,待反应得到的粗产物凝固后再用150ml二氯甲烷溶解,后加入大量的无水乙醚至沉淀不再产生为止,用100ml冷乙醚反复洗涤沉淀三次后收集沉淀并减压干燥,所得产品密封保存待用;
(2)取10.2gpeg-pcl(2mmol)、2.8ml三乙胺(20mmol)和3.8ml对甲苯磺酰氯(20mmol)溶于100ml二氯甲烷中,在冰水浴条件下反应至tlc检测反应结果不再变化时停止反应,后加入大量的无水乙醚至沉淀不再产生为止,用50ml冷乙醚反复洗涤沉淀三次后收集沉淀并常温干燥得到nh2-peg-pcl,所得产品密封保存待用;
(3)取20mgnh2-peg-pcl充分溶于2ml二氯甲烷中制成重量百分浓度为10mg/ml的溶液;将10mgatezolizumab稀释于1ml硼酸盐缓冲液中(ph=8.4)制成重量百分浓度为10mg/ml的溶液;
(4)加1ml上述稀释得到的单克隆抗体溶液到1mlnh2-peg-pcl溶液混合;
(5)搅拌条件下,将200ul25wt%戊二醛溶液缓慢的加入上述溶液;
(6)反应16h,加入1mol/l乙醇胺至体系不再发生变化为止;
(7)离心,收集纳米粒子,用10ml硼酸盐缓冲液(0.2mol/l,ph=8.4)冲洗三次,冻干,得到基于pd-l1抗体的纳米粒子。
实施例2:基于pd-l1抗体的纳米粒子的制备
(1)制备peg-pcl:将50gmpeg(mn=5000,10mmol)、1.15gε-cl(购自美国fluka公司,10mmol)和0.05g辛酸亚锡置于聚合管中,并用150ml干燥的无水甲苯溶解原料,真空下封管,130℃下反应48小时,待反应得到的粗产物凝固后再用150ml二氯甲烷溶解,后加入大量的无水乙醚至沉淀不再产生为止,用100ml冷乙醚反复洗涤沉淀三次后收集沉淀并减压干燥,所得产品密封保存待用;
(2)取10.2gpeg-pcl(2mmol)、2.8ml三乙胺(20mmol)和3.8ml对甲苯磺酰氯(20mmol)溶于100ml二氯甲烷中,在冰水浴条件下反应至tlc检测反应结果不再变化时停止反应,后加入大量的无水乙醚至沉淀不再产生为止,用50ml冷乙醚反复洗涤沉淀三次后收集沉淀并常温干燥得到nh2-peg-pcl,所得产品密封保存待用;
(3)取20mgnh2-peg-pcl充分溶于2mln,n-二甲基甲酰胺中制成重量百分浓度为10mg/ml的溶液;将10mgatezolizumab稀释于1ml硼酸盐缓冲液中(ph=9.0)制成重量百分浓度为10mg/ml的溶液;
(4)加1ml上述稀释得到的单克隆抗体溶液到5mlnh2-peg-pcl溶液混合;
(5)搅拌条件下,将200ul25wt%戊二醛溶液缓慢的加入上述溶液;
(6)反应10h,加入1mol/l乙醇胺至体系不再发生变化为止;
(7)离心,收集纳米粒子,用10ml硼酸盐缓冲液(0.2mol/l,ph=9.0)冲洗三次,冻干,得到基于pd-l1抗体的纳米粒子。
实施例3:基于pd-l1抗体的纳米粒子的制备
(1)制备peg-pcl:将50gmpeg(mn=5000,10mmol)、1.15gε-cl(购自美国fluka公司,10mmol)和0.05g辛酸亚锡置于聚合管中,并用150ml干燥的无水二氯甲烷溶解原料,真空下封管,130℃下反应48小时,待反应得到的粗产物凝固后再用150ml二氯甲烷溶解,后加入大量的无水乙醚至沉淀不再产生为止,用100ml冷乙醚反复洗涤沉淀三次后收集沉淀并减压干燥,所得产品密封保存待用;
(2)取10.2gpeg-pcl(2mmol)、2.8ml三乙胺(20mmol)和3.8ml对甲苯磺酰氯(20mmol)溶于100ml二氯甲烷中,在冰水浴条件下反应至tlc检测反应结果不再变化时停止反应,后加入大量的无水乙醚至沉淀不再产生为止,用50ml冷乙醚反复洗涤沉淀三次后收集沉淀并常温干燥得到nh2-peg-pcl,所得产品密封保存待用;
(3)取20mgnh2-peg-pcl充分溶于2ml二氯甲烷中制成重量百分浓度为10mg/ml的溶液;将10mgatezolizumab稀释于1ml硼酸盐缓冲液中(ph=8.0)制成重量百分浓度为10mg/ml的溶液;
(4)加1ml上述稀释得到的单克隆抗体溶液到10mlnh2-peg-pcl溶液混合;
(5)搅拌条件下,将200ul25wt%戊二醛溶液缓慢的加入上述溶液;
(6)反应20h,加入1mol/l乙醇胺至体系不再发生变化为止;
(7)离心,收集纳米粒子,用10ml硼酸盐缓冲液(0.2mol/l,ph=8.0)冲洗三次,冻干,得到基于pd-l1抗体的纳米粒子。
实验例1:连接的验证
应用x射线光电子能谱分析(xps)的方法,比较peg-pcl原材料与实施例1连接抗体后的基于pd-l1抗体的纳米粒子材料中n元素的变化,比较图1和图2可发现,抗体连接成功。如图3所示,显示基于pd-l1抗体的纳米粒子为球形,形态较均一,粒径150nm左右。
实验例2:peg-pcl-pd-l1抗体与peg-pcl对肿瘤细胞的毒作用
将peg-pcl-pd-l1ab与peg-pcl分别作用于胃癌细胞系bgc823(见图4)和肺癌细胞系a549(见图5),除低浓度(50ug/ml)时,peg-pcl和peg-pcl-pd-l1mab的细胞毒作用不具有统计学差异,其余4个浓度时,peg-pcl-pd-l1mab的细胞毒作用明显强于peg-pcl(p<0.01),表明通过本发明的方法制备得到的基于pd-l1抗体的纳米粒子能发挥正常的生物学活性。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺