抗癌剂感受性的判定标记的利记博彩app
(本申请是2012年2月24日递交的发明名称为“抗癌剂感受性的判定标记”的申请201280014973.x的分案申请)
本发明涉及为了判定作为对象的患者的癌对于抗癌剂是否具有治疗反应性而使用的抗癌剂感受性判定标记及其应用。
背景技术:
抗癌剂中包括烷基化剂、铂制剂、代谢拮抗剂、抗癌性抗生素、抗癌性植物生物碱等种类。这些抗癌剂中,根据癌的种类不同,有时显示效果,有时不显示效果。但是,已知即使是认为有效的种类的癌,也因各个患者而异有时显示效果,有时不显示效果。这种抗癌剂对于各个患者的癌是否显示效果称为抗癌剂感受性。
奥沙利铂(sp-4-2)-[(1r,2r)-环己烷-1,2-二胺-κn,κn’][乙二酸(2-)-κo1,κo2]铂(iupac)是第3代铂配位化合物类抗恶性肿瘤药。据认为,其作用机理与先前的药剂顺铂(cddp)和卡铂(cbcda)同样,通过与dna碱基形成交联而导致dna合成抑制、蛋白合成抑制,但奥沙利铂(l-ohp)即使对于cddp和cbcda无效的大肠癌而言也表现出抗肿瘤效果,表现出和以往的铂配位化合物类抗恶性肿瘤药不同的抗肿瘤谱。美国已经在2004年1月承认其与氟尿嘧啶(5-fu)/左亚叶酸盐(lv)的并用作为转移性结肠-直肠癌的第一线治疗药物,在日本,在2005年4月在药价中,也收载了对于不能切除治愈的晚期、复发的结肠-直肠癌,其与左亚叶酸盐和氟尿嘧啶的静脉内持续给药法的并用(folfox4法)。对于晚期复发大肠癌的治疗而言,在二十世纪90年代前半叶之前一直采用的5-fu/lv疗法的生存率是10~12个月,与此相对,加入了奥沙利铂的folfox疗法的生存期为19.5个月,达到几乎2倍。另外,在2009年8月,同样利用与5-fu/lv的静脉内持续给药法的并用的“结肠癌的术后辅助化学疗法”作为效能-效果得以追加,是能够期待对大肠癌患者日益广泛使用和有益性的药剂。
但是,尽管如此,folfox疗法对于晚期复发的大肠癌发挥的效率也仅为50%左右,换言之,意味着接受治疗的患者中有半数得不到效果。另外,因奥沙利铂的使用而导致中性粒细胞减少症,此外,还呈现高频率的末梢神经损伤,尽管这些并不是致死的副作用,但都是导致难以继续治疗的因素。因此,如果在治疗开始前能够预测、诊断可以期待效果的患者(应答者)和不能期待效果的患者(非应答者),就可实现有效性和安全性高的化学疗法。而且,由于一般而言癌化学疗法的治疗过程需要经过长期的时间,所以在治疗过程中对于抗癌剂的感受性的经时监控能够判定是否继续治疗,这不仅涉及减轻患者的负担和副作用,而且从医疗经济的观点出发也是有用的。确立一种用于预测在各个患者中的治疗反应性、选择适当的治疗的“个体化医疗”的治疗反应性预测生物标记是当务之急。
作为与奥沙利铂的治疗反应性关联的因素,认为主要与下述1)~3)等相关,作为在以大肠癌患者为对象的奥沙利铂与5-fu的并用疗法中的治疗反应性和预后预测因素,正在进行与1)~3)相关的临床研究。
1)奥沙利铂引起损伤的dna的切除、修复能力的增强
2)在细胞内的奥沙利铂(活性体)的失活(解毒)
3)奥沙利铂的细胞内积蓄量的降低
关于1),对于在核苷酸切除修复(nucleotideexcisionrepair:ner)中发挥重要作用的切除修复交叉互补基因1(excisionrepaircross-complementinggroup1,ercc1)而言,有报告肿瘤内ercc1的基因表达量是预后因素(非专利文献1),对于作为ercc1的单核苷酸多态性(snp)之一的c118t而言,有报告具有c/c纯合子的患者比具有至少1个以上的t等位基因的患者具有更良好的生存率(非专利文献2)。有报告在着色性干皮病基因d(xerodermapigmentosumd,xpd,也作为ercc2已知)中,伴有lys751gln的氨基酸突变的遗传多态性与肿瘤缩小率和生存期相关(非专利文献2、3)。有报告报告了x射线修复交叉互补基因1(x-rayrepaircross-complementinggroup1,xrcc1)的伴有arg399gln的氨基酸突变的遗传多态性与肿瘤缩小效果的关系,其中,该x射线修复交叉互补基因1编码据认为在碱基切除修复(baseexcisionrepair:ber)中与有效修复因暴露于烷基化剂等形成的dna单链切断的蛋白质相关(非专利文献4),但是有报告,根据以同一个患者为对象的后续分析,其对临床预后没有影响(非专利文献2)。尽管据认为dna错配修复(dnamismatchrepair:mmr)也参与对顺铂的感受性下降,但是有报告,在体外的研究中,mmr不参与由奥沙利铂导致的dna损伤部位的修复(非专利文献5)。
关于2),谷胱苷肽硫转移酶(glutathione-s-transferase,gst)是承担解毒、代谢的第ⅱ相反应的酶之一,通过催化dna铂加成物与谷胱苷肽形成抱合体而将药剂失活。有报告在gst亚型中,gstp1在大肠癌中的表达量增高,伴随ile105val的氨基酸突变的遗传多态性与生存期相关(生存期中间值:ile/ile为7.9个月、ile/val为13.3个月、val/val为24.9个月)(非专利文献6)。
关于3),有报告在使用培养细胞进行的研究中,有机阳离子转运体(octs)与奥沙利铂向细胞内输送和感受性相关(非专利文献7),此外,也有报告atp7a、atp7b等与铜或重金属的输送相关的转运体与感受性的相关(非专利文献8、9)。但是,关于它们的表达与奥沙利铂治疗反应性的关联,尚未进行临床研究。
在以接受了folfox疗法的晚期大肠癌患者为对象的最近的临床研究中,报告了ercc1的遗传多态性(asn118asn)和xpd的遗传多态性(lys751gln)独立地与无进展生存期(pfs)相关,但对于gstp1(ile105val)而言,没有发现与pfs的关联,而确认与奥沙利铂诱发神经毒性关联的倾向(非专利文献10)。
在体外研究中,关于铂配位化合物类的先前药剂顺铂的耐性相关因素有大量报告,关于奥沙利铂,也报告了与fas/fasl、bcl-xl等凋亡相关因素的关联(非专利文献11、12)。但是,除了奥沙利铂因癌种类而异而表现出与顺铂不同的治疗反应性以外,癌细胞对于担负奥沙利铂的细胞损伤活性的铂dna加成物的细胞应答几乎尚未阐明,对于使用奥沙利铂的化学疗法能够预测治疗反应性的明确的生物标记尚未确立。
氟尿嘧啶为1957年开发的氟化嘧啶类抗癌剂,至今仍是作为消化器癌化学疗法的基本的药剂。进入癌细胞的氟尿嘧啶通过下述作用机理发挥杀细胞效果,即,主要通过活性代谢物一磷酸氟代脱氧尿苷(fluorodeoxyuridine-5’-monophosphate,fdump)引起胸苷酸合酶(thymidylatesynthase,ts)抑制,从而引起dna合成抑制,此外,通过作为相同的活性代谢物的5-氟尿苷三磷酸(5-fluorouridinetriphosphate,futp)引起rna功能抑制。
关于氟化嘧啶类抗癌剂的治疗应答性的预测,目前为止进行了多项研究,特别是关于作为氟尿嘧啶的分解酶的二氢嘧啶脱氢酶(dihydropyrimidinedehydrogenase,dpd)和作为活性代谢物的靶酶的胸苷酸合成酶(thymidylatesynthase,ts)的报告较多。在高表达作为氟尿嘧啶异化代谢的限速酶的dpd的肿瘤中,报道了氟尿嘧啶耐性(非专利文献13),但是使用临床检体的验证报告并不多。关于ts表达,报道了不依赖于酶活性、蛋白质和rna水平等的测定法,其多寡能够成为氟化嘧啶类抗癌剂的治疗效果决定因素(非专利文献14、15)。但是,在所有的报告中并不一定能得到一致的结果,另外,尚不知道在治疗早期预测对于氟尿嘧啶的治疗反应性的明确的生物标记。
现有技术文献
非专利文献
非专利文献1:j.clin.oncol.19,4298-4304(2001)
非专利文献2:br.j.cancer91,344-354(2004)
非专利文献3:cancerres.61,8654-8658(2001)
非专利文献4:anticancerres.21,3075-3079(2001)
非专利文献5:cancerres.56,4881-4886(1996)
非专利文献6:j.natl.cancerinst.94,936-942(2002)
非专利文献7:cancerres.66,8847-8857(2006)
非专利文献8:mol.pharmacol.66,25-32(2004)
非专利文献9:clin.cancerres.10,4661-4669(2004)
非专利文献10:j.clin.oncol.25,1247-1254(2007)
非专利文献11:clin.cancerres.11,4770-4774(2005)
非专利文献12:j.biol.chem.279,46113-46121(2004)
非专利文献13:europeanjournalofcancer2004;40:939-950
非专利文献14:cancertreatmentreviews2002;28:27-47
非专利文献15:j.clin.oncol.2004;22:529-536
技术实现要素:
发明所要解决的课题
本发明的课题在于提供一种能够判别各个患者的治疗反应性的抗癌剂感受性判定标记以及利用该抗癌剂感受性判定标记的新的癌治疗方法。
用于解决课题的方法
因此,本发明的发明人等培养10种人癌细胞株,对于它们的细胞内代谢物使用毛细管电泳-飞行时间型质谱仪(ce-tofms)进行抗癌剂感受性判定标记的探索,结果在对奥沙利铂(也称为l-ohp)的感受性低的细胞群和高的细胞群中,发现了确认细胞内水平差异的代谢物,并发现该代谢物是n-乙酰氨基葡萄糖、氨基酸代谢系统上的物质(n-乙酰天冬氨酸、n-乙酰基-β-丙氨酸、天冬酰胺(asn)、精氨酸(arg)、鸟氨酸)、多胺代谢系统上的物质(亚精胺)、糖酵解系统上的物质(3-磷酸甘油酸、1,6-二磷酸果糖)。另外,本发明的发明人等培养人癌细胞株,对于l-ohp曝露后的细胞内代谢变动使用ce-tofms进行网罗式分析,进行抗癌剂感受性判定标记的探索,结果发现了确认在l-ohp高感受性细胞中l-ohp曝露后细胞内水平的显著上升的峰,并发现该峰为氨基酸代谢系统上的物质(β-丙氨酸(β-ala)、天冬酰胺、谷氨酸(glu)、arg、赖氨酸(lys)、n6-乙酰基赖氨酸、n-乙酰基-β-丙氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸)、多胺代谢系统上的物质(腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、亚精胺、n-乙酰腐胺)、核酸代谢系统上的物质(dtmp、cmp、ump、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp、鸟苷)、磷酸戊糖途径上的物质(2,3-二磷酸甘油酸、丙酮酸)、tca循环上的物质(苹果酸)、月桂酸、6-磷酸葡萄糖酸。此外,在l-ohp低感受性细胞中发现了确认l-ohp曝露后细胞内水平的显著上升的峰,并发现该峰为氨基酸代谢系统上的物质(谷胱甘肽(gsh))、丁酸、4-甲基吡唑。另外,在l-ohp高感受性细胞中发现了确认l-ohp曝露后细胞内水平的显著降低的峰,并发现该峰为核酸代谢系统上的物质(imp)。
另外,同样地对于氟尿嘧啶(也称为5-fu),培养人癌细胞株,对于5-fu曝露后的细胞内代谢变动使用ce-tofms进行网罗式分析,进行抗癌剂感受性判定标记的探索,结果在5-fu高感受性细胞中发现了确认5-fu曝露后细胞内水平显著上升的峰,并发现该峰为氨基酸代谢系统上的物质(天冬酰胺酸(asp)、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸、s-腺苷高半胱氨酸)、核酸代谢系统上的物质(鸟苷、cmp、ump、1-甲基腺苷、udp、ctp)、磷酸戊糖途径上的物质(7-磷酸景天庚酮糖)、糖酵解系统上的物质(磷酸二羟丙酮、丙酮酸)、tca循环上的物质(苹果酸)、多胺代谢系统上的物质(n1-乙酰精胺)、异丁胺、乙醇酸。另外,在5-fu低感受性细胞中发现了确认5-fu曝露后细胞内显著上升的峰,并发现该峰为氨基酸代谢系统上的物质(丝氨酸(ser)、谷胱甘肽(gsh))、核酸代谢系统上的物质(腺苷)。另外,在5-fu高感受性细胞中发现了确认5-fu曝露后细胞内显著降低的峰,并发现该峰为氨基酸代谢系统上的物质(3-甲基组氨酸、尸胺)、磷酸戊糖途径上的物质(prpp)、4-甲基吡唑。另外,在5-fu低感受性细胞中发现了确认5-fu曝露后细胞内显著降低的峰,并发现该峰为氨基酸代谢系统上的物质(半胱氨酸-谷胱甘肽)、糖酵解系统上的物质(2,3-二磷酸甘油酸)、多胺代谢系统上的物质(n-乙酰腐胺、n8-乙酰亚精胺、腐胺、亚精胺)、6-磷酸葡萄糖酸、nadh、nad+。
基于上述认识进一步进行研究,结果发现,当将来自癌患者的生物体试样中的这些代谢物的浓度作为指标,就能够判定该癌患者的癌是否具有对于抗癌剂的感受性,另外,当将这些代谢物的浓度或变动作为指标,就能够进行抗癌剂感受性增强剂的筛选,此外,当并用该抗癌剂感受性增强剂和作为感受性增强对象的抗癌剂,则该抗癌剂的治疗效果就飞跃性地提高,从而完成了本发明。
即,本发明提供抗癌剂感受性判定标记,其包含选自n-乙酰氨基葡萄糖、氨基酸代谢系统上的物质、核酸代谢系统上的物质、磷酸戊糖途径上的物质、糖酵解系统上的物质、tca循环上的物质、多胺代谢系统上的物质、和月桂酸、6-磷酸葡萄糖酸、丁酸、4-甲基吡唑、异丁胺、乙醇酸、nadh、nad+以及这些物质参与的代谢系统上的物质中的1种以上的物质。
另外,本发明提供选自l-ohp、5-fu以及它们的盐的抗癌剂的感受性判定标记,该抗癌剂感受性判定标记包括选自asn、γ-glu-cys、谷胱甘肽(gsh)、s-腺苷高半胱氨酸、asp、γ-氨基丁酸、1-甲基腺苷、精胺、亚精胺和这些物质参与的代谢系统上的物质中1种以上的物质。
另外,本发明提供抗癌剂感受性的判定方法,其特征在于,测定检体中的上述物质。
另外,本发明提供用于实施抗癌剂感受性的判定方法的试剂盒,其特征在于,包括用于测定检体中的上述物质的操作说明书。
此外,本发明提供抗癌剂感受性增强剂的筛选方法,其以上述物质的表达变动为指标。
而且,本发明提供利用上述的筛选方法得到的抗癌剂感受性增强剂。
此外,本发明提供癌治疗用组合物,其含有上述抗癌剂感受性增强剂和作为感受性增强对象的抗癌剂的组合。
发明的效果
如果使用本发明的抗癌剂感受性判定标记,就能够在抗癌剂给药前或抗癌剂给药开始后早期且准确地判定各个患者的抗癌剂治疗反应性,从而能够选择治疗效果更高的抗癌剂,作为其结果,能够防止不能期待治疗效果的抗癌剂的继续给药所导致的癌进展、副作用增大,还能够期待减轻患者的负担,减少医疗费。而且,如果使用该标记,就能够筛选增强抗癌剂感受性的药剂,如果将作为其对象的抗癌剂与抗癌剂感受性增强剂并用,就能够飞跃性地提高癌治疗效果。本发明的抗癌剂感受性判定标记的测定试剂作为抗癌剂感受性判定试剂是有用的。
附图说明
图1是表示10种人大肠癌细胞株对于l-ohp的感受性的图。
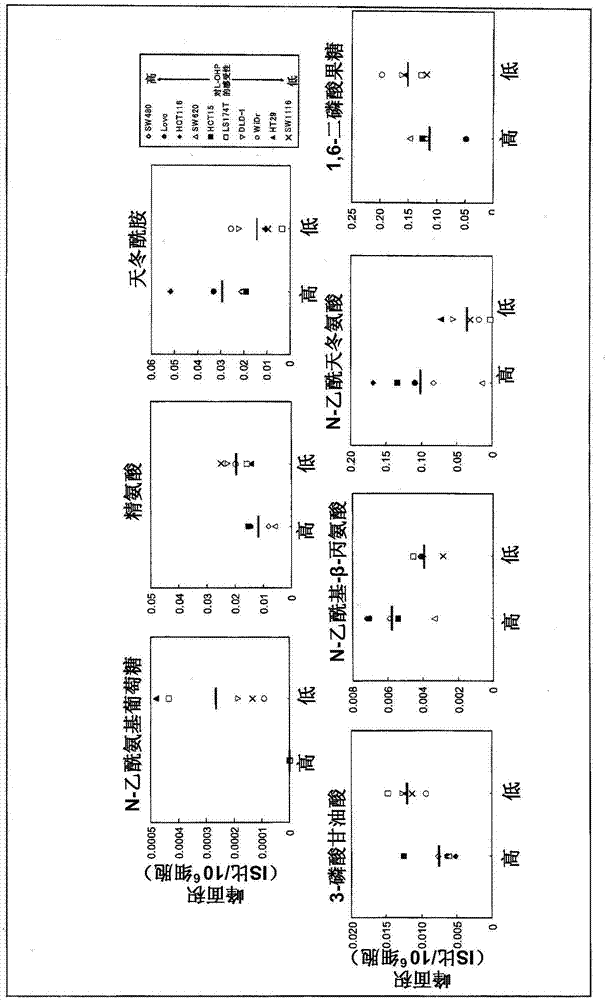
图2是表示l-ohp低感受性细胞和高感受性细胞的稳定状态(药剂处理前)中的n-乙酰氨基葡萄糖、精氨酸、天冬酰胺、3-磷酸甘油酸、n-乙酰基-β-丙氨酸、n-乙酰天冬氨酸、1,6-二磷酸果糖的细胞内水平的图。
图3是表示dld-1、hct116中l-ohp曝露后的腐胺的细胞内水平的经时变化的图。
图4是表示dld-1、hct116中l-ohp曝露后的n1-乙酰精胺的细胞内水平的经时变化的图。
图5是表示dld-1、hct116中l-ohp曝露后的n8-乙酰亚精胺的细胞内水平的经时变化的图。
图6是表示dld-1、hct116中l-ohp曝露后的精胺的细胞内水平的经时变化的图。
图7是表示dld-1、hct116中l-ohp曝露后的天冬酰胺的细胞内水平的经时变化的图。
图8是表示dld-1、hct116中l-ohp曝露后的β-丙氨酸的细胞内水平的经时变化的图。
图9是表示dld-1、hct116在l-ohp曝露24小时后的核酸代谢系统上的物质的变动的图。
图10是表示l-ohp低感受性细胞和高感受性细胞的稳定状态(药剂处理前)中多胺代谢系统上的物质的细胞内水平、和dld-1、hct116中l-ohp曝露后的多胺代谢系统上的物质的细胞内水平的经时变化的图。
图11是表示图10的观察方法的图。
图12是表示dld-1、hct116在l-ohp曝露24小时后的各代谢物质的变动的图。
图13是表示dld-1、hct116在5-fu曝露24小时后的各代谢物质的变动的图。
具体实施方式
本发明的抗癌剂感受性判定标记选自下述物质:n-乙酰氨基葡萄糖、氨基酸代谢系统上的物质、核酸代谢系统上的物质、磷酸戊糖途径上的物质、糖酵解系统上的物质、tca循环上的物质、多胺代谢系统上的物质、月桂酸、6-磷酸葡萄糖酸、丁酸、4-甲基吡唑、异丁胺、乙醇酸、nadh、nad+和这些物质参与的代谢系统上的物质。另外,包括使这些物质的浓度变动的代谢系统上的所有物质,作为该物质,可以列举使向这些物质的代谢增强的物质、抑制向这些物质的代谢的物质、促进从这些物质的代谢的物质、抑制从这些物质的代谢的物质等。
本发明的抗癌剂感受性判定标记之一,为n-乙酰氨基葡萄糖或其参与的代谢系统上的物质(也称为n-乙酰氨基葡萄糖代谢系统物质),作为该物质,在n-乙酰氨基葡萄糖之外,还包括在代谢系统中使n-乙酰氨基葡萄糖的浓度变动的所有物质,可以列举使向n-乙酰氨基葡萄糖的代谢增强的物质或抑制的物质、促进或抑制从n-乙酰氨基葡萄糖的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选n-乙酰氨基葡萄糖。
本发明的抗癌剂感受性判定标记之一,为氨基酸代谢系统上的物质(也称为氨基酸代谢系统物质),作为该物质,包括使氨基酸代谢系统物质的浓度变动的所有物质,可以列举使向氨基酸代谢系统物质的代谢增强的物质或抑制的物质、促进或抑制从氨基酸代谢系统物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选arg、asn、n-乙酰基-β-丙氨酸、n-乙酰天冬氨酸、β-丙氨酸、鸟氨酸、glu、lys、n6-乙酰基赖氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、谷胱甘肽(gsh)、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸。另外,作为5-fu感受性判定标记,特别优选asp、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸(gaba)、s-腺苷高半胱氨酸、ser、谷胱甘肽(gsh)、3-甲基组氨酸、尸胺、半胱氨酸-谷胱甘肽。
本发明的抗癌剂感受性判定标记之一,为核酸代谢系统上的物质(也称为核酸代谢系统物质),作为该物质,包括使核酸代谢系统物质的浓度变动的所有物质,可以列举使向核酸代谢系统物质的代谢增强的物质或抑制的物质、促进或抑制从核酸代谢系统物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,优选鸟苷、dtmp、cmp、ump、imp、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp,特别优选ump、udp。另外,作为5-fu感受性判定标记,特别优选鸟苷、cmp、ump、1-甲基腺苷、udp、ctp、腺苷。
本发明的抗癌剂感受性判定标记之一,为磷酸戊糖途径上的物质(也称为磷酸戊糖途径上物质),作为该物质,包括使磷酸戊糖途径上物质的浓度变动的所有物质,可以列举使向磷酸戊糖途径上物质的代谢增强的物质或抑制的物质、促进或抑制从磷酸戊糖途径上物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选2,3-二磷酸甘油酸、丙酮酸。另外,作为5-fu感受性判定标记,特别优选7-磷酸景天庚酮糖、prpp。
本发明的抗癌剂感受性判定标记之一,为糖酵解系统上的物质(也称为糖酵解系统物质),作为该物质,包括使糖酵解系统物质的浓度变动的所有物质,可以列举使向糖酵解系统物质的代谢增强的物质或抑制的物质、促进或抑制从糖酵解系统物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选3-磷酸甘油酸、1,6-二磷酸果糖。另外,作为5-fu感受性判定标记,特别优选磷酸二羟丙酮、2,3-二磷酸甘油酸、丙酮酸。
本发明的抗癌剂感受性判定标记之一,为tca循环上的物质(也称为tca循环上物质),作为该物质,包括使tca循环上物质的浓度变动的所有物质,可以列举使向tca循环上物质的代谢增强的物质或抑制的物质、促进或抑制从tca循环上物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选苹果酸。另外,作为5-fu感受性判定标记,特别优选苹果酸。
本发明的抗癌剂感受性判定标记之一,为多胺代谢系统上的物质(也称为多胺代谢系统物质),作为该物质,包括使多胺代谢系统物质的浓度变动的所有物质,可以列举使向多胺代谢系统物质的代谢增强的物质或抑制的物质、促进或抑制从多胺代谢系统物质的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、亚精胺、n-乙酰腐胺。另外,作为5-fu感受性判定标记,特别优选腐胺、n1-乙酰精胺、n8-乙酰亚精胺、亚精胺、n-乙酰腐胺。
本发明的抗癌剂感受性判定标记之一,为月桂酸或其参与的代谢系统上的物质(也称为月桂酸代谢系统物质),作为该物质,在月桂酸以外,还包括在代谢系统中使月桂酸的浓度变动的所有物质,可以列举使向月桂酸的代谢增强的物质或抑制的物质、促进或抑制从月桂酸的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选月桂酸。
本发明的抗癌剂感受性判定标记之一,为6-磷酸葡萄糖酸或其参与的代谢系统上的物质(也称为6-磷酸葡萄糖酸代谢系统物质),作为该物质,在6-磷酸葡萄糖酸以外,还包括在代谢系统中使6-磷酸葡萄糖酸的浓度变动的所有物质,可以列举使向6-磷酸葡萄糖酸的代谢增强的物质或抑制的物质、促进或抑制从6-磷酸葡萄糖酸的代谢的物质等。它们之中,l-ohp感受性判定标记和5-fu感受性判定标记都特别优选6-磷酸葡萄糖酸。
本发明的抗癌剂感受性判定标记之一,为丁酸或其参与的代谢系统上的物质(也称为丁酸代谢系统物质),作为该物质,在丁酸以外,还包括在代谢系统中使丁酸的浓度变动的所有物质,可以列举使向丁酸的代谢增强的物质或抑制的物质、促进或抑制从丁酸的代谢的物质等。它们之中,作为l-ohp感受性判定标记,特别优选丁酸。
本发明的抗癌剂感受性判定标记之一,为4-甲基吡唑或其参与的代谢系统上的物质(也称为4-甲基吡唑代谢系统物质),作为该物质,在4-甲基吡唑以外,还包括在代谢系统中使4-甲基吡唑的浓度变动的所有物质,可以列举使向4-甲基吡唑的代谢增强的物质或抑制的物质、促进或抑制从4-甲基吡唑的代谢的物质等。它们之中,l-ohp感受性判定标记和5-fu感受性判定标记都特别优选4-甲基吡唑。
本发明的抗癌剂感受性判定标记之一,为异丁胺或其参与的代谢系统上的物质(也称为异丁胺代谢系统物质),作为该物质,在异丁胺以外,还包括在代谢系统中使异丁胺的浓度变动的所有物质,可以列举使向异丁胺的代谢增强的物质或抑制的物质、促进或抑制从异丁胺的代谢的物质等。它们之中,作为5-fu感受性判定标记,特别优选异丁胺。
本发明的抗癌剂感受性判定标记之一,为乙醇酸或其参与的代谢系统上的物质(也称为乙醇酸代谢系统物质),作为该物质,在乙醇酸以外,还包括在代谢系统中使乙醇酸的浓度变动的所有物质,可以列举使向乙醇酸的代谢增强的物质或抑制的物质、促进或抑制从乙醇酸的代谢的物质等。它们之中,作为5-fu感受性判定标记,特别优选乙醇酸。
本发明的抗癌剂感受性判定标记之一,为nadh或其参与的代谢系统上的物质(也称为nadh代谢系统物质),作为该物质,在nadh以外,还包括在代谢系统中使nadh的浓度变动的所有物质,可以列举使向nadh的代谢增强的物质或抑制的物质、促进或抑制从nadh的代谢的物质等。它们之中,作为5-fu感受性判定标记,特别优选nadh。
本发明的抗癌剂感受性判定标记之一,为nad+或其参与的代谢系统上的物质(也称为nad+代谢系统物质),作为该物质,在nad+以外,还包括在代谢系统中使nad+的浓度变动的所有物质,可以列举使向nad+的代谢增强的物质或抑制的物质、促进或抑制从nad+的代谢的物质等。它们之中,作为5-fu感受性判定标记,特别优选nad+。
prpp、nad+、nadh、nadp+为在各种代谢中参与的物质,也已知是核酸代谢系统物质之一。
上述的抗癌剂感受性判定标记之中,天冬酰胺、精胺、亚精胺、谷胱甘肽(gsh)、γ-氨基丁酸(gaba)、1-甲基腺苷、γ-glu-cys、天冬酰胺酸、s-腺苷高半胱氨酸被本发明的发明人等确认是依立替康、sn-38或它们的盐的感受性判定标记,但新发现了天冬酰胺、精胺、亚精胺、谷胱甘肽(gsh)、γ-glu-cys、s-腺苷高半胱氨酸能够作为包含奥沙利铂(l-ohp)和/或其盐的抗癌剂的感受性判定标记。另外,天冬酰胺酸、亚精胺、谷胱甘肽(gsh)、gaba、1-甲基腺苷、s-腺苷高半胱氨酸被新发现能够作为包含5-fu的抗癌剂的感受性判定标记。此外,精胺、亚精胺为在各种代谢路径上存在的物质,也已知是多胺代谢系统物质之一。
β-丙氨酸、glu、lys、n6-乙酰基赖氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸、腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、n-乙酰腐胺、dtmp、cmp、ump、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp、鸟苷、2,3-二磷酸甘油酸、丙酮酸、苹果酸、月桂酸、6-磷酸葡萄糖酸,如后述的实施例所示,l-ohp曝露后,在作为l-ohp高感受性的hct116中观察到细胞内水平的显著上升。另一方面,在作为l-ohp低感受性的dld-1中,没有观察到像hct116那样的细胞内水平的显著的变动,或者细胞内水平相比于对照组降低。因此,这些物质特别是可用作l-ohp等的抗癌剂感受性判定标记。
谷胱甘肽(gsh)、丁酸、4-甲基吡唑,如后述的实施例所示,l-ohp曝露后,在作为低感受性的dld-1中观察到细胞内水平的显著上升,但在作为高感受性的hct116中,没有观察到像dld-1那样的细胞内水平的显著变动,或者细胞内水平相比于对照组降低。因此,这些物质特别是可用作l-ohp等的抗癌剂感受性判定标记。
imp,如后述的实施例所示,l-ohp曝露后,在作为l-ohp高感受性的hct116中观察到细胞内水平的显著降低,但在作为l-ohp低感受性的dld-1中,细胞内水平相比于对照组上升。因此,imp特别是可用作l-ohp等的抗癌剂感受性判定标记。
n-乙酰天冬氨酸,如后述的实施例所示,使用10种人癌细胞株进行研究,结果在l-ohp高感受性细胞中,细胞内水平高,在l-ohp低感受性细胞中,细胞内水平低。因此,n-乙酰天冬氨酸特别是可用作l-ohp等的抗癌剂感受性判定标记。
n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸,如后述的实施例所示,使用10种人癌细胞株进行研究,结果在l-ohp低感受性细胞中,细胞内水平高,在l-ohp高感受性细胞中,细胞内水平低。因此,n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸特别是可用作l-ohp等的抗癌剂感受性判定标记。
天冬酰胺、n-乙酰基-β-丙氨酸,如后述的实施例所示,使用10种人癌细胞株进行研究,结果在l-ohp高感受性细胞中,细胞内水平高,在l-ohp低感受性细胞中,细胞内水平低。另外,l-ohp曝露后,在作为l-ohp高感受性的hct116中观察到细胞内水平的显著上升,但在作为l-ohp低感受性的dld-1中没有观察到像作为高感受性细胞的hct116那样的细胞内水平的显著变动。因此,天冬酰胺、n-乙酰基-β-丙氨酸特别是可用作l-ohp等的抗癌剂感受性判定标记。
精氨酸、亚精胺,如后述的实施例所示,使用10种人癌细胞株进行研究,结果在l-ohp低感受性细胞中,细胞内水平高,在l-ohp高感受性细胞中,细胞内水平低。另外,l-ohp曝露后,在作为l-ohp高感受性的hct116中观察到细胞内水平的显著上升,但在作为l-ohp低感受性的dld-1中没有观察到像作为高感受性细胞的hct116那样的细胞内水平的显著变动,或者细胞内水平相比于对照组降低。因此,精氨酸、亚精胺特别是可用作l-ohp等的抗癌剂感受性判定标记。
asp、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸、s-腺苷高半胱氨酸、鸟苷、cmp、ump、1-甲基腺苷、udp、ctp、7-磷酸景天庚酮糖、磷酸二羟丙酮、丙酮酸、苹果酸、n1-乙酰精胺、异丁胺、乙醇酸,如后述的实施例所示,5-fu曝露后,在作为高感受性的hct116中观察到细胞内水平的显著上升。另一方面,在作为低感受性的dld-1中,没有观察到像hct116那样的细胞内水平的显著变动,或者细胞内水平相比于对照组降低。因此,这些物质特别是可用作5-fu等的感受性判定标记。
ser、谷胱甘肽(gsh)、腺苷,如后述的实施例所示,5-fu曝露后,在作为低感受性的dld-1中观察到细胞内水平的显著上升,但在作为高感受性的hct116中没有观察到像dld-1那样的细胞内水平的显著变动,或者细胞内水平相比于对照组降低。因此,这些物质特别是可用作5-fu等的感受性判定标记。
3-甲基组氨酸、尸胺、prpp、4-甲基吡唑,如后述的实施例所示,5-fu曝露后,在作为高感受性的hct116中观察到细胞内水平的显著降低,但在作为低感受性的dld-1中,没有观察到像hct116那样的细胞内水平的显著变动,或者细胞内水平相比于对照组上升。因此,这些物质特别是可用作5-fu等的感受性判定标记。
半胱氨酸-谷胱甘肽、2,3-二磷酸甘油酸、n-乙酰腐胺、n8-乙酰亚精胺、腐胺、亚精胺、6-磷酸葡萄糖酸、nadh、nad+,如后述的实施例所示,5-fu曝露后,在作为低感受性的dld-1中观察到细胞内水平的显著降低,但在作为高感受性的hct116中没有观察到像dld-1那样的细胞内水平的显著变动。因此,这些物质特别是可用作5-fu等的感受性判定标记。
作为本发明的抗癌剂感受性判定标记的对象的抗癌剂,没有特别限定,例如可以列举奥沙利铂(l-ohp)、环磷酰胺(cyclophosphamide)、异环磷酰胺(ifosfamide)、噻替哌(thiotepa)、美法仑(melphalan)、白消安(busulfan)、尼莫司汀(nimustine)、雷莫司汀(ranimustine)、达卡巴嗪(dacarbazine)、丙卡巴肼(procarbazine)、替莫唑胺(temozolomide)、顺铂(cisplatin)、卡铂(carboplatin)、奈达铂(nedaplatin)、甲氨蝶呤(methotrexate)、培美曲塞(pemetrexed)、氟尿嘧啶(fluorouracil)、替加氟/尿嘧啶(tegaful/uracil)、脱氧氟尿苷(doxifluridine)、替加氟/吉美拉西/奥替拉西(tegaful/gimeracil/oteracil)、卡培他滨(capecitabine)、阿糖胞苷(cytarabine)、依诺他滨(enocitabine)、吉西他滨(gemcitabine)、6-巯基嘌呤(6-mercaptopurine)、氟达拉滨(fuludarabin)、喷司他汀(pentostatin)、克拉屈滨(cladribine)、羟基脲(hydroxyurea)、多柔比星(doxorubicin)、表柔比星(epirubicin)、佐柔比星(daunorubicin)、依达比星(idarubicine)、吡柔比星(pirarubicin)、米托蒽醌(mitoxantrone)、氨柔比星(amurubicin)、放线菌素d(actinomycind)、博来霉素(bleomycine)、派来霉素(pepleomycin)、丝裂霉素c(mytomycinc)、阿柔比星(aclarubicin)、净司他丁(zinostatin)、长春新碱(vincristine)、长春地辛(vindesine)、长春碱(vinblastine)、长春瑞滨(vinorelbine)、紫杉醇(paclitaxel)、多西紫杉醇(docetaxel)、依立替康(irinotecan)、依立替康活性代谢物(sn-38)、托泊替康(nogitecan,topotecan)、依托泊苷(etoposide)、泼尼松龙(prednisolone)、地塞米松(dexamethasone)、他莫昔芬(tamoxifen)、托瑞米芬(toremifene)、甲羟孕酮(medroxyprogesterone)、阿那曲唑(anastrozole)、依西美坦(exemestane)、来曲唑(letrozole)、利妥昔(rituximab)、伊马替尼(imatinib)、吉非替尼(gefitinib)、吉姆单抗奥佐米星(gemtuzumabozogamicin)、硼替佐米(bortezomib)、厄洛替尼(erlotinib)、西妥昔单抗(cetuximab)、贝伐单抗(bevacizumab)、舒尼替尼(sunitinib)、索拉非尼(sorafenib)、达沙替尼(dasatinib)、帕尼单抗(panitumumab)、门冬酰胺酶(asparaginase)、维甲酸(tretinoin)、三氧化二砷(arsenictrioxide)、亚叶酸(folinate)、左亚叶酸(levofolinate)、或它们的盐、或它们的活性代谢物等。其中,优选铂配位化合物类抗癌剂、氟化嘧啶类抗癌剂,特别优选奥沙利铂、氟尿嘧啶或它们的盐。
作为本发明的抗癌剂感受性判定标记的对象的抗癌剂,可以列举奥沙利铂或其盐、氟尿嘧啶或其盐,但在体内被代谢转化为奥沙利铂或氟尿嘧啶的抗癌剂也与奥沙利铂、氟尿嘧啶同样为本发明的抗癌剂感受性判定标记的对象。具体而言,由于已知替加氟(tegaful)、卡培他滨(capecitabine)在体内被代谢而转化为氟尿嘧啶,所以代替氟尿嘧啶,替加氟和卡培他滨也是本发明的抗癌剂感受性判定标记的对象。
在使用本发明的抗癌剂感受性判定标记判定抗癌剂感受性时,测定检体中的这些代谢系统物质即可。在这里,作为检体,可以列举来自患有癌的被检验者(癌患者)的生物体试样,例如,可以列举血液、血清、血浆、尿、肿瘤组织-细胞、腹水、胸水、脑脊液、便、痰等,但特别优选血清。
另外,作为本发明对象的癌,可以列举以喉癌为代表的唇、口腔和喉癌、以食道癌、胃癌、结肠-直肠癌等为代表的消化器官癌、以肺癌为代表的呼吸器官和胸腔内脏器癌、骨骼及关节软骨癌、皮肤的恶性黑色素瘤、鳞状细胞癌及其它皮肤癌、以间皮瘤为代表的间皮和软组织癌、以乳腺癌、子宫癌,卵巢癌为代表的女性性器官癌、以前列腺癌为代表的男性性器官癌、以膀胱癌为代表的尿路癌、以脑肿瘤为代表的眼、脑和中枢神经系统癌、甲状腺和其它内分泌腺癌,以非何杰金氏淋巴瘤和淋巴细胞性白血病为代表的淋巴组织、造血组织和关联组织癌、以及以这些癌为原发病灶的转移组织的癌等,特别是对非小细胞肺癌、小细胞肺癌、宫颈癌、卵巢癌、胃癌、结肠-直肠癌、鳞状细胞癌、恶性淋巴瘤能够适合地利用。
检体中的这些代谢系统物质的测定方法根据被测定对象物质而适当确定即可,例如能够利用ce-tofms、气相色谱-质谱(gaschromatography-massspectrometry:gc-ms)等各种质量分析装置、hplc、免疫学测定法、生化学测定法等测定。
关于β-丙氨酸、glu、lys、n6-乙酰基赖氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸、腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、n-乙酰腐胺、dtmp、cmp、ump、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp、鸟苷、2,3-二磷酸甘油酸、丙酮酸、苹果酸、月桂酸、6-磷酸葡萄糖酸,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前以及给药后的癌患者的生物体试样中的这些代谢系统物质浓度,如果与抗癌剂给药前相比,给药后的这些代谢系统物质的浓度上升,或者在规定的基准以上,则能够判定该癌为抗癌剂感受性,如果抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者低于规定的基准,则能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于谷胱甘肽(gsh)、丁酸、4-甲基吡唑,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中的这些代谢系统物质浓度,如果与抗癌剂给药前相比,给药后的这些代谢系统物质的浓度上升,或者高于规定的基准,则能够判定该癌不具有抗癌剂感受性,如果在抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者在规定的基准以下,则能够判定该癌为抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于imp,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中的这些代谢系统物质浓度,如果与抗癌剂给药前相比,给药后的这些代谢系统物质的浓度降低,或者在规定的基准以下,则能够判定该癌具有抗癌剂感受性,如果抗癌剂给药前后的这些代谢系统物质的浓度没有变化,或者高于规定的基准,则能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于n-乙酰天冬氨酸,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,在抗癌剂给药前或者给药后初期阶段,这些代谢系统物质的浓度具有判断为低于规定的标准浓度的浓度的情况下,能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,在抗癌剂给药前或者给药后初期阶段,在这些代谢系统物质的浓度具有判断为高于规定的标准浓度的浓度的情况下,能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于天冬酰胺、n-乙酰基-β-丙氨酸,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中的这些代谢系统物质浓度,如果相比于抗癌剂给药前,给药后的这些代谢系统物质的浓度上升,或者在规定的基准以上,则能够判定该癌具有抗癌剂感受性,如果抗癌剂给药前后的这些代谢系统物质的浓度没有变化,或者低于规定的基准,则能够判定该癌不具有抗癌剂感受性。
另外,在抗癌剂给药前或者给药后初期的阶段,这些代谢系统物质的浓度具有判断为低于规定的标准浓度的浓度的情况下,能够判定该癌不具有抗癌剂感受性。在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于精氨酸、亚精胺,在作为对象的抗癌剂为l-ohp时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中的这些代谢系统物质浓度,如果相比于抗癌剂给药前,给药后的这些代谢系统物质的浓度上升,或者在规定的基准以上,则能够判定该癌具有抗癌剂感受性,如果抗癌剂给药前后的这些代谢系统物质的浓度没有变化,或者低于规定的基准,则能够判定该癌不具有抗癌剂感受性。
另外,在抗癌剂给药前或者给药后初期的阶段,这些代谢系统物质的浓度具有判断为高于规定的标准浓度的浓度的情况下,能够判定该癌不具有抗癌剂感受性。在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于asp、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸、s-腺苷高半胱氨酸、鸟苷、cmp、ump、1-甲基腺苷、udp、ctp、7-磷酸景天庚酮糖、磷酸二羟丙酮、丙酮酸、苹果酸、n1-acetylspermine、异丁胺、乙醇酸,在作为对象的抗癌剂为5-fu时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中这些代谢系统物质浓度,如果相比于抗癌剂给药前,给药后的这些代谢系统物质的浓度上升,或者在规定的基准以上,则能够判定该癌具有抗癌剂感受性,如果抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者低于规定的基准,则能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于ser、谷胱甘肽(gsh)、腺苷,在作为对象的抗癌剂为5-fu时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中这些代谢系统物质浓度,相比于抗癌剂给药前,给药后的这些代谢系统物质的浓度上升,或者高于规定的基准,则能够判定该癌不具有抗癌剂感受性,如果抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者在规定的基准以下,则能够判定该癌具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于3-甲基组氨酸、尸胺、prpp、4-甲基吡唑,在作为对象的抗癌剂为5-fu时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中这些代谢系统物质浓度,如果相比于抗癌剂给药前,给药后这些代谢系统物质的浓度降低,或者在规定的基准以下,则能够判定该癌具有抗癌剂感受性,如果抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者高于规定的基准,则能够判定该癌不具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
关于半胱氨酸-谷胱甘肽、2,3-二磷酸甘油酸、n-乙酰腐胺、n8-乙酰亚精胺、腐胺、亚精胺、6-磷酸葡萄糖酸、nadh、nad+,在作为对象的抗癌剂为5-fu时,为了判定对于抗癌剂的感受性,测定来自抗癌剂给药前和给药后的癌患者的生物体试样中这些代谢系统物质浓度,如果相比于抗癌剂给药前,给药后这些代谢系统物质的浓度降低,或者低于规定的基准,则能够判定该癌不具有抗癌剂感受性,如果抗癌剂给药前后这些代谢系统物质的浓度没有变化,或者在规定的基准以上,则能够判定该癌具有抗癌剂感受性。
在对于作为对象的抗癌剂不具有感受性时,无法期待其药效,在持续将这样的无法期待药效的抗癌剂给药的情况下,会有癌的恶化、副作用增大的危险。这样,本发明的抗癌剂感受性判定标记不仅对于抗癌剂治疗反应性的判定具有很大贡献,而且对于防止伴随不能期待药效的抗癌剂的继续给药带来的副作用增大也有很大贡献。
为了实施本发明的抗癌剂感受性的判定方法,优选使用包含用于检测检体中的这些代谢系统物质的操作说明书的试剂盒。该试剂盒中包括这些代谢系统物质测定试剂、测定试剂的使用方法和用于判定抗癌剂感受性有无的基准等。该基准中包括这些代谢系统物质的标准浓度或标准比、判断为高的浓度或比、判断为低的浓度或比、影响测定结果的要素及其影响的程度等,这些浓度能够对每个作为对象的抗癌剂进行设定。使用该基准,能够如上所述进行判定。
在作为对象的抗癌剂为l-ohp时,当将抗癌剂曝露后的β-丙氨酸、glu、lys、n6-乙酰基赖氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸、腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、n-乙酰腐胺、dtmp、cmp、ump、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp、鸟苷、2,3-二磷酸甘油酸、丙酮酸、苹果酸、月桂酸、6-磷酸葡萄糖酸的表达变动、具体而言将变动的促进或浓度的上升作为指标,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,促进这些代谢系统物质在抗癌剂曝露后的变动或使其浓度上升的物质增强抗癌剂感受性。例如,在invitro中,促进抗癌剂曝露后细胞内这些代谢系统物质的变动或使其浓度上升的物质为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,促进荷瘤动物在抗癌剂曝露后这些代谢系统物质的变动或使其浓度上升的物质为增强该抗癌剂的感受性增强的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,当以抗癌剂曝露后的谷胱甘肽(gsh)、丁酸、4-甲基吡唑的表达变动的有无作为指标,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,减小谷胱甘肽(gsh)、丁酸、4-甲基吡唑在抗癌剂曝露后的变动的物质,增强抗癌剂感受性。例如,在invitro中,减小抗癌剂曝露后的细胞内的谷胱甘肽(gsh)、丁酸、4-甲基吡唑的变动的物质为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,减小荷瘤动物的抗癌剂曝露后的谷胱甘肽(gsh)、丁酸、4-甲基吡唑的变动的物质为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,当将抗癌剂曝露后的imp的表达变动、具体而言将变动的促进或浓度的降低作为指标,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,促进imp在抗癌剂曝露后的变动或使浓度降低的物质增强抗癌剂感受性。例如,在invitro中,促进抗癌剂曝露后的细胞内的imp的变动或使浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,促进荷瘤动物在抗癌剂曝露后的imp的变动或使浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,当将抗癌剂曝露后的n-乙酰天冬氨酸的表达变动、具体而言将浓度的上升作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,使n-乙酰天冬氨酸在抗癌剂曝露前的浓度上升的物质增强抗癌剂感受性。例如,在invitro中,在抗癌剂曝露前将各种癌细胞株用某种物质处理时,使细胞内的n-乙酰天冬氨酸的浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,使荷瘤动物在抗癌剂曝露前的n-乙酰天冬氨酸的浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,如果将抗癌剂曝露后的n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸的表达变动、具体而言将浓度的降低作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,使n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸在抗癌剂曝露前的浓度降低的物质,增强抗癌剂感受性。例如,在invitro中,在抗癌剂曝露前将各种癌细胞株用某种物质处理时,使细胞内的n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸的浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,使荷瘤动物在抗癌剂曝露前的n-乙酰氨基葡萄糖、3-磷酸甘油酸、1,6-二磷酸果糖、鸟氨酸的浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,当将抗癌剂曝露后的天冬酰胺、n-乙酰基-β-丙氨酸的表达变动、具体而言将变动的促进或浓度的上升作为指标时,能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,使天冬酰胺、n-乙酰基-β-丙氨酸在抗癌剂曝露前的浓度上升的物质、促进抗癌剂曝露后的变动或使浓度上升的物质,增强抗癌剂感受性。例如,在invitro中,在抗癌剂曝露前将各种癌细胞株用某种物质处理时,使细胞内的天冬酰胺、n-乙酰基-β-丙氨酸的浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invitro中,促进各种癌细胞株在抗癌剂曝露后的细胞内的天冬酰胺、n-乙酰基-β-丙氨酸的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,使荷瘤动物在抗癌剂曝露前的天冬酰胺、n-乙酰基-β-丙氨酸的浓度上升的物质、促进抗癌剂曝露后的天冬酰胺、n-乙酰基-β-丙氨酸的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为l-ohp时,当将抗癌剂曝露后的精氨酸、亚精胺的表达变动作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,使精氨酸、亚精胺在抗癌剂曝露前的浓度降低的物质、促进抗癌剂曝露后的变动或使浓度上升的物质,增强抗癌剂感受性。例如,在invitro中,在抗癌剂曝露前将各种癌细胞株用某种物质处理时,使细胞内的精氨酸、亚精胺的浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invitro中,促进各种癌细胞株在抗癌剂曝露后的细胞内的精氨酸、亚精胺的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,使荷瘤动物在抗癌剂曝露前的精氨酸、亚精胺的浓度降低的物质、促进抗癌剂曝露后的精氨酸、亚精胺的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
在作为对象的抗癌剂为5-fu时,当将抗癌剂曝露后的asp、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸、s-腺苷高半胱氨酸、鸟苷、cmp、ump、1-甲基腺苷、udp、ctp、7-磷酸景天庚酮糖、磷酸二羟丙酮、丙酮酸、苹果酸、n1-乙酰精胺、异丁胺、乙醇酸的表达变动、具体而言将变动的促进或浓度的上升作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,促进这些代谢系统物质在抗癌剂曝露后的变动或使浓度上升的物质,增强抗癌剂感受性。例如,在invitro中,促进抗癌剂曝露后的细胞内的这些代谢系统物质的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,促进荷瘤动物在抗癌剂曝露后的这些代谢系统物质的变动或使浓度上升的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为5-fu时,当将抗癌剂曝露后的ser、谷胱甘肽(gsh)、腺苷的表达变动的有无作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,减小ser、谷胱甘肽(gsh)、腺苷在抗癌剂曝露后的变动的物质,增强抗癌剂感受性。例如,在invitro中,减小抗癌剂曝露后的细胞内的ser、谷胱甘肽(gsh)、腺苷的变动的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,减小荷瘤动物在抗癌剂曝露后的ser、谷胱甘肽(gsh)、腺苷的变动的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为5-fu时,当将抗癌剂曝露后的3-甲基组氨酸、尸胺、prpp、4-甲基吡唑的表达变动、具体而言,将变动的促进或浓度的降低作为指标时,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,促进3-甲基组氨酸、尸胺、prpp、4-甲基吡唑在抗癌剂曝露后的变动或使浓度降低的物质,增强抗癌剂感受性。例如,在invitro中,促进抗癌剂曝露后的细胞内的3-甲基组氨酸、尸胺、prpp、4-甲基吡唑的变动或使浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,促进荷瘤动物在抗癌剂曝露后的3-甲基组氨酸、尸胺、prpp、4-甲基吡唑的变动或使浓度降低的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,在作为对象的抗癌剂为5-fu时,当将抗癌剂曝露后的半胱氨酸-谷胱甘肽、2,3-二磷酸甘油酸、n-乙酰腐胺、n8-乙酰亚精胺、腐胺、亚精胺、6-磷酸葡萄糖酸、nadh、nad+的表达变动的有无作为指标,就能够筛选抗癌剂感受性增强剂。即,在invitro或invivo中,减小这些代谢系统物质在抗癌剂曝露后的变动的物质,增强抗癌剂感受性。例如,在invitro中,减小抗癌剂曝露后的细胞内的这些代谢系统物质的变动的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。另外,在invivo中,减小荷瘤动物在抗癌剂曝露后的这些代谢系统物质的变动的物质,为增强该抗癌剂的感受性的物质(抗癌剂感受性增强剂)。
另外,当将本发明的抗癌剂感受性判定标记作为指标时,就能够筛选抗癌剂。即,在invitro或invivo中,当某种物质使抗癌剂感受性判定标记的浓度变动时,该物质就为抗癌剂。例如,在invitro中,如果比较使各种癌细胞株在某种物质中曝露后、曝露前,抗癌剂感受性判定标记的浓度变动,则该物质为抗癌剂。另外,对荷瘤动物将某种物质给药后,如果抗癌剂感受性判定标记的浓度变动,则该物质为抗癌剂。如果为能够期待药效的抗癌剂,则抗癌剂感受性判定标记的浓度变动早于肿瘤的缩小或者细胞杀伤效果出现,因此,通过以抗癌剂感受性判定标记作为指标进行筛选,以较短时间的研究就能够判定该物质是否可作为抗癌剂使用。从削减抗癌剂的开发所需的劳力和费用的方面出发,也能够期待很大的效果。
当并用这样得到的抗癌剂感受性增强剂和作为感受性增强对象的抗癌剂时,该抗癌剂的治疗效果飞跃性提高。作为组合抗癌剂感受性增强剂和作为感受性增强对象的抗癌剂的方式,既可以是包含这些成分两者的一个组合物,也可以是分别各个制剂的组合。另外,这些成分也可以是分别的给药途径。作为这里使用的作为对象的抗癌剂,与上述同样,可以列举奥沙利铂、环磷酰胺(cyclophosphamide)、异环磷酰胺(ifosfamide)、噻替哌(thiotepa)、美法仑(melphalan)、白消安(busulfan)、尼莫司汀(nimustine)、雷莫司汀(ranimustine)、达卡巴嗪(dacarbazine)、丙卡巴肼(procarbazine)、替莫唑胺(temozolomide)、顺铂(cisplatin)、卡铂(carboplatin)、奈达铂(nedaplatin)、甲氨蝶呤(methotrexate)、培美曲塞(pemetrexed)、氟尿嘧啶(fluorouracil)、替加氟/尿嘧啶(tegaful/uracil)、脱氧氟尿苷(doxifluridine)、替加氟/吉美拉西/奥替拉西(tegaful/gimeracil/oteracil)、卡培他滨(capecitabine)、阿糖胞苷(cytarabine)、依诺他滨(enocitabine)、吉西他滨(gemcitabine)、6-巯基嘌呤(6-mercaptopurine)、氟达拉滨(fuludarabin)、喷司他汀(pentostatin)、克拉屈滨(cladribine)、羟基脲(hydroxyurea)、多柔比星(doxorubicin)、表柔比星(epirubicin)、佐柔比星(daunorubicin)、依达比星(idarubicine)、吡柔比星(pirarubicin)、米托蒽醌(mitoxantrone)、氨柔比星(amurubicin)、放线菌素d(actinomycind)、博来霉素(bleomycine)、派来霉素(pepleomycin)、丝裂霉素c(mytomycinc)、阿柔比星(aclarubicin)、净司他丁(zinostatin)、长春新碱(vincristine)、长春地辛(vindesine)、长春碱(vinblastine)、长春瑞滨(vinorelbine)、紫杉醇(paclitaxel)、多西紫杉醇(docetaxel)、依立替康(irinotecan)、依立替康活性代谢物(sn-38)、托泊替康(nogitecan,topotecan)、依托泊苷(etoposide)、泼尼松龙(prednisolone)、地塞米松(dexamethasone)、他莫昔芬(tamoxifen)、托瑞米芬(toremifene)、甲羟孕酮(medroxyprogesterone)、阿那曲唑(anastrozole)、依西美坦(exemestane)、来曲唑(letrozole)、利妥昔(rituximab)、伊马替尼(imatinib)、吉非替尼(gefitinib)、吉姆单抗奥佐米星(gemtuzumabozogamicin)、硼替佐米(bortezomib)、厄洛替尼(erlotinib)、西妥昔单抗(cetuximab)、贝伐单抗(bevacizumab)、舒尼替尼(sunitinib)、索拉非尼(sorafenib)、达沙替尼(dasatinib)、帕尼单抗(panitumumab)、门冬酰胺酶(asparaginase)、维甲酸(tretinoin)、三氧化二砷(arsenictrioxide)、亚叶酸(folinate)、左亚叶酸(levofolinate)、或它们的盐、或它们的活性代谢物等。其中,优选铂配位化合物类抗癌剂、氟化嘧啶类抗癌剂,特别优选奥沙利铂、氟尿嘧啶或它们的盐。
实施例
接着,列举实施例,进一步详细地说明本发明。
实施例1
(1)方法
(a)使用细胞
使用10种人大肠癌细胞株(dld-1、hct15、hct116、ht29、lovo、ls174t、sw480、sw620、sw1116、widr)。hct116、ht29从株式会社益力多本社获得,dld-1、lovo、sw480、sw1116、widr从大日本住友制药株式会社获得,hct15、ls174t从东北大学加龄医学研究所医用细胞资源中心获得,sw620从住商医药国际株式会社(summitpharmaceuticalsinternationalcorporation)获得。
(b)药剂
l-ohp原末从株式会社益力多本社获得。
(c)对于l-ohp的感受性的评价
对于各细胞,用mtsassay(celltiter96tmaqueousonesolutioncellproliferationassay,promega)评价在0~1000μmol/l的l-ohp中曝露48小时后的细胞存活率,算出ic50值(相对于l-ohp未处理,将细胞数抑制50%的l-ohp浓度),作为各细胞的l-ohp感受性的指标。
(d)细胞内代谢物的采集
对于稳定状态的各细胞,除去培养基,在冰上用5%甘露醇(4℃)清洗细胞后,立刻添加甲醇(4℃,含有内部标准物质),由此使酶失活,在-80℃保存。此外,分别准备代谢物提取用的细胞和细胞数计算用的细胞,进行同样的处理后进行细胞计数,用于细胞数校正。
(e)代谢组(metabolome)样品的制备
在-80℃保存甲醇溶液中,加入氯仿和miliq水,进行液―液提取,除去夹杂成分。采集含有代谢物的水―甲醇层,使用截止分子量5000da的离心超滤过滤器进行除蛋白后,将滤液减压干燥,在-80℃保存。在即将测定前用miliq水使其溶解,用于代谢组测定。
(f)代谢组测定
细胞内代谢物的网罗式测定使用agilenttechnologies公司的毛细管电泳―飞行时间型质谱仪(ce-tofms)进行。以阳离子模式或阴离子模式,将m/z=50~1000的代谢物一次性进行定量分析。
(g)细胞内代谢物量和l-ohp感受性的关系
关于通过ce-tofms从各细胞样品检测出的峰,对于通过与已知m/z和移动时间的约500个标准品数据的对照而鉴定出的代谢物,研究10种人大肠癌细胞中的细胞内水平与各自的细胞的l-ohp感受性的关系。
(2)结果
(a)10种人大肠癌细胞株的l-ohp感受性的评价
对于10种人大肠癌细胞株(dld-1、hct15、hct116、ht29、lovo、ls174t、sw480、sw620、sw1116、widr)的l-ohp感受性,以通过mts试验算出的ic50作为指标进行评价。sw480(0.65±0.07μm)、lovo(0.72±0.12μm)和hct116(0.89±0.33μm)显示高感受性,sw1116(26.42±4.12μm)、ht29(23.92±9.29μm)、widr(17.30±5.24μm)和dld-1(16.95±6.31μm)显示低感受性(图1)。
(b)细胞内代谢物量和l-ohp感受性的关系
从10种人大肠癌细胞中提取细胞内代谢物,用ce-tofms一次性分析。对于从各样品检测出的数千个峰,与约500个标准品数据对照,着眼于在任何一种细胞中都确认检出并得以鉴定的代谢物。根据mts试验的结果,将10种人大肠癌细胞分成l-ohp感受性较高的上位5种(hct15、hct116、lovo、sw480、sw620)和下位5种(dld-1、ht29、ls174t、sw1116、widr)的2组,比较研究两组间的细胞内代谢物量的差异。其结果,作为在l-ohp高感受性组和低感受性组之间其细胞内水平的差异大的代谢物,得到了n-乙酰氨基葡萄糖(p=0.0108)、精氨酸(p=0.0263)、天冬酰胺(p=0.0794)、3-磷酸甘油酸(p=0.0201)、n-乙酰基-β-丙氨酸(p=0.0392)、n-乙酰天冬氨酸(p=0.0529)、1,6-二磷酸果糖(p=0.1071)(图2)。
实施例2
(1)方法
(a)使用细胞
实施例1中使用的细胞之中,使用2种人大肠癌细胞株(hct116、dld-1)。这些细胞使用含有10%胎牛血清(invitrogen公司)的doulbecco’smodifiedeagle’smedium(dmem),用
(b)药剂
l-ohp原末从株式会社益力多本社获得。另外,5-fu原末从sigma-aldrich日本株式会社获得。
(c)l-ohp的曝露和细胞内代谢物的采集
对于两种细胞,通过更换为含有10μmol/l的l-ohp的培养基开始抗癌剂曝露(将使用不含l-ohp的培养基的作为对照组)。在曝露0hr、4hr、12hr、24hr、48hr后,在冰上用5%甘露醇(4℃)清洗细胞,然后立即添加甲醇(4℃,含有内部标准物质),由此使酶失活,在-80℃保存。此外,分别准备细胞数计算用的细胞和代谢物提取用的细胞,进行同样的处理后,进行细胞计数,用于细胞数校正。
(d)5-fu的曝露和细胞内代谢物的采集
对于两种细胞,通过更换为包含100μmol/l的5-fu的培养基开始抗癌剂曝露(以不含5-fu的培养基作为对照组)。曝露0hr、4hr、12hr、24hr、48hr后,在冰上用5%甘露醇(4℃)清洗细胞,然后立刻添加甲醇(4℃,含有内部标准物质含有),由此使酶失活,在-80℃保存。此外,分别准备细胞数计算用的细胞和代谢物提取用的细胞,进行同样的处理后,用于细胞数校正。
(e)代谢组样品的制备
在-80℃保存甲醇溶液中,加入氯仿和miliq水,进行液―液提取,除去夹杂成分。采集含有代谢物的水―甲醇层,使用截止分子量5000da的离心超滤过滤器进行除蛋白后,将滤液减压干燥,在-80℃保存。在即将测定前用miliq水使其溶解,用于代谢组测定。
(f)代谢组测定
细胞内代谢物的网罗式测定使用agilenttechnologies公司的毛细管电泳―飞行时间型质谱仪(ce-tofms)进行。阳离子性代谢物的网罗式测定中,以毛细管的出口为阴极的方式施加电压,另外,在阴离子性代谢物的网罗式测定中,以毛细管的出口为阳极的方式施加电压,一次性对m/z=50~1000的代谢物进行定量分析。
(2)结果
使对于l-ohp的感受性不同的2种人大肠癌细胞(高感受性:hct116;低感受性:dld-1)暴露0、4、12、24、48小时的10μml-ohp,提取细胞内代谢物后,用ce-tofms对阳离子、阴离子和核苷酸性代谢物进行了一次性分析。对于确认检出并得以鉴定的约170个代谢物,分析l-ohp曝露后的细胞内水平的经时变化,结果,在l-ohp曝露后在低感受性细胞(dld-1)中没有观察到大的变动,在高感受性细胞(hct116)中,作为细胞内水平大幅上升的代谢物,发现了腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺、天冬酰胺、β-丙氨酸(图3~8)。
在l-ohp曝露后的经时的变化中,两种细胞间的差别大的代谢物中,对于β-丙氨酸,特别是在曝露24小时的时刻以后确认了在hct116中的细胞内水平的上升。由于β-丙氨酸已知是核酸代谢的分解物,因此用l-ohp高感受性细胞(hct116)和低感受性细胞(dld-1)对l-ohp24小时曝露后的核酸代谢的变动和与核酸代谢关系密切的代谢物的变动进行比较分析。其结果,明确了在l-ohp高感受性细胞中,核酸代谢途径上的多个代谢物的细胞内水平上升(图9)。特别是dtmp、cmp、ump、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp在hct116中确认了细胞内水平的显著上升,在dld-1中,没有观察到像hct116那样的细胞内水平的显著变动,或者与对照组相比,细胞内水平降低。关于这些代谢物,在两种细胞中比较24小时l-ohp曝露后的相对于对照组的细胞内水平的变动时,其比率(hct116/dld-1)均为1.2以上。
另一方面,imp在dld-1中观察到l-ohp曝露后细胞内水平的显著上升,但在hct116中,细胞内水平降低,在两细胞中比较24小时l-ohp曝露后的相对于对照组的细胞内水平的变动时,其比率(hct116/dld-1)为0.26,极低。
以上述的比率小于0.8、或1.2以上作为基准,筛选核酸代谢上的物质,结果,作为抗癌剂感受性判定标记,发现了dtmp、cmp、ump、imp、gmp、cdp、udp、dctp、ctp、utp、gtp、nadp+、atp和/或dgtp。
在l-ohp曝露后的经时变化中两种细胞间差大的代谢物,腐胺、n1-乙酰精胺、n8-乙酰亚精胺、精胺和在实施例1中发现的精氨酸属于多胺代谢途径,因此,在实施例1、2中得到的数据中,着眼于与多胺途径相关的代谢物的数据。其结果,作为在l-ohp高感受性组和低感受性组之间其细胞内水平的差异大的代谢物,得到了鸟氨酸、亚精胺(图10)。此外,在图11中,表示了图10的图表的观察方法。
此外,用l-ohp高感受性细胞(hct116)和低感受性细胞(dld-1)对l-ohp曝露24小时后的其他代谢物的变动进行比较分析。其结果,作为在l-ohp高感受性细胞中观察到l-ohp曝露后细胞内水平的显著上升的代谢物,发现了glu、arg、lys、n6-乙酰基赖氨酸、n-乙酰基-β-丙氨酸、n-乙酰基鸟氨酸、γ-glu-cys、β-ala-lys、glu-glu、s-乳酰谷胱甘肽、尸胺、半胱磺酸、反式肉桂酸、s-腺苷高半胱氨酸、亚精胺、n-乙酰腐胺、鸟苷、2,3-二磷酸甘油酸、丙酮酸、苹果酸、月桂酸、6-磷酸葡萄糖酸。另外,作为在l-ohp低感受性细胞中没有观察到l-ohp曝露后细胞内水平的显著上升的代谢物,发现了谷胱甘肽(gsh)、丁酸、4-甲基吡唑(图12)。
对于5-fu感受性不同的2种人大肠癌细胞(高感受性:hct-116;低感受性:dld-1),着眼于5-fu曝露24小时后的细胞内代谢组数据,选出5-fu曝露后观察到变动的代谢物(图13)。其结果,作为在5-fu高感受性细胞中观察到5-fu曝露后细胞内水平的显著上升的代谢物,发现了asp、鸟氨酸、n-乙酰基鸟氨酸、β-ala-lys、glu-glu、2-氨基己二酸、γ-氨基丁酸、s-腺苷高半胱氨酸、鸟苷、cmp、ump、1-甲基腺苷、udp、ctp、7-磷酸景天庚酮糖、磷酸二羟丙酮、丙酮酸、苹果酸、n1-乙酰精胺、异丁胺、乙醇酸。另外,作为在5-fu低感受性细胞中观察到5-fu曝露后细胞内水平显著上升的代谢物,发现了ser、谷胱甘肽(gsh)、腺苷。另外,作为在5-fu高感受性细胞中观察到5-fu曝露后细胞内水平的显著降低的代谢物,发现了3-甲基组氨酸、尸胺、prpp、4-甲基吡唑。此外,作为在5-fu低感受性细胞中确认了5-fu曝露后细胞内水平显著降低的代谢物,发现了半胱氨酸-谷胱甘肽、2,3-二磷酸甘油酸、n-乙酰腐胺、n8-乙酰亚精胺、腐胺、亚精胺、6-磷酸葡萄糖酸、nadh、nad+。
- 还没有人留言评论。精彩留言会获得点赞!