用于治疗低血糖的鼻粉末制剂的利记博彩app
发明领域本申请涉及用于鼻施用的含有胰高血糖素或胰高血糖素类似物的粉末制剂,其可用于治疗低血糖,且特别是治疗严重低血糖。本申请进一步涉及制备该粉末制剂的方法,和用于使用所述粉末制剂的设备和方法。
背景技术:
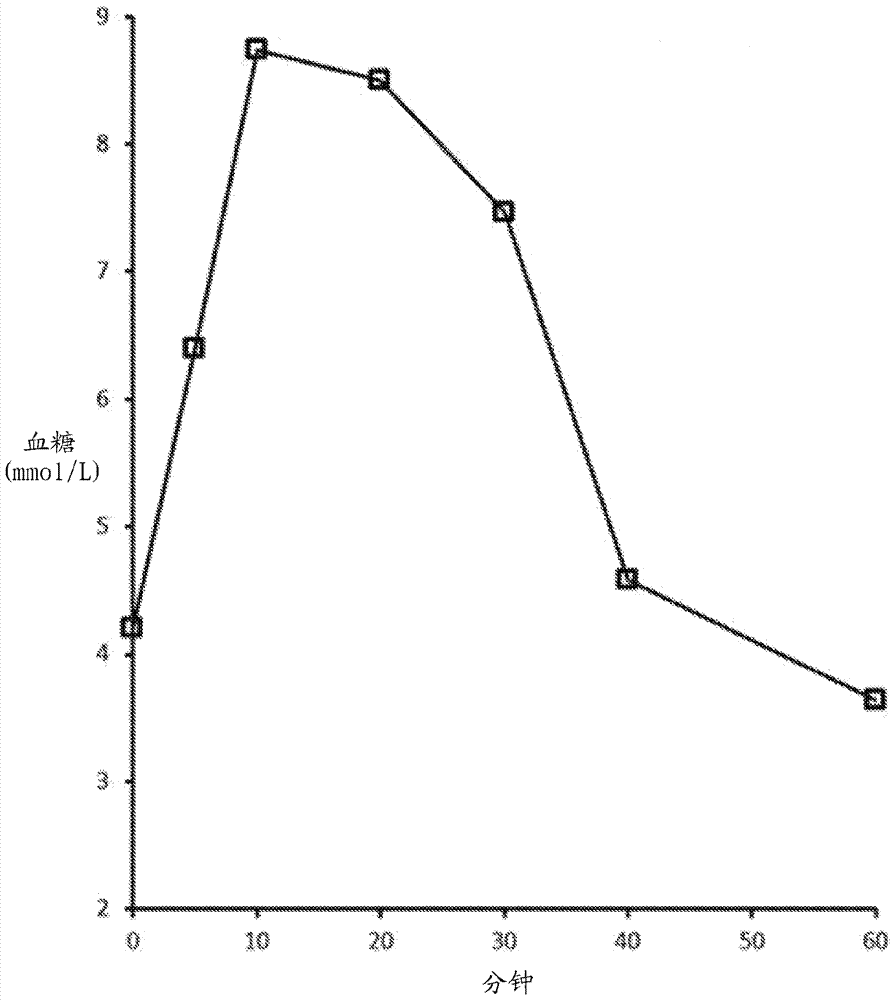
:糖尿病在大部分西方世界已经达到流行病的规模并且在很多发展中经济体中是严重的和增长中的公共健康问题。在全球,有大约2.85亿人患有糖尿病,并且预期该数字在2030年达到4.38亿(idfdiabetesatlas,2009)。糖尿病并发症通常与慢性提升的血糖水平(高血糖)有关,其导致心脏、肾脏和眼部疾病,截肢和神经功能损伤。不幸地,存在与用于治疗糖尿病相关的高血糖的药物的使用有关的非常真实和严重的并发症。用于降低血糖水平的治疗的一个最常见的并发症是低血糖(低血液糖),其最常见于使用胰岛素治疗的患者(即患有1型糖尿病的全部患者和大约30%患有2型糖尿病的患者)中,但也见于接受磺酰脲治疗的2型糖尿病患者中。实际上,如果不是低血糖的障碍,患有糖尿病的人群可能具有正常的血糖水平并且因此避免与高血糖相关的并发症(cryer,2002)。取决于发作的严重程度,低血糖导致广泛的生理问题,范围从虚弱、头晕、发汗、发冷和饥饿至更严重的症状,包括视力模糊、行为变化、癫痫、昏迷和甚至死亡。除了低血糖的生理作用,还有显著的心理作用,包括难堪、对另一次发作的恐惧,高焦虑水平和低水平的整体愉悦,其不利地影响葡萄糖控制和生活质量(deary,2008)。应当通过口服摄取碳水化合物,优选如葡萄糖片剂或等效物来治疗有意识的人的严重低血糖。对于在医院环境外的无意识个体的严重低血糖,推荐治疗是通过肌内(im)或皮下(sc)注射1mg胰高血糖素。在存在专业医疗救助和静脉通道的情况下,对无意识个体的严重低血糖,推荐静脉注射右旋糖。在全部情况中,一旦低血糖已经逆转,患者应当被允许给予口服碳水化合物至完全恢复并且防止反复的低血糖。胰高血糖素,作为在医院环境之外和之内均对严重低血糖非常有效的治疗,目前仅可以作为粉末获得,所述粉末必须在紧临注射施用之前与稀释剂混合。虽然这是对于注射胰岛素的糖尿病患者而言相对容易的程序,但是他们无法自我治疗,因为根据定义,严重低血糖是患者需要第三方援助的低血糖发作(cryer,2009)。对于面对处于低血糖昏迷或遭受低血糖相关痉挛的糖尿病患者的紧急情况的任何非医疗人员,将目前的可注射胰高血糖素重构并注射是复杂的且令人畏缩的程序,其充满潜在的错误。实际上,澳大利亚的研究者已经公开了一项研究,其中患有糖尿病的儿童或青少年的父母在模拟的紧急情况下使用目前可获得的胰高血糖素试剂盒的一种(glucogenhypokit,novonordisk)(harris等人,2001)。每位父母被要求假装在凌晨3:00且他们孩子是没有意识的。随后,给予他们未打开的急救胰高血糖素试剂盒,并且要求他们将药物施用于模拟大腿的被包裹的一块肉中。11位糖尿病健康专家(五位内分泌学家和六位糖尿病教育者)的小组作为替代对照。在参与该研究的136位父母中,106位是患有糖尿病平均持续时间4.7年的青少年的父母,且30位是患有糖尿病平均持续时间2.4年的更年轻的儿童的父母。超过90%报告此前已经接受使用胰高血糖素的训练。这些父母中,总计69%经历过目前的胰高血糖素急救试剂盒的操作困难。困难包括难以打开包装、移除针鞘、混合成分和弯曲针头。这些父母平均需要2分30秒完成所述程序(范围从30秒至>12分钟)。此外,6%完全放弃注射且4%的参与者仅注射了空气或仅注射了稀释剂。相比之下,糖尿病专家在1分17秒中执行了所述程序(范围1-1.75分钟)。在这个父母样品中观察到的错误的数量是令人不安的,特别是鉴于这是一个计时模拟且不是真实紧急事件的事实。使用胰高血糖素急救试剂盒的相关困难在来自加拿大安全用药实践研究所(ismp)的近期报告(ismpcanadasafetybulletin,2010)中得到证实。2010年9月的ismp报告记载了三起独立的意外事件,其中稀释剂被单独施用,而在施用前尚未使用稀释剂重构胰高血糖素粉末。这导致完全没有将预期剂量的胰高血糖素递送至经历严重低血糖危机的个体,并且根据该报告,在一个案例中造成患者伤害。对具有1型糖尿病的102位患者进行了电话调查以确认他们对目前可获得的胰高血糖素急救试剂盒的意见(yanai,1997)。大多数患者(67%)声称他们会更喜欢鼻内施用的胰高血糖素(如果其可以获得),且这些患者的总计82%的假定家庭成员、教师和同事会更喜欢通过鼻内途径施用急救疗法。在常是首位被召唤以治疗遭受严重低血糖发作患者的急救护理专家中,同样存在对注射施用途径的显著担心。由于固有地使用尖锐物,存在意外的血液暴露和针刺,以及感染威胁生命的传染病的相关可能性的非常真实的风险(leissj2006)。在这一背景下,一些急救专家积极寻找非侵入性施用途径,包括鼻内途径,作为增强急救患者护理,增加患者和护理实施者的安全,同时增加可以有效对紧急事件作出反应的护理提供者的集合的方法(curran,2007)。这些考量明确了当前在紧急情况下施用胰高血糖素的方法是不足的,且对于用于递送胰高血糖素以治疗严重低血糖的替代方法存在真实的需求。已经提出了多种经由鼻内施用递送胰高血糖素的方法,但是它们尚未产生注射胰高血糖素的批准的替代方法的可能性。通常,这些方法可以被分为两组:使用液体制剂施用的那些,和使用某种类型的干燥制剂的那些。在液体制剂组中,pontiroli(1983)、pontiroli(1985)、freychet(1988)、pontiroli(1989)、pontiroli(1993)和pacchioni(1995)中使用的组合物均为需要喷雾至鼻中的制剂。最近,sibley等人,2013,报道了在医院外环境的患者中,通过重构的胰高血糖素溶液的鼻内喷雾,成功地使用了预期为可注射的胰高血糖素。因为胰高血糖素在液体状态下不稳定,所以在这些研究中使用的液体组合物需要在紧临使用前重构,并且因此对于治疗严重低血糖的急救使用是不理想的。此外,在很多的这些研究中,患者需要在使用这些组合物给药后立刻做深呼吸。因为患有严重低血糖的患者经常是无意识或甚至昏迷的,因此,无法要求他们进行深呼吸。因此,这些组合物对于用于治疗严重低血糖的鼻内递送是不理想的,并且没有克服可注射制剂的挑战,其涉及由非医疗专家使用针头和需要在使用前进行制备。在第二组中,美国专利号5,059,587公开了用于生理活性肽(包括胰高血糖素)的鼻施用的粉末。这些粉末包括水溶性有机酸作为吸收促进剂。jorgensen等人1991公开了“用于鼻递送的胰高血糖素的粉末状制剂”。该制剂被公开为含有胰高血糖素、二癸基磷脂酰胆碱(ddpc)和α-环糊精(α-cd),且被报道为提供关于血糖和血胰高血糖素的增加的剂量依赖性应答。这件参考文献中没有公开组成量或制备所述制剂的方法。jorgensen1991制剂或hypogon®nasal(novonordisk)被认定为在多个后续研究中使用的材料,且在这些报道之一中,称所述试剂具有5:10:85的重量比的胰高血糖素:ddpc:α-cd的组成。在这些研究中,jorgensen1991粉末制剂的成人鼻内施用被报道显示在具有低血糖的成人中增加血糖浓度。在这些研究中,在给药后葡萄糖水平增加,直至在给药后约30分钟达到平台期。与之相比,在这些研究中使用注射胰高血糖素治疗导致葡萄糖水平从施用的时间起持续增加达至少90分钟(hvidberg,1994;rosenfalck,1992)。据报道,对患有低血糖的儿童鼻内施用jorgensen1991粉末制剂在给药后立刻增加血糖浓度,在给药后25-30分钟达到峰值水平,其后葡萄糖水平下降。与之相比,使用注射胰高血糖素治疗儿童导致血糖水平持续上升至少45分钟(stenninger,1993)。sakr,1996报道了含有胰高血糖素和二甲基-β-环糊精(dmβcd)的喷雾和粉末制剂的比较。鼻喷雾通过将商购胰高血糖素溶解在含有2或5%w/vdmβcd的“生产商溶剂”中而制备。通过冷冻干燥所述喷雾溶液获得粉末。teshima等人(2002)发现,在鼻内施用含有比例为1:69的胰高血糖素和微晶纤维素的粉末后,在健康志愿者中的最大血糖增加为1.56mmol/l(28.08mg/dl)。他们还报道所述粉末形式在5和25℃下稳定至少84天。对于用于患有胰岛素诱导的低血糖的患者中的鼻内产品,仅1.5mmol/l的增加可能不足以使患者回归正常血糖水平。此外,粉末的体积(即,对于1:69比例制剂为70mg)是相当大的,且可能对于使用可获得的设备是过量的。matilainen等人(2008,2009)调查了在升高的温度和/或湿度下长达39周,胰高血糖素/γ-cd和胰高血糖素/乳糖粉末的固态稳定性和溶解,其中胰高血糖素/γ-cd粉末的固态稳定性更好。所述粉末没有用于鼻内施用。endo等人(2005)报道了在用于肺部施用的胰高血糖素的干粉吸入剂中,使用赤藓糖醇作为赋形剂和载体。所述粉末通过将微粉化的胰高血糖素颗粒和赋形剂与更大的载体颗粒混合而制备。为了实现用于后续全身吸收的肺泡沉积,将胰高血糖素的干粉吸入剂(dpi)在大小上减少至1至6微米之间的质量中位直径,如通过激光衍射分析测量的。onoue等人(2009)报道了在用于肺部吸入的胰高血糖素干粉吸入剂中添加柠檬酸改善了溶解表现,并且不损坏固态稳定性。相比在没有柠檬酸的情况下吸入的胰高血糖素,气管内施用含有柠檬酸的胰高血糖素干粉吸入剂(大鼠中50µg/kg)导致大鼠中2.9倍更有效的促血糖增高效果。endo(2005)和onoue(2009)的公开都提出了胰高血糖素的肺部递送。由于患有严重低血糖的患者可能是无意识或严重意识障碍的,预期他们不能深呼吸以确保肺部递送。因此,胰高血糖素的肺部递送不适合用于治疗严重低血糖。虽然进行了这些努力,但没有患者可获得的当前产品,其利用鼻粉末施用胰高血糖素用于治疗严重低血糖。本发明的目的是提供这样的鼻粉末制剂。发明概述根据本发明的第一方面,提供了胰高血糖素或胰高血糖素类似物的粉末制剂。这种粉末组合物包含胰高血糖素或胰高血糖素类似物、环糊精和磷脂表面活性剂,且经配制使得至少一部分的所述粉末以通过x射线粉末衍射确定的xrpd介峰(mesopeak)表征的相存在。在进一步的具体实施方案中,所述粉末组合物由以下组成:(a)5至15重量%的胰高血糖素或胰高血糖素类似物;(b)5至51重量%的磷脂表面活性剂;(c)44至90重量%的环糊精,和(d)任选地,多至10重量%的低分子量有机酸或其药学上可接受的水溶性盐或酯。根据本发明的第二方面,提供了用于粉末制剂的鼻施用器。所述施用器包括粉末制剂储存器,和包含在所述储存器中的根据本发明的粉末制剂。根据本发明的第三方面,提供了用于制备本发明的粉末制剂的方法。这个方法包括以下步骤:(a)在含水载体中形成胰高血糖素和表面活性剂的第一混合物,其中所述表面活性剂以大于或等于临界胶束浓度的浓度存在;(b)将环糊精添加至所述第一混合物以形成第二混合物;(c)干燥所述第二混合物以形成固体制剂;和(d)加工所述固体制剂以生产均匀粉末,所述均匀粉末包括至少一部分处于通过xrpd介峰表征的相的粉末。在具体的实施方案中,对所述第二混合物的干燥可以通过对第二混合物的冷冻干燥或喷雾干燥来实施。附图说明图1:在经由具有10:10:80的胰高血糖素:dpc:β-cd重量比的粉末制剂,将1mg剂量的胰高血糖素鼻内施用至犬后,随时间以mmol/l计的血糖浓度。图2:在经由具有10:10:80的胰高血糖素:ddpc:β-cd重量比的粉末制剂,将1mg剂量的胰高血糖素鼻内施用至犬后,随时间以mmol/l计的血糖浓度。图3:在经由具有10:10:80的胰高血糖素:llpc:β-cd重量比的粉末制剂,将1mg剂量的胰高血糖素鼻内施用至犬后,随时间以mmol/l计的血糖浓度。图4:在经由具有10:10:80的胰高血糖素:d8pc:β-cd重量比的粉末制剂,将750µg剂量的胰高血糖素鼻内施用至犬后,随时间以mmol/l计的血糖浓度。图5:在经由具有5:25:70的胰高血糖素:dlpg:α-cd重量比的粉末制剂,将750µg剂量的胰高血糖素鼻内施用至犬的单个鼻孔后,随时间以mmol/l计的血糖浓度。图6:重量比为10:10:80的胰高血糖素:dpc:β-cd和胰高血糖素-ddpc-β-cd的粉末制剂的x射线粉末衍射图。图7:使用鼻内和注射胰高血糖素治疗的患有1型糖尿病和胰岛素诱导的低血糖的成人中的平均血糖浓度。图8a:使用鼻内和注射胰高血糖素治疗的患有1型糖尿病的12-17岁儿童中的平均血糖浓度。顶部线为肌内,底部线为鼻内。图8b:使用鼻内和注射胰高血糖素治疗的患有1型糖尿病的12-17岁儿童中的平均血糖浓度。顶部线为肌内,底部线为鼻内。图9a:具有(顶部线)和不具有(底部线)鼻充血的成人,和具有充血并使用鼻减充血剂预处理(中部线)的成人中的平均血胰高血糖素浓度。图9b:具有(顶部线)和不具有(底部线)鼻充血的成人,和具有充血并使用鼻减充血剂预处理(中部线)的成人中的平均血糖浓度。图10:用于鼻粉末制剂的示例性应用设备(aptar设备)。发明详述在下文列出了具有商业潜力的鼻内粉末制剂的一些期望的属性。•通过用于鼻内施用的设备的均匀剂量递送能力•不存在小颗粒的显著级分,以排除对肺的无意施用•充分的药物含量,以作为进入单个鼻孔的单剂量提供实现治疗效果所需的药物总剂量•充分的药物含量,以数十毫克或递送设备所允许的最大值递送总剂量•充分的药物含量和吸收特征,从而在可能与过敏或普通感冒相关的鼻充血的存在下有效•在环境条件下,在延长的时间段(优选至少18个月)的储藏期间的稳定性•良好的安全性和耐受性概况。此前试图开发鼻内粉末制剂的尝试在期望属性中的一个或几个中有所欠缺。本发明中描述的组合物经设计而在具有以下三种所需组分的组合物中满足这些期望属性中的一部分,并且优选满足所有的期望属性:胰高血糖素或胰高血糖素类似物、环糊精和磷脂表面活性剂。胰高血糖素和胰高血糖素类似物如本申请的说明书和权利要求书使用的,“胰高血糖素”是指以下序列的多肽:his-ser-gln-gly-thr-phe-thr-ser-asp-tyr-ser-lys-tyr-leu-asp-ser-arg-arg-ala-gln-asp-phe-val-gln-trp-leu-met-asn-thr(seqidno:1)。胰高血糖素可以是化学合成,通过重组dna技术产生,或从天然来源提取的。术语“胰高血糖素类似物”是指该序列的变体,其保留了在体内刺激血糖增加的能力,但是可以提供用于药物用途的益处,诸如更好的活性、更好的溶解性或更好的稳定性。在chabenne等人(2014)中公开了其中天然序列的一个氨基酸被替换为丙氨酸的胰高血糖素类似物,以及具有多个取代的类似物的实例,该文献通过引用并入本文。对其中三个氨基酸进行修饰,从而产生具有增强生物活性的胰高血糖素类似物的示例性类似物是[lys17,18,g1u21]胰高血糖素。zealandpharma已经公开了众多胰高血糖素类似物,例如在美国专利公开20140080757、2014001733、20130316941、20130157935、20130157929、20120178670、20110293586、20110286982、20110286981和20100204105中,其通过引用并入本文。这些类似物被报道相比胰高血糖素受体,对glp受体具有更高的结合亲和力,但是仍保留了胰高血糖素活性。zealandpharma还开始了被命名为zp4207的用于治疗低血糖的胰高血糖素类似物的临床试验。美国专利公开20130053310(其通过引用并入本文)公开了可用于治疗低血糖的其它胰高血糖素类似物。磷脂表面活性剂磷脂是普遍存在的生物膜组分,其为人体中细胞和组织,包括鼻粘膜的一部分。尽管磷脂酰甘油(pg)是生物膜的显著组分,但是细胞中最普遍的磷脂表面活性剂是磷脂酰胆碱和磷酸胆碱(pc)。在本发明的制剂中,可以使用pc和pg。还可以使用通过移除酰基之一而衍生自二酰基pc或pg的溶血磷脂。优选的磷脂可溶于水或酸化水,但是,如果需要增强磷脂溶解性,可以使用药学上可接受的助溶剂,诸如乙醇、二甲基亚砜或n-甲基吡咯烷酮。根据本发明,可以用于粉末制剂中的示例性的磷脂表面活性剂为十二烷基磷酸胆碱(dpc)、1,2-二癸基-sn-甘油-3-磷酸胆碱(ddpc或“二癸基磷脂酰胆碱”)、1-二癸酰基-sn-甘油-3-磷酸胆碱(llpc或“溶血月桂酰基磷脂酰胆碱”)、1,2-二辛酰基-sn-甘油-3-磷酸胆碱(d8pc或“二辛酰基磷脂酰胆碱”)和1,2-二月桂酰基-sn-甘油-3-磷酸(1'-rac-甘油)(dlpg或“二月桂酰基磷脂酰甘油”)。优选的磷脂表面活性剂是在制备粉末制剂期间使用的浓度下形成胶束,而不形成双分子层的那些。这包括dpc、ddpc、llpc和d8pc,但不包括dlpg。通常,可以基于磷脂表面活性剂的结构,预测与双分子层相对的胶束的形成,所述结构由二或三部分组成:含磷的胆碱或甘油头部基团、任选的甘油主链,和一条或两条酰基链。酰基链的长度和每个分子的酰基链数量对于确定某种磷脂形成胶束还是双分子层是至关重要的。当仅存在一个酰基链时,如果所述酰基链的长度小于14,那么相比双分子层更可能形成胶束,如在dpc和llpc中,其在它们的单个酰基链中具有12个碳。二酰基磷脂含有两个酰基链/分子。当每个链的链长小于12时,它们倾向于形成胶束。dlpg、ddpc和d8pc是二酰基磷脂。dlpg每个酰基链含有12个碳且形成双分子层。ddpc每个酰基链含有10个碳,其依赖于浓度而形成双分子层或胶束(marsh,1990)。d8pc每个酰基链含有8个碳,且通常形成胶束。在本发明具体的实施方案中,制剂含有单一类型的磷脂表面活性剂。在另一个实施方案中,制剂的磷脂表面活性剂组分可以由磷脂表面活性剂的混合物构成,其包括例如,上文确定的表面活性剂中的任意两种、三种或四种的组合。环糊精环糊精,作为一类,由5个或更多个1->4连接的α-d-吡喃葡萄糖苷单元组成,如在直链淀粉(淀粉)中那样。但是,如在本申请中使用的,术语“环糊精”是指更常见且典型的环糊精,其在环中含有六个、七个或八个葡萄糖残基,形成锥形,即:•α(阿尔法)-环糊精:6-元糖环分子•β(贝塔)-环糊精:7-元糖环分子•γ(伽马)-环糊精:8-元糖环分子。α-cd用于进行临床试验的novonordisk的粉末制剂(hypogon®nasal)中(stenniger和aman,1993;rosenfalck,1992)。据报道,α-cd的水溶性为约5重量%。两种其它的环糊精:一种水溶性小于α-cd(β-cd,1.85重量%),且另一种具有比α-cd更高的水溶性(hp-β-cd),也适合用于本发明的组合物;易溶于水的γ(伽马)-环糊精同样适合用于本发明的组合物。本发明的组合物中的环糊精充当填料,并且也附着至鼻粘膜表面并且帮助胰高血糖素的吸收。在递送至鼻孔后,主要成分(按重量90%至70%)即环糊精,帮助将粉末附着至鼻粘膜。环糊精的可溶性越低,预期粉末在身体上粘膜附着得越久。基于环糊精的溶解性能,预期粘膜附着性按以下顺序递减:β-cd>α-cd>hp-β-cd。因此,最优选的填料是β-cd。本发明的环糊精可以单独使用,或作为任意两种或更多种环糊精的混合物使用。粉末制剂本发明的粉末制剂含有三种成分:胰高血糖素或胰高血糖素类似物,磷脂表面活性剂和环糊精,所述成分的量在可以以单一剂量施用在单个鼻孔中的粉末量中,有效提供治疗有效量的胰高血糖素或胰高血糖素类似物。在具体的实施方案中,所述粉末制剂由以下组成:(a)5至15重量%的胰高血糖素或胰高血糖素类似物;(b)5至51重量%的磷脂表面活性剂;(c)44至90重量%的环糊精,和(d)任选地,多至10重量%的低分子量有机酸或其药学上可接受的水溶性盐或酯。如下文的实施例所反映的,当用于鼻内施用胰高血糖素时,这种类型的粉末制剂具有极好的性能,而jorgensen1991/rosenfalck1992/hypogon®nasal产品的相似的成分组没有提供可比的结果,并且显然在人对象中的起始测试后,被放弃。基于本领域中的各种描述,据信jorgensen1991/rosenfalck1992/hypogon®nasal产品含有重量比为5:10:85的胰高血糖素、ddpc和α-cd。没有提供这些成分是如何组合的信息。因此,不可能将本发明的制剂与该制剂直接比较。但是,对于每种制剂的可获得数据表明事实上所述制剂是不同的。重要的是,jorgensen1991/rosenfalck1992中描述的制剂是以分次剂量施用,在每个鼻孔中施用一半的剂量。虽然这在临床研究环境中是相对容易执行的,但是在实际使用条件下,对于治疗严重低血糖发作的非医疗看护着而言,这使援救治疗显著复杂化,因为这会需要施用两剂量的援救药物。他们还报道了50%的受治疗患者打喷嚏,这个比例比使用本发明中描述的制剂观察到的(小于2%)高得多。对成人鼻内施用jorgensen1991粉末制剂被报道显示在具有低血糖的成人中增加血糖浓度。在具有胰岛素诱导的低血糖的健康成人中,在给药后葡糖糖水平增加,直至在给药后约45分钟达到平台期。与之相比,在这个研究中,使用注射胰高血糖素治疗导致葡萄糖水平从施用的时间起持续增加达至少90分钟(hvidberg,1994)。在对患有1型糖尿病和胰岛素诱导的低血糖的成人进行的另一个研究中,葡萄糖水平在给药后增加,在鼻内给药后约30分钟达到平台期,与之相比,注射胰高血糖素则增加至少90分钟。与使用jorgensen1991/rosenfalck1992制剂观察到的葡萄糖概况相比,使用在本发明中描述的粉末制剂生成的数据显示,血糖浓度在给药后至少90分钟持续升高(图7,底部线)。如显示的,这与使用肌内胰高血糖素在相同时间段获得的的结果(图7,顶部图)相当。据报道,对患有1型糖尿病和诱导低血糖的儿童鼻内施用jorgensen1991/rosenfalck1992粉末制剂,在给药后立即增加血糖浓度,在给药后25-30分钟达到峰值水平,此后葡萄糖水平下降,与之相比,血糖水平在sc注射后至少45分钟持续提升(stenninger,1993)。在鼻内给药后大约10分钟出现治疗后胰高血糖素峰值(rosenfalck1992;stenninger1993)。与使用jorgensen1991/rosenfalck1992制剂观察到的葡萄糖概况相比,使用本发明中描述的粉末制剂,在儿童(12-<17岁)中生成的数据显示血糖浓度在给药后至少60分钟持续升高(图8b)。此外,直到给药后大约20分钟,才出现血胰高血糖素浓度峰(图8a)。因为严重低血糖的发作是不可预测的,并且可能出现在受鼻充血影响的胰岛素使用人员中,所以进行研究以评估本发明的粉末制剂在这种情况下的pk和pd。如实验11中所述和在图9a和9b中显示的,使用本发明的鼻粉末的治疗产生的药代动力学和药效动力学没有受到鼻充血的负面影响。这支持了本发明对于治疗可能遭受鼻充血的人的严重低血糖发作的效用。如在没有鼻充血的人中所观察到的,达到血胰高血糖素峰水平的时间是在给药后大约20分钟。从未报道过表明jorgensen1991/rosenfalck1992制剂是否可以用于治疗具有鼻充血的人的数据,所述鼻充血可见于患有普通感冒或季节性过敏性鼻炎的人中。本申请人相信结果中的这些差异是由本申请要求保护的粉末制剂与jorgensen1991/rosenfalck1992粉末之间的结构差异所导致的。如下文讨论的,磷脂和环糊精组分的共增溶解,随后的干燥和粉末形成,导致形成一些结构,其具有不存在于任一单独材料的特征性xrpd峰。在将胰高血糖素添加至组合物时,这个峰得到保留。不受任何具体理论的束缚,认为胰高血糖素或胰高血糖素类似物与溶液中的胶束磷脂结合,并且在干燥后维持一定的结合,但不破坏由磷脂和环糊精形成的结构,并且这种结合使胰高血糖素更好地呈现用于鼻吸收。因此,本申请要求保护的粉末制剂不仅仅是三种组分的掺合物,而是含有可通过x射线粉末衍射技术检测的独特物理结构。对本发明制剂的结构的这一理解与关于胰高血糖素与磷脂表面活性剂的相互作用的已知信息相一致。在约55:1的磷脂:胰高血糖素摩尔比,胰高血糖素形成复合结构(epand&sturtevant,1982)。还已显示胰高血糖素可以结合50个磷脂分子,且其中20个紧密结合(epand&sturtevant,1981)。boesch等人(1980)和brown等人(1981)报道,结合至多种胶束脂质(包括dpc)的胰高血糖素的构象很大程度与脂质类型无关。所述构象被描述为明确定义并显著延伸的。dpc:胰高血糖素复合物的化学计量报道为40:1。他们还提出结合胶束的胰高血糖素的构象与结合脂质双分子层的胰高血糖素的构象非常相似。如在本发明的一些优选制剂中,10:10重量比的磷脂(dpc、ddpc、llpc、d8pc或dlpg):胰高血糖素的摩尔比在6:1至10:1之间,表明在鼻内粉末制剂中,磷脂最可能密切结合胰高血糖素。对本发明的粉末制剂的x射线粉末衍射研究清楚地显示了可能与制剂中胶束或中间相结构相关的峰的存在。这些峰被表征为低衍射角度(对于dpc为6.6°2θ和对于ddpc为7.3°2θ)。(图6)在不包括胰高血糖素的样品中看到了这些相同的峰,并且在本申请中被称为“xrpd介峰”。该xrpd介峰是本发明的粉末制剂的特征。图6呈现了胰高血糖素-dpc-β-环糊精(文件474320)和胰高血糖素-ddpc-β-环糊精(文件407476)组合物的叠加x射线粉末衍射结果。衍射图保留了与晶体环糊精的存在一致的高角度峰(例如,在约18-20°-2θ的峰61),这并非预想之外的,因为相对于磷脂和胰高血糖素,环糊精大幅过量地存在。此外,每个图分别在6.6和7.3°-2θ具有低衍射角度峰。这些峰也存在于没有胰高血糖素的样品中,其通过在胶束形成浓度下溶解磷脂,添加环糊精并且随后将产生的溶液干燥来制备。如在本申请中使用的,表述“至少一部分的所述粉末以通过x射线粉末衍射确定的xrpd介峰表征的相存在”指示低角度峰在x射线粉末衍射图中是可检测的,并且可与测量的噪音清晰地区分。在优选的实施方案中,xrpd介峰的大小(由峰高度确定)是在约18-20°-2θ的峰(如图6中文件407476中的图式)高度的约30%或更高,并且可以与该峰高度大约相等(如图6中文件474320的图式)。已经在具有和不具有胰高血糖素的样品中,并使用不同的制剂和干燥技术,观察到了由xrpd介峰表征的相的形成。已经观察到取决于干燥条件,可以出现xrpd介峰的形状和位置的一些变化。例如,在一个实验中观察到产生更厚冻层和更长干燥时间的更大量的冻干,导致两个加宽并重叠的xrpd介峰的形成。本发明的进一步的益处是其作为急救治疗的可用性,甚至是在极端环境条件下,特别是寒冷条件下。即使当温度低于凝固点时,本发明的制剂仍可直接使用,并且测试已经显示在-20℃储存的粉末可以直接使用,并且具有可接受的胰高血糖素递送和摄取。与之相比,含有用于在使用前重构胰高血糖素的液体载体的急救试剂盒必需保持在载体的凝固点之上。同样地,胰高血糖素溶液也必需保持在溶液的凝固点之上,如果使用诸如dmso的溶剂提供溶液的稳定性,这将是更高的温度。制备本发明的组合物的方法本发明的进一步的方面是用于制备具有胰高血糖素活性的粉末制剂的方法,所述粉末制剂包含胰高血糖素或胰高血糖素类似物、环糊精和磷脂表面活性剂,其中至少一部分的所述粉末以通过x射线粉末衍射确定的xrpd介峰表征的相存在。所述方法包含以下步骤:a.在含水载体中形成胰高血糖素和表面活性剂的第一混合物,其中所述表面活性剂以大于或等于临界胶束浓度的浓度存在;b.将环糊精添加至所述第一混合物以形成第二混合物;c.干燥所述第二混合物以形成固体制剂;和d.加工所述固体制剂以形成均匀粉末,所述均匀粉末包括至少一部分处于通过xrpd介峰表征的相的粉末。形成第一混合物的步骤a,可以通过向溶剂(例如水),添加胰高血糖素或胰高血糖素类似物,并随后添加表面活性剂而完成。可选地,可以首先溶解表面活性剂,随后添加胰高血糖素或胰高血糖素类似物。还可以单独溶解混合物的两种组分,并随后组合以形成第一混合物。优选地,将溶剂酸化至ph4或更低,以增强胰高血糖素的溶解性。酸化可以使用无机酸,诸如hcl、磷酸或硫酸,或有机酸,诸如乙酸、柠檬酸、乙醇酸或乳酸,或使用无机酸和有机酸的组合完成。在优选的制剂中,所述酸为乙酸。用于形成第一混合物的溶剂的量足以溶解所述第一混合物中的胰高血糖素和磷脂表面活性剂。可以使用过量溶剂,但是大过量增加了干燥步骤中所需的时间量和能量,并因此是不优选的。环糊精可以作为固体或在溶剂(诸如水)中添加至第一混合物,以形成第二混合物。混合可以通过包括静态和动态混合的方法进行。动态混合可以通过使用插入液体的叶片完成,所述叶片连接至轴并且通过发动机旋转。静态混合可以使液体流动通过静态混合器中的弯曲通道进行。在高速混合条件下,混合期间存在的空气-水交界面可能导致发泡。由于剪切力,高速混合还可以进而导致的蛋白质的不稳定。为了使发泡最小化,并优选消除它,优选低速混合条件。在动态混合的情况下,通过搅拌器的每分钟转数(rpm)确定速度。优选rpm值为100-1000之间。在静态混合的情况下,通过选择允许无层流的泵,获得低剪切条件。将第二混合物干燥以移除溶剂(例如水)并产生固态产品。干燥可以通过冷冻干燥、喷雾干燥、盘式干燥或其他技术进行。产品的宏观物理特征将取决于干燥技术而变化,并且可以是来自冷冻干燥的片状固体或干燥的固体块的形式。与干燥中使用的方法无关,从制剂移除过量的水对粉末的特征和稳定性具有重要影响。具有过量水分含量的粉末可能是粘的并且形成团块,导致难以操作粉末用于填充施用设备。重要的是,残留的含水量水平对稳定性具有直接影响。在胰高血糖素的情况中,充分理解的是稳定性和物理特征受到水的负面影响。具体地,在过量水的存在下,胰高血糖素形成淀粉样原纤维,其负面影响胰高血糖素的稳定性和毒性概况。(pederson2010)。因为形成淀粉样原纤维的这一倾向,目前可用的胰高血糖素产品作为粉末供应,以待在紧临使用前溶解在水中。由于水解、氧化和脱酰胺作用,水还可以负面影响胰高血糖素的稳定性。对此,使用本发明的制剂生成的数据指示相比具有低于5%的残留含水量的粉末,在散装粉末中超过5%的残留含水量水平导致降低的稳定性。因此,用于鼻施用的合适的粉末通常具有低于5%的残留含水量水平。用于鼻施用的合适的粉末通常具有使得大多数颗粒大于约10微米并小于约1000μm的粒径分布。优选地,粒径分布将使得d10落入3-75μm的范围内,d50落入15-450μm的范围内,且d90落入80-1000μm的范围内,具有1.5-15的跨度。用于鼻施用的合适的粉末需要允许足够流动性的物理特征,以允许将它们填充至鼻喷放设备中。流动性通过多个参数确定,包括粒径、形状、密度、表面质地、表面积、密度、内聚力、附着力、弹力、多孔性、吸水性和易碎性。可以通过加工散装粉末以移除太小或太大的颗粒,来产生具有合适粒径和流动性特征的粉末。加工散装粉末以移除太小或太大的颗粒的方法可以包括研散装状粉末,以破坏较大的颗粒,并筛分以分离期望粒径范围的颗粒。可以执行多种筛分的方法,包括投掷筛分、水平筛分、拍打筛分、超声筛分和空气循环喷射筛分(aircircularjetsieving)。可以将筛作为固定标称口径的单筛使用,或者可以通过逐步缩小口径的一些列筛子加工散装粉末,以获得期望的粒径分布。筛可以是具有25-1000μm范围的正常口径的金属筛网筛。由使用鼻粉末施用设备的粉末施用产生的喷射模式和羽流几何学(plumegeometry)是重要的特征,其决定了在鼻腔中沉积鼻粉末的表面积。用于本发明的合适的喷射模式特征包括5-25mm的最小直径(d最小),10-60mm的最大直径(d最大)和0.5-6的椭圆度比。就本发明的制剂观察到的具体的喷射模式概述在下表中。对于本发明合适的羽流几何学特征包括落入20-75°范围内的喷射角度,和落入10-50mm的范围的羽流宽度。下表总结了根据本发明的多批次粉末的羽流几何学信息。本发明的组合物的施用和施用器虽然用于将粉末引入使用者鼻内的任何方法都可以用于本发明的方法,但是本发明的粉末组合物适合在根据目的设计的鼻施用器中提供,所述施用器将粉末保持在干净、干燥和可用的状态直至使用,并且随后将粉末递送至使用者的鼻粘膜。这样的施用器是本领域已知的,并且通常具有粉末制剂储存器,和包含在所述储存器中的粉末制剂,和用于将粉末制剂通过鼻孔内可接受的喷嘴从储存器排出的机制。选择能够在一次吹入/施用中提供足够粉末制剂的施用器以提供治疗剂量。对于在制剂中具有较低百分比的胰高血糖素或胰高血糖素类似物的粉末,需要更大的储存器和递送能力,而较小的储存器和递送能力可以用于具有更高百分比的制剂。在美国专利号6,398,074和6,938,798中公开了特定的合适的递送设备,所述专利通过引用并入本文。图10取自'074专利以说明合适的设备。在图10中,储存器810含有单一剂量的根据本发明的制剂。储存器810具有进气口811和产品出口815。产品保留设备812和/或813配置在进气口811中,以将产品保存在储存器810中直至产品分配。通过关闭球816封闭(优选以密封方式)产品出口815,关闭球816在产品分配时,通过气流从其封闭位置移开。当使用者开启设备时,他以如下方式向柱塞825施加压力,以使活塞821压缩包含在鼓风机820的室822中的空气。因为网格812可以透过空气,室822中空气压缩传递至储存器810,并且因此施加于封闭产品出口815的关闭球816。关闭球816的尺寸及其在储存器产品出口815的固定,使得当通过所述鼓风机820中的储存器810产生最小的预定压力时,球816从其封闭位置移开。因此,当达到最小压力时,球立刻朝向设备的出口通道840移动,并且由鼓风机820产生的气流将储存器810中含有的全部剂量排出。由该关闭球816产生的预加压缩确保当其从它的封闭位置移开时,在使用者手中积累的能量使得活塞821连同柱塞825在室822中推进,从而产生强力的气流,即,适合细致地喷射产品的剂量并且显著去除任何产品团聚体(如果其为粉末产品)的气流。适合与本发明的粉末组合物组合使用的施用器设备的另一个实例是美国专利公开号20110045088中所公开的,该公开通过引用并入本文。还可以使用美国专利号7,722,566中展示的设备,特别是其图1和7中显示的,因为使用本发明的粉末,不需要施用至两个鼻孔。用于粉末组合物的鼻施用的施用器设备的仍进一步的实例已知来自wo2014004400和美国专利号5,702,362,其通过引用并入本文。实验实施例1将胰高血糖素、dpc和α-cd、β-cd或hp-β-cd溶解在0.01n或0.1nhcl溶液中。还使用1m乙酸或0.5m乙酸制备制剂。胰高血糖素:dpc:环糊精的重量比在5:10:75至10:20:70的范围。在两个独立实验中,添加柠檬酸钠或柠檬酸作为添加剂。将冻干粉末包装在用于递送至鼻孔的设备中。粉末以500µg、750µg或1000µg的剂量鼻内递送至比格犬。粉末施用至3或6只犬/组。通过使用血糖仪测量血糖浓度。在表1中显示了施用前(0分钟)和鼻施用后5、10、20、30、40和60分钟的血糖浓度。在表1中,比例是指胰高血糖素:dpc:环糊精的比例,或胰高血糖素:dpc:环糊精:添加剂的比例。表1:鼻内施用胰高血糖素:dpc:cd组合物后比格犬中的平均血糖浓度(mmol/l)。全部组合物(使用不同的酸浓度、不同的酸、三种成分的不同比例、在柠檬酸或柠檬酸钠的存在下制备、在不同剂量、递送至一个鼻孔或两个鼻孔)显示长达10-30分钟之间的血糖浓度的增加,随后在40分钟减少,并且随后在60分钟进一步减少。作为实例,来自以1000µg剂量施用至一个鼻孔的具有β-cd和0.01nhcl的10:10:80组合物的结果显示在图1中。实施例2将胰高血糖素、ddpc和α-cd、β-cd或羟丙基-β-cd溶解在0.01n或0.1nhcl溶液中。胰高血糖素:ddpc:环糊精的重量比在5:10:75至10:20:70的范围。在一个研究中,还添加了柠檬酸钠。将粉末包装在用于递送至鼻孔的设备中。将粉末以500µg、750µg或1000µg的剂量鼻内递送至比格犬。粉末施用至3或6只犬/组。通过使用血糖仪测量血糖浓度。结果显示在下表中。在表2中显示了施用前(0分钟)和鼻施用后5、10、20、30、40和60分钟的血糖浓度。在表2中,比例是指胰高血糖素:ddpc:环糊精的比例,或是指胰高血糖素:ddpc:环糊精:添加剂的比例。表2:鼻内施用胰高血糖素:ddpc:cd组合物后比格犬中的平均血糖浓度(mmol/l)。全部组合物(使用不同的酸浓度、不同的环糊精、不同的比例制备,不同的剂量、递送至一个鼻孔或两个鼻孔)显示长达10-30分钟之间的血糖浓度的增加,随后在40分钟减少,并且随后在60分钟进一步减少。作为实例,来自以1000µg剂量施用,递送至一个鼻孔的具有β-cd的10:10:80组合物的结果显示在图2中。实施例3将胰高血糖素、llpc和β-cd溶解在0.01n或0.1nhcl溶液中。胰高血糖素:llpc:β-cd的重量比为10:10:80。将粉末包装在用于递送至一个鼻孔的设备中。粉末以750µg或1000µg的剂量鼻内递送至比格犬。粉末施用至6只犬/组。通过使用葡萄糖检测条测量血糖浓度。表3中显示了施用前(0分钟)和鼻施用后5、10、20、30、40和60分钟的血糖浓度。表3:鼻内施用胰高血糖素:llpc:cd组合物后比格犬中的平均血糖浓度(mmol/l)。全部组合物(不同的剂量、递送至一个鼻孔)显示长达10-20分钟之间的血糖浓度的增加,随后在30或40分钟减少,并且随后在40或60分钟进一步减少。作为实例,来自以1000剂量施用至一个鼻孔的具有β-cd的10:10:80组合物的结果显示在图3中。实施例4将胰高血糖素、d8pc和β-cd溶解在0.01n或0.1nhcl溶液中。胰高血糖素:d8pc:β-cd的重量比为10:10:80。将粉末包装在用于递送至鼻孔的设备中。将粉末鼻内递送至比格犬。粉末施用至6只犬/组。通过使用葡萄糖检测条测量血糖浓度。在表4中显示了施用前(0分钟)和鼻施用后5、10、20、30、40和60分钟的血糖浓度。表4:鼻内施用胰高血糖素:d8pc:cd组合物后比格犬中的平均血糖浓度(mmol/l)。全部组合物(使用不同的酸浓度制备,递送至一个鼻孔)显示长达10-20分钟之间的血糖浓度的增加,随后在30或40分钟减少,并且随后在40或60分钟进一步减少。作为实例,来自以750µg剂量施用至一个鼻孔的具有β-cd的10:10:80组合物的结果显示在图4中。实施例5将胰高血糖素、dlpg和α-cd溶解在0.1nhcl溶液中。胰高血糖素:dlpg:α-cd的重量比为5:25:70或5:54:41。将胰高血糖素、dlpg和β-cd以10:10:80的重量比单独地溶解在0.1nhcl溶液中。将产生的溶液冻干以生产粉末。将粉末包装在用于递送至鼻孔的设备中。将粉末递送至比格犬的一个鼻孔或两个鼻孔。粉末施用至3或6只犬。通过使用葡萄糖检测条测量血糖浓度。结果显示在下表中。在表格中显示胰高血糖素:dlpg:α-cd(或ß-cd)的重量比、每个鼻孔的胰高血糖素剂量、将粉末递送至一个还是两个鼻孔。在表5中显示了施用前(0分钟)和鼻施用后5、10、20、30、40和60分钟的血糖浓度。表5:鼻内施用胰高血糖素:dlpg:cd组合物后比格犬中的平均血糖浓度(mmol/l)。全部组合物(使用不同的环糊精、不同的比例制备、不同的剂量、递送至一个鼻孔或两个鼻孔)显示长达10-30分钟之间的血糖浓度的增加,随后在40分钟减少,并且随后在60分钟进一步减少。作为实例,来自以750µg剂量施用至一个鼻孔的具有α-cd的5:25:70组合物(其导致最高的血糖浓度)的结果显示在图5中。实施例6使用x射线粉末衍射以确定胰高血糖素-dpc-β-环糊精和胰高血糖素-ddpc-β-环糊精组合物的结构。它们展示了在低角度(对dpc为6.6°2θ,且对ddpc为7.3°2θ)的峰,指示了中间相(图6)。这些峰对于胰高血糖素不存在,因为其为无定形粉末。它们也不存在于β-环糊精中,β-环糊精展示了特征性的晶形。此外,它们不存在于表面活性剂dpc中。这些峰存在于不存在胰高血糖素的ddpc(或dpc)和β-环糊精的混合物中。本发明的组合物由可通过这些低衍射角度峰检测的中间相表征。实施例7使用体积-加权分布概况的计算d10、d50和d90,呈现在表6中。表6:10%颗粒的直径(d10),50%颗粒的直径(d50)和90%颗粒的直径(d90)。表面活性剂酸d10(µm)d50(µm)d90(µm)ddpc0.1nhcl6.06311.7721.86dpc0.1nhcl6.6366.51426超声处理的dpc0.1nhcl3.610.6821.77d8pc0.1nhcl7.92617.9735.34llpc0.1nhcl8.03115.3128.89dpc1m乙酸6.86792.480537.471粒径分析显示6种不同粉末制剂中的少数颗粒具有3.6至8.031µm范围的有效直径。d10结果显示递送至鼻孔的粉末中超过90%的颗粒不会被吸入。实施例8使用制备方法中描述的方法制备粉末制剂。组合物是使用1m乙酸制备的10:10:80胰高血糖素:dpc:β-环糊精的组合物。10毫克粉末含有1mg胰高血糖素。将10毫克粉末制剂包装在10个设备的每一个中。收集在设备启动后递送的粉末。由10个设备递送的粉末的重量作为递送剂量(mg)显示在表7中。表7中还显示了来自十个设备的递送剂量均一性(%),其通过将10份递送的粉末中每一份的胰高血糖素量与在填充至十个设备中每一个之前的10毫克粉末中的胰高血糖素量的比例乘以100来计算。表7:递送剂量和递送剂量的均一性设备编号递送剂量的均一性(%)递送剂量mg197.59.3297.09.2398.99.74102.79.85100.39.7692.39.07100.29.6896.99.2994.89.21096.89.2实施例9进行多中心、随机、双向、交叉的三期研究,其中招收患有1型糖尿病的患者(t1d,n=75)以评价在胰岛素诱导的低血糖后,单剂量的鼻内施用的胰高血糖素(作为本发明主题的粉末)相比通过im注射施用的胰高血糖素的功效和安全性。本研究的主要终点是在使用胰高血糖素治疗30分钟内实现增加血糖水平至≥70mg/dl或在使用胰高血糖素治疗30分钟内血糖增加20mg/ml的患者的比例。方案使用胰岛素以降低血糖水平至低血糖范围(目标最低点<50mg/dl)。对使用鼻粉末治疗的血糖应答的统计分析显示鼻粉末在治疗胰岛素诱导的低血糖中不逊于注射的胰高血糖素。呈现于图7的葡萄糖应答曲线显示在鼻和注射治疗组中葡萄糖水平均大幅增加,并且在给药后约15分钟,两个组中的大多数受试者的血糖水平增加至正常范围内。实施例10–amg103amg103是在患有1型糖尿病,年龄在4-<17岁的儿童中的研究。在该群体中引入严重低血糖是儿科irb所不允许的,但是如果需要,在使用胰高血糖素给药前,使用胰岛素将血糖标准化至<80mg/dl(4.4mmol/l)的目标。儿童访问研究设施两次。在第一次访问时,随机地对12名年龄在12至<17岁的儿童通过im注射胰高血糖素(剂量率根据生产商的标签),或作为本发明主题的胰高血糖素粉末制剂(按重量10:10:80)。在第二次访问时,对象接受另一个的治疗。对于4至<8岁和8至<12岁年龄组的儿童,每组有18名儿童。在这些年龄组的每一个中,儿童以2:1随机接受两剂量鼻内胰高血糖素或胰高血糖素im的单次注射。对于接受in胰高血糖素的儿童,他们在第一次访问中随机接受2或3mg并且在第二次访问中接受另一个的剂量水平。研究参与者和研究中心对剂量水平不知情。作为在使用鼻胰高血糖素粉末给药的儿童中的观察结果的实例,提供了来自年龄12-<17的儿童的结果。图8a提供了胰高血糖素pk曲线,而图8b提供了葡萄糖概况。在本研究中生成的数据表明鼻粉末胰高血糖素产生了葡萄糖应答,其与注射胰高血糖素后所观察到的没有差异。实施例11-鼻充血的影响在一个研究中,在患有普通感冒,有以及没有伴随施用鼻减充血剂的受试者中,测试由重量比10:10:80的胰高血糖素:dpc和β环糊精组成的本发明粉末,以研究3mg剂量的in胰高血糖素在男性和女性受试者中的安全性和pk/pd。这是单中心、单剂量、开放性、重复测量、平行设计研究。全部三十六(36)名受试者在10小时禁食过夜后的早晨,通过鼻内途径接受3mg单一剂量的胰高血糖素。组群1(18名受试者)被安排进行两个阶段。在阶段1期间,受试者具有与普通感冒相关的鼻充血和/或流鼻涕,并且在阶段2期间,受试者从普通感冒康复并且已经至少2天没有症状。在组群2(受试者#019至036)中,受试者被安排仅进行阶段1。在呈现与普通感冒相关的鼻充血和/或流鼻涕后,在接受in单一剂量的胰高血糖素之前,使用鼻减充血剂预治疗这些受试者。对峰值鼻吸气流的测量提供了鼻充血的客观测量,并且确认了与普通感冒相关的鼻充血以及羟甲唑啉的预期治疗效果。在本研究期间,研究的药物被良好耐受并且没有严重的不良事件或死亡。在施用粉末后的胰高血糖素和葡萄糖应答呈现在图9a和9b中。血胰高血糖素浓度(图9a)增加,大幅高于基线,对于“amg504-1+普通感冒”、“普通感冒+减充血剂”和“无感冒症状”分别具有1198.4、868.0和801.5pg/ml的平均峰浓度(cmax)。达到峰浓度的中值时间(tmax)对于全部治疗组为给药后20分钟。对于‘amg504-1+普通感冒’预算的auc0-t比另外两个治疗组更高(1198.4对比1038.0和797.5)。全部三组中,血糖水平(图9b)在给药后5分钟开始增加,表明鼻充血,有以及没有伴随施用鼻减充血剂,对血糖应答的发生没有影响。总体而言,无论普通感冒的存在或者对具有普通感冒的受试者施用减充血剂,在鼻内施用胰高血糖素后的葡萄糖概况是相当的。本研究的结果表明,鼻内施用的粉末的pk或pd没有受到与普通感冒相关的鼻充血(有以及没有伴随施用鼻减充血剂)的显著影响。这是非常重要的,因为使用胰岛素的患有糖尿病的人随时处于经历严重低血糖的风险下,包括当遭受过敏或普通感冒时。因此,意图用于治疗严重低血糖的鼻内胰高血糖素必须还在存在鼻充血的情况下有效。实施例12在大鼠、犬和兔中进行一系列研究,评价本发明的组合物的生物相容性、安全性和耐受性。评价了亚慢性和急性毒性。表8显示了这些研究的发现。研究显示本发明的组合物被良好耐受且无副作用。表8:在大鼠、犬和兔中的亚慢性和急性毒性研究。研究类型物种测试物&剂量关键发现28天亚慢性毒理学犬盐水、安慰剂粉末、amg504-1以2和4mg/犬/天进行28天除了短暂的(即,<30秒)鼻声和在给药后立即分泌唾液之外,没有不良的临床迹象。没有不良的大体尸检发现或对bw、食物消耗、临床化学、血液学、ekg或器官重量的治疗相关作用。嗅上皮轻微至中等的完全可逆的萎缩/退化。在全部组织的组织学检查中没有微观测试物相关的发现。28天亚慢性毒理学大鼠盐水、安慰剂液体、在溶液中的amg504-1成分以0.1和0.2mg/大鼠/天,持续28天。没有不良的临床迹象或大体尸检发现。没有对bw、食物消耗、临床化学、血液学、ekg或器官重量的治疗相关作用。在高剂量组中,嗅上皮轻微至中等的完全可逆的糜烂/溃疡。在全部组织的组织学检查中没有微观测试物相关的发现。急性毒理学大鼠空气安慰剂对照、amg504-1以0.5mg气管内施用无不良的临床、宏观或微观发现急性毒理学兔在眼直接施用30mg药物产品良好耐受,最低限度的眼部刺激,限于位于结膜和眼睑膜的轻微红斑和水肿。参考文献(全部通过引用并入本文)c.boesch,l.r.brown,和k.wuethrich.physicochemicalcharacterizationofglucagon-containinglipidmicelles.biochim.biophys.acta603:298-312,1980.l.r.brown,c.boeschandk.wuthrich.locationandorientationrelativetothemicellesurfaceforglucagoninmixedmicelleswithdodecylphosphocholine:eprandnmrstudies.biochim.biophys.acta642:296,1981s.carstens和m.sprehn.prehospitaltreatmentofseverehypoglycaemia:acomparisionofintramuscularglucagonandintravenousglucose.prehospitalanddisastermedicine13:44-50,1998chabenne等人,molecularmetabolism3(2014)293–300.p.e.cryer.hypoglycaemia:thelimitingfactorintheglycaemicmanagementoftypeiandtypeiidiabetes.diabetologia45:937-948,2002.p.e.cryer.hypoglycemiaindiabetes.americandiabetesassociation.2009.r.curran.amilestonechangeinpractice.acallforwidespreadapplicationofintranasalmedicationdeliveryintheprehospitalenvironment.www.emsworld.com.2007i.j.deary.symptomsofhypoglycaemiaandeffectsonmentalperformanceandemotions.in:hypoglycaemiainclinicaldiabetes.secondedition.eds.b.m.frierandm.fisher.2007.h.dodziuk.cyclodextrinsandtheircomplexes.wiley-vchverlag,berlin,2006.k.endo,s.amikawa,a.matsumoto,n.sahashiands.onoue.erythritol-baseddrypowderofglucagonforpulmonaryadministration.int.j.pharm.290:63-71,2005.r.m.epand和j.m.sturtevant.acalorimetricstudyofpeptide-phospholipidinteractions:theglucagon-dimyristoylphosphatidylcholinecomplex.biochemistry20:4603-4606,1981.r.m.epand和j.m.sturtevant.studiesontheinteractionofglucagonwithphospholipids.biophys.j.37:163-164,1982.j.filipovic-grcic和a.hafner.nasalpowderdrugdelivery.chapter5.7,p.651-681,in:pharmaceuticalmanufacturinghandbook:productionandprocesses,editedbys.c.gad,wiley-interscience,newyork,2008,pp.1384.l.freychet,n.desplanque,p.zirinis,s.w.rizkalla,a.basdevant,g.tchobroutsky和g.slama.effectofintranasalglucagononbloodglucoselevelsinhealthysubjectsandhypoglycaemicpatientswithinsulin-dependentdiabetes.thelancet.pp.1364-1366,june18,1988glucagonforinjection(rdnaorigin).packageinsert.elililly&co.2005.g.harris,a.diment,m.sulway和m.wilkinson.glucagonadministration–underevaluatedandundertaught.practicaldiabetesint.18:22-25,2001.m.a.howellandh.r.guly.acomparisonofglucagonandglucoseinprehospitalhypoglycaemia.j.accid.emerg.med.14:30-32(1997).a.hvidberg,r.djurup和j.hilsted.glucoserecoveryafterintranasalglucagonduringhypoglycaemiainman.eur.j.clin.pharmacol.46:15-17,1994.idfdiabetesatlas,internationaldiabetesfoundation,fourthedition,2009.ismpcanadasafetybulletin.administrationofproduct-specificdiluentwithoutmedication.instituteforsafemedicationpracticescanada.10(7):1-3,2010.k.k.jain.drugdeliverysystems.methodsinmolecularbiology.vol.437.pp.8-9,humanapress,totowa,nj,2008.s.jorgensen,a.r.sorensen,l.l.kimer和n.mygind.apowderyformulationofglucagonfornasaldelivery-aphase1study.diabetes40[suppla]:2190,1991n.c.kaarsholm.stabilizedaqueousglucagonsolutionscomprisingdetergents.patentnumberswo9947160,ep19990906095,1999.n.c.kaarsholm.stabilizedaqueouspeptidesolutions.u.s.patentno.6,384,016,1999a.d.lichtenberg.liposomesasamodelforsolubilizationandreconstitutionofmembranes.chapter13.pp.199-218.in:handbookofnonmedicalapplicationsofliposomes.modelsforbiologicalphenomena.volii,ed.y.barelholzandd.d.lasic,crcpress,bocaratonfl.pp.379,1996marsh,d.handbookoflipidbilayers.crcpress,bocaraton,fl,387pp.,1990.l.matilainen,k.l.larsen,r.wimmer,p.keski-rahkonen,s.auriola,t.jarvinen和p.jarho.theeffectofcyclodextrinsonchemicalandphysicalstabilityofglucagonandcharacterizationofglucagon/gamma-cdinclusioncomplexes.j.pharm.sci.97:2720-2729,2008.l.matilainen,s.l..maunu,j.pajander,s.auriola.i.laaskelainen,k.l.larsen,t.jarvinen和p.jarho.thestabilityanddissolutionpropertiesofsolidglucagon/gamma-cyclodextrinpowder.eur.j.pharm.sci.36:412-420,2009.s.onoue,k.yamamoto,y.kawabata,m.hirose,t.mizumoto和s.yamada.noveldrypowderinhalerformulationofglucagonwithadditionofcitricacidforenhancedpulmonarydelivery.int.j.pharm.382:144-150,2009.r.p.oomenandh.kaplan.bindingofglucagontolipidbilayers.biochem.cellbiol.68:284-291,1990.j.e.sondergaardpederson.thenatureofamyloid-likeglucagonfibrils.j.diab.sciencetech.4:1357-1367.2010.a.e.pontiroli,m.alberetto和g.pozza.britishmedicaljournal.287:462-463,1983.a.e.pontiroli,m.alberetto,a.calderara,e.pajetta和g.pozza.nasaladministrationofglucagonandhumancalcitonintohealthysubjects:acomparisonofpowdersandspraysolutionsandofdifferentenhancingagents.eur.j.clin.pharmacol.37:427-430,1989.a.m.rosenfalck,i.bendtson,s.jorgensen和c.binder.nasalglucagoninthetreatmentofhypoglycaemiaintype1(insulin-dependent)diabeticpatients.diabetesresearchandclinicalpractice.17:43-50,1992.f.m.sakr.nasaladministrationofglucagoncombinedwithdimethyl-β-cyclodextrin:comparisonofpharmacokineticsandpharmacodynamicsofsprayandpowderformulations.int.j.pharmaceutics132:189-194,1996.sibley等人prehosp.emer.care.vol.17:98-102,2013.e.stenninger和j.aman.intranasalglucagontreatmentrelieveshypoglycaemiainchildrenwithtype1(insulin-dependent)diabetesmellitus.diabetologia.36:931-935,1993.d.teshima,a.yamauchi,k.makino,y.kataoka,y.arita,h.nawata和r.oishi.nasalglucagondeliveryusingmicrocrystallinecelluloseinhealthyvolunteers.int.j.pharm.233:61-66,2002.d.p.tieleman,d.vanderspoel和h.j.c.berendsen.moleculardynamicssimulationsofdodecylphosphocholinemicellesatthreedifferentaggregatesizes:micellarstructureandlipidchainrelaxation.j.phys.chem.b104:6380-6388,2000o.yanai,d.pilpel,i.harman,e.elitzur-leiberman和m.philip.iddmpatients’opinionsontheuseofglucagonemergencykitinsevereepisodesofhypoglycaemia.practicaldiabetesint.14:40-42,1997.序列(seqidno:1)his-ser-gln-gly-thr-phe-thr-ser-asp-tyr-ser-lys-tyr-leu-asp-ser-arg-arg-ala-gln-asp-phe-val-gln-trp-leu-met-asn-thr序列表<110>elilillyandcompany<120>用于治疗低血糖的鼻粉末制剂<130>x20946<150>62/117031<151>2015-02-17<160>1<170>patentinversion3.5<210>1<211>29<212>prt<213>智人<400>1hisserglnglythrphethrserasptyrserlystyrleuaspser151015argargalaglnaspphevalglntrpleumetasnthr2025当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1