一种治疗脑部损伤类疾病的神经干细胞注射液的利记博彩app
本发明涉及属于生物医药领域,具体涉及一种治疗脑部损伤类疾病的神经干细胞注射液和制备方法及其使用方法。
背景技术:
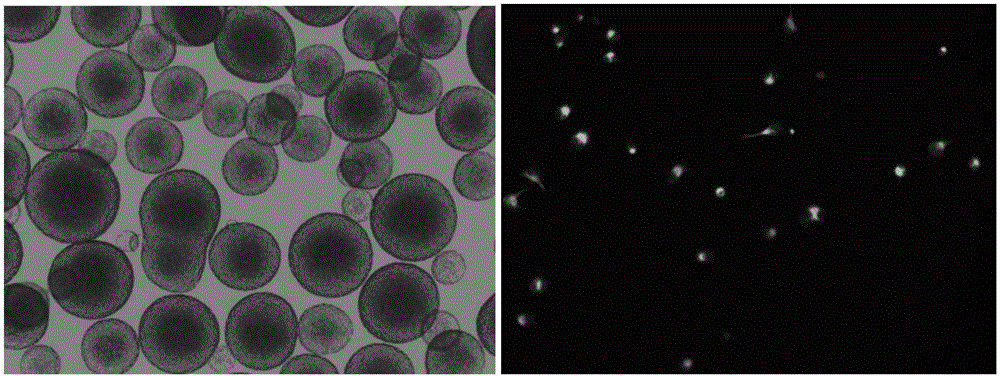
:小儿脑瘫通常指出生前到出生后一个月内由各种原因引起的非进行性脑损伤或脑发育异常所导致的中枢性运动障碍。临床上以姿势与肌张力异常、肌无力、不自主运动和共济失调等为特征,常伴有感觉、认知、交流、行为等障碍和继发性骨骼肌肉异常,并可有癫痫发作,该病目前无理想的治疗手段,致残率高,给患者本人及家庭造成的精神负担和经济负担重。根据卫生部发布的数据计算,我国每年新生儿1600万人,据不同统计,小儿脑瘫发病率在千分之二到千分之五左右,即每年3-8万人;而由于以往人口出生率高、医疗条件落后导致发病率高、治愈率低等原因,有报道称我国已有累积小儿脑瘫患者500万人。因此该病危害十分严重。小儿脑瘫目前常用的治疗方式有物理治疗、作业治疗、家庭训练、矫形器等。常用的药物有脑神经营养药、肌肉松弛剂等,然而药物治疗只有在必要时才使用,它不能替代功能性训练。注射用鼠神经生长因子是被SFDA批准的一种生物制剂,提取自小鼠的颌下腺,与人的同源性达90%,采用肌肉注射的方式给药,据报道对小儿脑瘫引起的肌张力、运动发育、姿势异常、反射异常等症状有一定改善效果。目前所有的治疗小儿脑瘫的药物大多为提供营养,缓解症状,不能达到治疗的目的。也就是说,目前市场上并没有特异性治疗小儿脑瘫的有效药物。在临床上通常采取药物和运动康复相结合的办法。最近CFDA批准的一种注射用鼠神经生长因子生物制剂用于小儿脑瘫的治疗,该药物来源于小鼠的额下腺,与人的同源性达90%,采用肌肉注射方式给药,据报道对小儿脑瘫引起的肌张力,运动发育,姿势异常,反射异常等症状有一定改善效果。脑损伤主要还包括脑中风和创伤性脑损伤,国内外已有大量临床前实验研究表明神经干细胞(NSC)对于脑中风和创伤性脑损伤有一定的治疗效果。并且有部分临床试验证明NSC移植能够治疗脑损伤。神经干细胞(NSC)是一群较原始的、能自我更新并具有多种分化潜能的细胞,可分化成神经元、少突胶质细胞和星形细胞。在生理条件下,体内的NSC通常保持静息状态;神经损伤后,内源性NSC可因微环境的改变而被激活、迁移和分化,以替代损伤的细胞和重建神经环路;遗传修饰后,外源性NSC移植显示了很大的治疗潜力,为脑损伤的治疗提供了新的手段。技术实现要素:本发明的目的在于克服上述现有技术存在的不足,一种治疗脑部损伤类疾病的神经干细胞注射液和制备方法及其使用方法。本发明的目的是通过以下技术方案来实现的:本发明涉及一种治疗脑部损伤类疾病的神经干细胞注射液的制备方法,所述方法包括如下步骤:S1:原代细胞培养:将原代神经干细胞用无血清培养基对细胞悬液进行培养扩增;其中,原代神经干细胞的来源为哺乳动物、灵长类动物或啮齿类动物的神经干细胞中的一种或几种;所述原代神经干细胞为手术分离废弃胎脑组织的皮层组织,然后消化酶将组织消化离心获得原代神经干细胞悬液;原代神经干细胞的来源方法包括IPSC诱导、提取胚胎干细胞、提取人类视网膜色素上皮细胞或提取神经组织器官以外的其他器官或组织干细胞。优选的,原代神经干细胞的来源为医疗废弃的人源胎脑皮层组织的神经干细胞。这种来源为完全100%人源,是一种单一的干细胞产品,用自主研发的无血清培养基和培养工艺,在体外培养到P3代,干细胞纯度可达95%以上,神经干细胞活性在90%以上。优选的,所述原代神经干细胞为手术分离废弃胎脑组织的皮层组织,细胞消化计数后,采用无血清完全培养基进行重悬,并调整密度为1x105个/ml,然后接种至超低吸附培养瓶中,放入35℃5%CO2中环境中进行培养。其中,无血清培养基是由DMEM/F12,B27,N2,以及神经营养因子BFGF,EGF,LIF组成,无任何动物源血清成分。S2:神经干细胞纯化及扩大培养:将扩增满的原代神经干细胞进行消化、传代,直至传到第5代,并鉴定细胞纯度达95%以上后,作为种子细胞;P5到P8代都可作为种子细胞,种子细胞可以冻存,便于保存。所述扩增满为至细胞直径超过300μm,然后进行消化传代至P1代神经干细胞;培养方法为连续培养10-14天,期间每24小时进行观察,确认细胞生长状态正常,每隔48-72小时进行换液;悬浮培养和贴壁培养的神经干细胞在显微镜下的形态见图1。P1代神经干细胞消化后接种至超低吸附培养瓶中,放入35℃5%CO2的环境中进行培养至传代,重复消化、接种、培养的过程直至传代到P5代神经干细胞;所述培养方法为每间隔48-72小时进行换液,连续培养10-14天。将P5代神经干细胞进行细胞特性和异源物质检测,细胞特性鉴定包括流式鉴定神经干细胞表面标记物SOX2和NESTIN,检测其纯度达95%以上,见图2。荧光免疫的方法鉴定神经干细胞特性和纯度为95%以上,并具有多种分化潜能,能够分化为神经元,星型胶质细胞和少突胶质细胞。异源物质主要是微生物的检测,包括无菌检测,支原体和内毒素检测,其结果阴性为合格,检测合格后将细胞冻存作为种子细胞。S3:神经干细胞工作细胞库的建立:将步骤S2中的种子细胞,计数并无血清培养基悬浮培养,待培养瓶细胞融合到80%—90%,将细胞消化传代,如此反复直至细胞传代P9代;S4:神经干细胞注射液的制备:将步骤S3中的P9代细胞加生理盐水定容或负载于微载体,制成临床用神经干细胞注射液。优选的,步骤S3的悬浮培养的方法包括以下步骤:具体方法参见申请号为201110173821.1的专利。(a)将神经干细胞接种在包含bFGF和EGF的DMEM/F12或DMEM培养基中培养;(b)2、3或4天后在培养基中添加5-20%体积的营养补充液并继续培养,其中所述营养补充液是包含1×B27添加剂,1×N2添加剂,1.0-3.0mMol/L的L-谷氨酰胺,0.5-1.5mMol/L的丙酮酸钠,0.5-1.5mMol/L的NAC,50-150ng/ml的bFGF,50-150ng/ml的EGF以及1-15ng/ml的LIF的DMEM/F12或DMEM培养基;(c)监测培养基中形成的神经球直径,当60%以上、优选70%以上神经球直径高于阈值时,分离直径高于所述阈值的神经球,消化后收获,其中所述阈值为200-500μm,例如为250μm、300μm、350μm、400μm或450μm;(d)未挑中的直径小于所述阈值的剩余细胞保留在原培养基中,将培养基移除1/2-1/4体积,然后添加与移除体积相同体积的(a)中所述的包含bFGF和EGF的培养基继续培养;(e)在(a)接种神经干细胞10、11、12、13、14或15天后通过合并(c)中收获的细胞和(d)继续培养所得的细胞而收获细胞。优选的,步骤S4中,所述微载体包括脂质体、微胶囊或微球载体。上述的制备方法制成的治疗脑部损伤类疾病的神经干细胞注射液。上述的神经干细胞注射液中包含大于1×106个神经干细胞。上述的治疗脑部损伤类疾病的神经干细胞注射液的使用方法,将所述治疗脑部损伤类疾病的神经干细胞注射液植入患者体内;所述植入方法包括定点注射,静脉回输、鞘内注射、鼻腔粘膜吸附或肌肉注射。与现有技术相比,本发明具有如下有益效果:1、本发明的神经干细胞注射液可来源自认废弃的胚胎组织,完全100%人源,是一种单一的干细胞产品,用自主研发的无血清培养基和培养工艺,在体外培养到P3代,干细胞纯度可达95%以上,神经干细胞活性在90%以上。2、该发明的神经干细胞在体外可连续传代到第32代并保持良好的干性和分化潜能。对数期细胞倍增时间最快可达16-24小时,活率95%以上。3、体外扩增能力强,增值倍数(每传代一次)可最高达8-10倍。自主开发的冻存复苏技术,细胞冻存后复苏率可达90%以上,便于神经干细胞制剂的制备和储存。4、体外分化为神经元和少突胶质细胞能力较强。在无诱导分化下,此神经干细胞分化为神经元的比例为75%-80%(远高于其他同类产品,大部分神经干细胞自发分化神经元的比例在20%左右),分化为少突胶质细胞的比例为4%以上(其他神经干细胞自发分化为少突胶质细胞较少,1%以下)。5、该发明的神经干细胞可以来源于IPS,胚胎干细胞,不同来源间充质干细胞转化得到的神经干细胞,具有大脑皮层来源的神经干细胞。6、哺乳动物来源的神经干细胞注射液7、该注射液用于治疗小儿脑瘫,脑卒中,急慢性脑损伤8、鼻腔粘膜吸附的给药方式和纹状体定点给药治疗脑损伤和小儿脑瘫9、体外免疫学反应测试显示,此神经干细胞对外周淋巴细胞没有明显的刺激作用,具有较低的免疫原性。10、药效学实验表明此神经干细胞注射液鼻腔或脑内给予可改善脑损伤大鼠的运动平衡能力和脑损伤面积。移植的神经干细胞可在脑内存活35天以上,并分化为神经元。所有实验动物未出现免疫反应和意外死亡,显示了较好的安全性。附图说明图1为悬浮培养的神经干细胞球和正在分裂增殖的单个神经干细胞;图2为流式检测鉴定神经干细胞纯度为95%以上;图3为鼻腔给予神经干细胞后第42天脑组织的切片的CV染色图,比例尺为2mm;图4为脑梗死面积百分比;图5为hNSC能够改善HI损伤后大鼠的感觉,学习,记忆和认知能力。图(A)为HI造模、hNSCs给药以及各种行为测试的时间安排;图(B-C)为sham+saline(n=23),sham+hNSCs(n=24),HI+saline(n=17)andHI+hNSCs(n=17)各组大鼠的翻正反射(B)和步态分析(C)的表现;图(D)为各组大鼠的走网试验的表现(N=12/组);图(E-H)为SCT的表现;图6为Morris水迷宫的表现,左图为训练时间,右图为目标象限所花费的时间;图7hNSCs能够调节NF-κB信号传导,并降低IL-1β的表达。(A,C,E,G)为对应的westernblot条带。(B,D,F,H)为各条带表达的相对强度;图8为行为学观察图;图A体重(BWT)、图B平衡木实验(BBT)、图C身体抬高摇摆实验(EBST)、图DBederson评分实验数据分别用GraphPad5.0作图;图9脑梗死面积结果。具体实施方式下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。实施例1:制得原代神经干细胞1、从胚胎干细胞(ESCs)诱导获得原代神经干细胞使用细胞刮挑取ESCs细胞克隆,轻柔吹散,然后使用神经干细胞诱导液重悬,转移至超低吸附培养皿中进行悬浮培养3天左右,收集形成的细胞球,轻柔吹散,再用神经干细胞诱导液进行重悬,超低吸附培养皿中再次悬浮培养3天,收集形成的细胞球;将提前一天使用Laminin包被的培养皿用不含Ca、Mg的DPBS洗涤2次,将收集的细胞球用神经干细胞完全培养基进行重悬,接种于包被好的培养皿中进行贴壁培养,每2-3天进行换液,直至形成明显的神经样集落,然后使用细胞刮收集形成的集落,并使用accutase将其消化成为单个细胞,用神经干细胞完全培养基进行重悬,悬浮培养,使其形成神经干细胞球,获得的神经干细胞球可以消化进行传代,也可以进行液氮冻存。2、从诱导多能干细胞(iPSCs)诱导获得原代神经干细胞挑取iPSCs细胞克隆,将细胞轻柔吹散并使用不含bFGF和EGF的完全培养基进行重悬,转移至超低吸附培养皿中进行悬浮培养7天左右,每2-3天进行半量换液,然后离心收集形成的细胞球。将提前一天使用Laminin包被的培养皿用不含Ca、Mg的DPBS洗涤2次,将收集的细胞球用含有并接种于包被好的培养皿中进行贴壁培养,每2-3天进行换液,直至形成明显的神经样集落,然后使用细胞刮收集形成的集落,并使用accutase将其消化成为单个细胞,用神经干细胞完全培养基进行重悬,悬浮培养,使其形成神经干细胞球,获得的神经干细胞球可以消化进行传代,也可以进行液氮冻存。3、人源废弃胚胎组织获得原代神经干细胞1)胚胎组织获取将完整的胚胎/废弃胎儿置于100mm无菌培养皿的hibernationmedium缓冲溶液中,用缓冲液反复冲洗。在解剖镜下,一手持眼科镊,另一手持眼科剪,剥离头部皮肤和骨骼,打开颅腔,暴露脑组织,用精细手术镊撕去脑组织周围血管膜。用精细手术镊夹断脑皮层的边缘,分离脑皮层,放入35mm无菌培养皿的缓冲溶液中。再用精细手术镊将脑皮层分割成约1mm大小的组织块。将取材得到的人胚胎/胎儿脑皮层和缓冲溶液用无菌一次性3ml滴管转移进入一个或多个15/50ml离心管,静置5分钟,使组织块充分沉淀到管底,尽量吸弃上清。然后用无菌注射器和0.22um滤膜进行无菌过滤,直接滤入离心管中,每个15ml离心管中需5ml消化液,之后进行轻微晃动。将离心管放入35℃二氧化碳培养箱消化,每5分钟手动振荡一次,消化30分钟后,离心300g,5分钟,20℃。最后用无菌一次性3ml滴管吸弃上清至约50ul处,用1ml枪头吸取950ul缓冲溶液加入离心管,轻柔吹吸10-15次,以致形成单细胞悬液。2)接种配制的神经干细胞培养液20ml并加入低吸附T75培养瓶中。根据计数得到的悬液细胞密度和200个/ul的最终细胞接种密度,计算需接种的细胞悬液的体积。用无菌一次性吸管混匀细胞悬液,用合适量程的移液枪在液面下再吹打,取出计算体积的单细胞悬液,迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动容器,使细胞在培养液中均匀分布。将接种后的T75培养瓶迅速放入二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。4)原代细胞培养原代细胞接种培养后,根据细胞生长情况及培养液外观,按照《神经干细胞培养加液标准操作程序》每过2-3天,从二氧化碳培养箱中取出T75培养瓶,放入生物安全柜中。用2ml的无菌移液管,取出已配置好的神经干细胞培养营养补充液2ml,迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞均匀分布。将加好补液的低吸附T75培养瓶迅速放回二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。5)细胞收获神经干细胞培养至7-10天,观察细胞生长状态,用无菌吸管将低吸附T75培养瓶中的神经球和培养液吸入50ml离心管中,100g,4℃,离心10min,使神经球充分沉淀到管底,尽量吸去上清,将吸取的上清液放入无菌容器中,得到原代神经干细胞。实施例2:P1-P5代神经干细胞的制备1、原代神经干细胞传代与培养将已配好的10ml无菌神经消化液用无菌注射器注入装有原代神经干细胞球的离心管中。将离心管口用parafilm膜密封,静置3分钟。加入准备好的除菌神经组织消化液,放入35℃的二氧化碳培养箱中作用30分钟(每10分钟手动震荡一次5秒)。低温离心机4℃,300g,离心10分钟。用无菌一次性吸管吸弃上清,用大功率移液器和移液管加入1·-5mLDMEM/F12冲洗,上下吹打2-3次,使组织分离。低温离心机4℃,300g,离心10-20分钟。重新加入1-5mLhibernationmedium洗涤,共洗涤三次。用无菌一次性吸管吸弃上清。加入1-5mLDMEM,使细胞沉淀悬浮均匀,注意不要产生气泡使细胞沉淀悬浮均匀,用于后续计数操作。1.1细胞计数按照《细胞密度测定标准操作程序》对单细胞悬液进行计数。1.2传代与培养根据计数得到的悬液细胞密度,计算需接种的细胞悬液的体积。将三个低吸附T75培养瓶中加入10-30ml的神经干细胞培养液。用无菌一次性吸管混匀细胞悬液,用合适量程的移液枪在液面下再吹打,取出计算体积的单细胞悬液(根据计数得到的悬液细胞密度和50-500个/ul的最终细胞接种密度),迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞在培养液中均匀分布。将接种后的低吸附T75培养瓶迅速放入二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。2、细胞的收获与冻存P2细胞接种培养后,根据细胞生长情况及培养液外观,按照《神经干细胞培养加液标准操作程序》每过2-3天,从二氧化碳培养箱中取出T75培养瓶,放入生物安全柜中。用2ml的无菌移液管,取出已配置好的神经干细胞培养营养补充液2ml,迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞均匀分布。将加好补液的低吸附T75培养瓶迅速放回二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。得到P2代细胞。2.1消化收获用无菌吸管将低吸附T75培养瓶中的神经球和培养液吸入50ml离心管中,100g,4℃,离心10min,使神经球充分沉淀到管底,尽量吸去上清,将吸取的上清液放入无菌容器中做好标记存放于4℃冰箱中储存备用。2.2洗涤将已配好的5-50ml无菌神经消化液用无菌注射器注入装有P2神经球的离心管中。将离心管口用parafilm膜密封,静置3分钟。加入准备好的除菌神经组织消化液,放入35℃的二氧化碳培养箱中作用10-50分钟(每10分钟手动震荡一次5秒)。低温离心机4℃,300g,离心10分钟。用无菌一次性吸管吸弃上清,用大功率移液器和移液管加入5mLDMEM/F12冲洗,上下吹打2-3次,使组织分离。低温离心机4℃,300g,离心5-30分钟。重新加入1-10mLhibernationmedium洗涤,共洗涤三次。2.3过滤和细胞计数用无菌一次性吸管吸弃上清。加入2mLDMEM,使细胞沉淀悬浮均匀,按照《细胞密度测定标准操作程序》对单细胞悬液进行计数。2.4P2代到P5代细胞培养将消化后的P2代细胞按1×105个/ml的密度接种到T75培养瓶中,培养过程和消化过程与P1代细胞相同,待细胞生长到80%以上的时候进行消化,计数和传代,以此类推,直至获得P5代细胞的获得。2.4细胞冻存分装鉴定细胞纯度达95%以上后,用无菌吸管将低吸附T75培养瓶中的神经球和培养液吸入50ml离心管中,100g,4℃,离心10min,使神经球充分沉淀到管底,尽量吸去上清,将吸取的上清液放入无菌容器中做好标记存放于4℃冰箱中储存备用2.5程序性降温使用程序降温仪进行程序降温:将需冻存的细胞放置于程序性降温仪中按照标准冻存程序将至-80以下℃。2.6细胞入库冻存结束后,将冻存盒取出转移到液氮罐中贮存。实施例3P6-P9代神经干细胞的制备1、细胞的复苏从液氮罐中取出冻存的细胞,放入电热恒温水槽中的复苏架上(水温保持在40左右),快速晃动复温。由固态变成液态时,复苏即完成。1.1细胞的洗涤将离心管口用parafilm膜密封,静置3分钟。加入准备好的除菌神经组织消化液,放入35℃的二氧化碳培养箱中作用5-60分钟(每10分钟手动震荡一次5秒)。低温离心机4℃,300g,离心10分钟。1.2取样计数和洗涤用无菌一次性吸管吸弃上清,用大功率移液器和移液管加入1-10mLDMEM/F12冲洗,上下吹打2-3次,使组织分离。低温离心机4℃,300g,离心10分钟。重新加入1-10mLhibernationmedium洗涤,共洗涤三次。用无菌一次性吸管吸弃上清。1.3传代与培养将1:3接种于低吸附T75培养瓶中加入5-50ml的神经干细胞培养液。用无菌一次性吸管混匀细胞悬液,用合适量程的移液枪在液面下再吹打,取出计算体积的单细胞悬液(根据计数得到的悬液细胞密度和10-500个/ul的最终细胞接种密度),迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞在培养液中均匀分布。将接种后的低吸附T75培养瓶迅速放入二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。2、种子细胞的传代P5细胞接种培养后,根据细胞生长情况及培养液外观,每过2-3天,从二氧化碳培养箱中取出T75培养瓶,放入生物安全柜中。用2ml的无菌移液管,取出已配置好的神经干细胞培养营养补充液1-5ml,迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞均匀分布。将加好补液的低吸附T75培养瓶迅速放回二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。2.1消化神经干细胞培养至7-10天,观察细胞生长状态,达到平台期(细胞经连续2日观察,增值缓慢或停滞)进行传代操作。按照《神经球消化标准操作程序》进行。其中6瓶T75用于1:3继续传代培养,其余按照《神经干细胞冻存标准操作程序》冻存。2.2细胞计数将细胞吹打成单个神经干细胞,取10ul在细胞自动计数仪上计数。2.3传代与培养将消化后的单个神经干细胞,按着0.1-10*105个/ML的浓度接种继续培养,在T75瓶中混匀培养,放入二氧化碳培养箱中,待培养瓶细胞融合到80%—90%,将细胞消化传代,如此反复直至细胞传代P9代。实施例4:P6-P9代神经干细胞注射液的制备将冻存的P5-P8神经干细胞按着实施例3的方法进行复苏,计数后接种,在T75培养瓶中培养,根据细胞生长情况及培养液外观,每过2-3天,从二氧化碳培养箱中取出T75培养瓶,放入生物安全柜中。用2ml的无菌移液管,取出已配置好的神经干细胞培养营养补充液1-5ml,迅速加入低吸附T75培养瓶中,并轻轻从不同方向晃动,使细胞均匀分布。将加好补液的低吸附T75培养瓶迅速放回二氧化碳培养箱中,培养温度为35℃,二氧化碳浓度为5%。待神经干细胞培养10-14天,观察细胞生长情况,如细胞融合达到85%以上,即可消化细胞,用无菌吸管将低吸附T75培养瓶中的神经球和培养液吸入50ml离心管中,100g,4℃,离心10min,使神经球充分沉淀到管底,尽量吸去上清,将吸取的上清液放入无菌容器中做好标记存放于4℃冰箱中储存备用。需要时取出装有神经干细胞的离心管,加入50ml生理盐水,细胞混匀后离心,4℃,离心10min。离心后取上清,再次重复以上步骤,共计洗涤2次,然后加入1ml生理盐水进行细胞计数,最后用生理盐水定容成1×106个细胞/ml的神经干细胞注射液。此注射液可用于动物实验和临床实验治疗脑部损伤类疾病。实施例5:小儿脑瘫动物模型研究1、实验动物动物:SPF级出生后7天的SD大鼠(13-19g,雌雄各半)2、造模(HI)乙醚麻醉,动物固定并暴露左侧颈总动脉,用电凝器进行横断,待其恢复1.5小时,然后在7.8%O2/92.2%N2的低氧箱中进行缺氧2小时(HI)。3、干细胞治疗HI造模后24小时鼻腔给药,细胞数共3x105/6ul,左右各3ul,两次间隔时间5min。4、实验分组正常对照组1(正常组)——给予生理盐水正常对照组2——ANGE-S001HI模型对照组(模型组)——给予生理盐水HI模型给药组(ANGE-S001组)——ANGE-S001给药ANGE-S001配制过程:将鲜活的P9代神经干细胞3x105溶于6ul生理盐水中。5、疗效检测和机理探索(1)鼻腔给予神经干细胞注射液3h后,PKH-26(红)标记的hNSC(3×105细胞/动物)在SD大鼠头部的在体生物发光,SD大鼠头部的在体生物发光成像明显;脑中总的荧光强度明显强于生理盐水给药组;神经干细胞在脑内主要分布在嗅球,皮质,胼胝体和海马区域。(2)hNSCs对脑损伤的长期影响。见图3。切片中脑损伤的面积和损伤对侧的脑面积均进行了计算,见图4。可见hNSCs给予后能显著减少HI造成的组织损伤(模型组大鼠5只,神经干细胞组大鼠6只)。。神经干细胞给予后能明显减少HI引起的脑梗死面积。(3)hNSC能够改善HI损伤后大鼠的感觉,学习,记忆和认知能力。见图5。由图(B)可见在给药后第3天,神经干细胞能显著降低翻正实验所需的时间。由图(C)可见在给药后第5天,神经干细胞能显著降低步态分析的时间。需要注意的是HI+hNSCs组的老鼠和假手术组在交流和好奇心上表现出一致的偏好,而HI+生理盐水组刚好相反。和HI+saline组大鼠不同,HI+的hNSCs组大鼠与假手术组大鼠表现出相似的nose-point(图G)和ceter-point(图H)指数。(4)在获得性试验中,HI+saline组大鼠的潜伏期明显比HI+hNSCs组和假手术组大鼠长。在保留试验中,HI+saline组大鼠和sham+saline组和HI+hNSCs组大鼠相比,在目标象限所花费的时间和跨越平台的频率都显著降低,见图6。(5)鼻腔给药后第3天采用westernblot对IL-1β,磷酸化IκBα,和NF-κBp65的表达,见图7。如图7所示,HI损伤增加了细胞内IL-1β,磷酸化IκBα和NF-κBP65的表达,而hNSCs能逆转这一过程。对于细胞核NF-κB,hNSCs能显著的增强其表达。实施例6:脑损伤MCAO动物模型研究1.实验动物动物:成年SD大鼠(220-250,雌雄各半),共40只2.造模(MCAO)术前禁食不禁水12h。动物用10%戊巴比妥钠(32mg/kg)腹腔注射麻醉。参考改进的ZeaLonga方法造模,缺血达到2h后小心抽出栓线,即形成再灌注。假手术对照只是不插入尼龙鱼线,其余步骤同手术组。在手术后保持体温在(37±0.5)℃。模型制作成功标准:参照Bederson确立的5级评分法,对大鼠的神经功能缺损进行评分。在MCAO大鼠造模2h后,对大鼠的神经功能进行评分,评分在1-3级者定为造模成功小鼠,0级和4级者弃去。3、神经干细胞治疗MCAO造模后24小时鼻腔给药,NSC双侧鼻腔给药,每侧3ul,给药后保持姿势5min,间隔15min。实验分组组别数量(只)剂量(细胞/体积)注射方式1正常组6生理盐水/6ul双侧,造模后1,3,7天2模型组5生理盐水/6ul双侧,造模后1,3,7天3人源NSC71*106个/6ul双侧,造模后1,3,7天4鼠源NSC101*106个/6ul双侧,造模后1,3,7天5.行为学观察造模后第1d、3d、5d、7d、14d、21d、28d、35d、42d、49d、56d分别进行Bederson评分,EBST实验、平衡木实验,每次同步记录体重数据。见图8。Sham组与MCAO+NS、MCAO+hNSC.、MCAO+rNSC.组比较:*P<0.05,**P<0.01;MCAO+NS组与MCAO+hNSC.组比较:#P<0.05,##P<0.01;MCAO+NS组与MCAO+rNSC.组比较:无差异;MCAO+hNSC.组与MCAO+rNSC.组比较:^P<0.05,^^P<0.01。6.脑梗死面积结果由图9可见,脑组织切片结果,神经干细胞组能显著修复脑损伤引起脑梗死。当前第1页1 2 3
相关技术
网友询问留言
已有1条留言
-
 0访客 来自[中国] 2021年09月30日 11:17该技术成熟度要反复在人体上实验成百上千次,方可祢成功。
0访客 来自[中国] 2021年09月30日 11:17该技术成熟度要反复在人体上实验成百上千次,方可祢成功。
1