一种生物仿生型组织粘合剂的制备方法与流程
本发明涉及医用生物材料技术领域,具体涉及一种生物仿生型粘合剂及其制备方法,该生物仿生型粘合剂在湿润环境组织的粘合、微创手术穿刺部位的粘合、以及单纯创伤性皮肤撕裂处的粘合、免手术缝合等方面有潜在应用价值。
背景技术:
多年来,由于缝合牢固、伤口不易裂开等优点,采用缝合线、铆钉等材料或器械缝合伤口是临床上最常用且最有效的伤口粘合方法。然而,随着现代医学的快速发展,临床上对手术方法和辅助材料的要求越来越高,为了减少手术的复杂程度和对病人的创伤,医用粘合剂获得了飞速的发展和广泛的应用。
医用粘合剂是指在医疗上应用的可粘附在表面或使表面间发生粘合的制剂、材料或物质,主要用于器官或组织的局部粘合与修补、传统缝合术的辅助止血、牙齿的修补、骨骼或关节的结合与定位等技术领域。与传统方法如缝合与钉合相比,医用粘合剂的使用可有效缩短手术时间、避免缝合与钉合过程中造成的二次损伤、减轻患者疼痛感、提高患者的就医舒适度。因此,医用粘合剂越来越受到医生和患者的青睐。
目前为止,人类对医用软组织粘合剂的研究已有数十年。各种类型的医用软组织粘合剂,虽然都已应用于临床,但均具有一定的局限性。纤维蛋白粘合剂虽然应用时间久,应用范围广,但是由于其相对较低的粘合强度而逐渐被取代;半合成软组织粘合剂Bio Glue、GRF粘合剂等虽然粘合强度达到使用要求,但由于产品中使用醛类物质对人体产生潜在毒害作用,因此使用过程中必然会带来潜在的生物安全隐患,抑制了进一步的推广和应用,化学合成类组织粘合剂如美国Ethicon Endo-Surgery公司的Dermabond Topical Skin Adhesive和德国Meyer-Haake Medical Innovations公司的Tissue adhesive,还有广东龙心医疗器械有限公司的α-氰基丙烯酸正丁酯医用粘合剂等,该类粘合剂均通过小分子单体物质快速聚合来达到产生粘性的目的,这些小分子单体具有一定的毒性,它们的毒副作用将可能导致潜在的热效应、引起炎症反应甚至还可能导致组织坏死等 严重的不良反应。
于此同时在实际的手术操作中,各种创面都是处于一个出血、组织液渗透等潮湿环境,上述各种组织粘合剂的使用环境大都在干燥环境下效果更佳,而潮湿环境下会发生溶胀脱落影响粘合效果,因此研制出一种无毒、潮湿环境下使用仍具有具有高强度组织粘合性的新型组织粘合剂是该领域内的发展趋势。
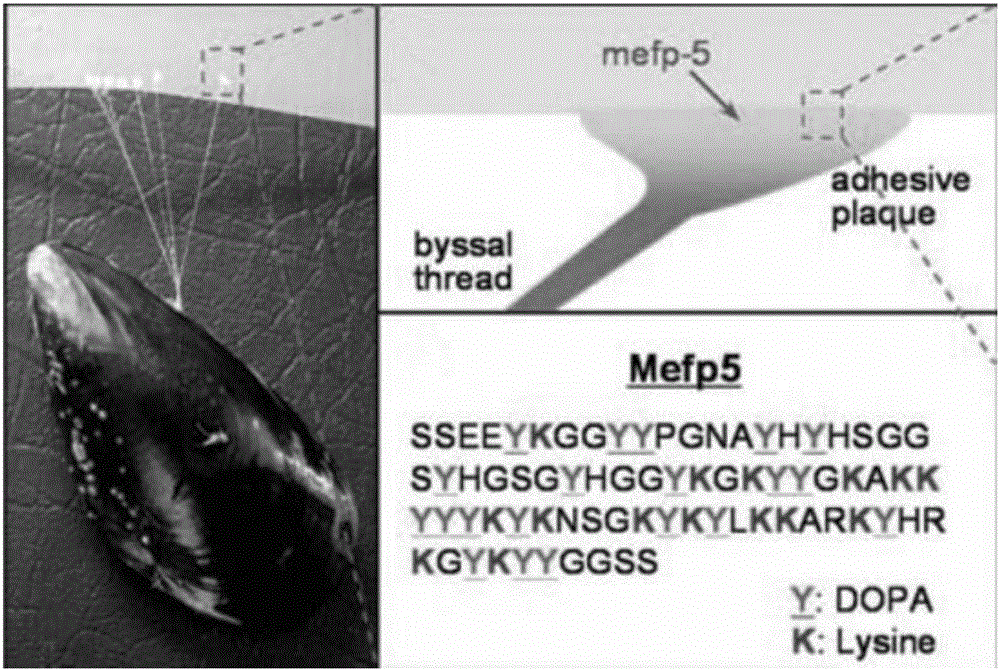
海洋贻贝类生物通过足丝分泌的黏附蛋白,具有高强度、高韧性、防水性以及极强黏附性等特点,可以使其黏附在几乎所有基底材料上。大量研究表明,3,4-二羟基-L-苯基丙氨酸(多巴,DOPA)是海洋贻贝类生物分泌的相关黏附蛋白中的重要组成部分,而且贻贝黏附蛋白所具有的这种超强黏附能力,主要与多巴中特有的分子结构以及其与基底材料的相互作用方式等相关。多巴胺、儿茶酚等多巴衍生物具有与多巴相似的结构和性质,同样可以实现对基材表面的黏附,因而引起了研究人员的极大关注,于此同时除多巴之外粘蛋白产生粘性的结构基础除了多巴之外还有一个保守序列即丰富的赖氨酸序列,这也是确保贻贝黏附蛋白所具有的高强度、高韧性、防水性以及特殊的黏附性能,是目前其它黏合剂所无法比拟的。目前,通过模仿黏附蛋白分子结构和性能,开发和应用新型功能材料,是仿生材料领域研究的热点之一。
目前基于海洋生物贻贝的研究主要包括两种途径,其一是单纯利用多巴胺通过控制条件使其形成聚多巴胺用于金属材料、无机材料的表面涂层,改性后材料表面的惰性得以克服同时提高了材料的生物相容性和细胞的黏附性能,改善了材料的生物活性,其二是通过化学接枝将多巴胺及其衍生物接枝到其他高分子材料上进而赋予相似的生物粘性,国内专利《生物粘合剂及其制备方法》(申请号201410852796.3)中提供了一种通过3步改性的方式制备生物粘合剂的方法,文中采用传统的羧基活化剂碳化二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),,虽然生物粘合剂的粘合性能可以得以提高,但反应过程中会引入醛基、有机溶剂等,同时EDC结合NHS的活化方式对反应体系的pH值依赖性较高,导致制备工艺繁琐、生物相容性差等诸多问题出现。
此本发明的目的是提供一种仿生型生物组织粘合剂的制备方法,发明中采用生物仿生和结构仿生两种方式对透明质酸钠、几丁糖等天然高分子进行了化学改性,首先采用新型的羧基活化剂4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐 (DMTMM)在高分子链上接枝多巴胺或其它含有儿茶酚基团的衍生物,以提高高分子材料的生物粘性,然后在反应体系中添加赖氨酸或聚赖氨酸以提高含儿茶酚基团改性材料的赖氨酸含量,最终达到结构仿生贻贝粘蛋白的目的,进而提高材料的组织粘合性。
技术实现要素:
本发明提供了一种仿生型的生物组织粘合剂的制备方法,旨在改善目前传统工艺制备贻贝粘蛋白仿生型生物组织粘合剂工艺中存在的不足,提高材料的粘性、改善材料的生物相容性以及材料的结构仿生。采用新型的羧基活化剂4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐(DMTMM),通过酰胺化反应将多巴胺或其它含有儿茶酚基团的衍生物接枝到如羧甲基几丁糖、海藻酸钠、透明质酸钠、肝素钠等天然高分子多糖上,得到含有邻苯羟基的天然高分子衍生物,随后采用相同的方法选用赖氨酸或聚赖氨酸等物质进行进一步的改性,最终得到同时含有多巴类似物和多赖氨酸类似物以达到生物和结构仿生的新型组织粘合剂。具体的制备包括如下步骤:
(1)结构仿生型天然高分子的制备:
0.01%~10%(w/v)天然高分子水溶液中加入含有儿茶酚基团的小分子化合物和羧基活化剂4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐(DMTMM)(天然高分子单元与含有儿茶酚基团的小分子化合物的摩尔比为1/10~10/1,天然高分子单元与DMTMM的摩尔比1/10~100/1)。搅拌均匀后,置于4~50℃环境下反应一段时间。再加入一定比例的赖氨酸或聚赖氨酸(天然高分子单元与赖氨酸或聚赖氨酸分子单元的摩尔比为1/10~100/1),于相同环境下反应一段时间即得。经透析、冷冻干燥处理后,即得到不同接枝率的结构仿生型天然高分子材料,高温高压灭菌后再配制成不同浓度的结构仿生型天然高分子溶液。
(2)结构仿生型天然高分子溶液的氧化:
取0.1~10%(w/v)高碘酸钠溶液与0.1~10%(w/v)结构仿生型天然高分子溶液混合成凝胶。
本发明的优点:
1.制备工艺简单,所用的羧基活化剂反应条件温和,羧基活化效率高,且无需对pH进行过程控制,适于企业放大生产;
2.产品纯化工艺简单,无任何有机溶剂的使用;
3.产品为结构仿生型天然高分子材料,其粘附性能良好,可在湿态环境中充分发挥粘附作用,适于临床应用;
附图说明
图1贻贝粘附蛋白结构组成
图2结构仿生型天然高分子材料结构示意图
图3弹性模量曲线
图4搭接-剪切拉伸承载强度
图5搭接-剪切拉伸承载强度实验的装置图
图6拉伸强度曲线
图7拉伸强度实验的装置图
具体实施方式
现结合实施例,以透明质酸钠和多巴胺盐酸盐为例,对本发明作详细描述,但本发明的实施不仅限于此。
实施例一
将0.5g透明质酸钠干粉(分子量2,000,000DA)溶解于25mL水中,并调节pH值至5,再加入0.25g多巴胺盐酸盐和0.5g DMTMM,充氮气去氧且避光条件下搅拌反应24h。称取聚赖氨酸0.034g,DMTMM0.0986g加入到上述混合体系中,充氮气去氧且避光条件下反应6h。用pH=5的PBS缓冲液透析2天(截留分子量10000),再用pH=7.2的PBS缓冲液透析2天(截留分子量10000),冷冻干燥,得样品A,待用。
将0.1g样品A溶于5mL PBS溶液中,溶解完全后,加入50uL 3%的高碘酸钠溶液,快速混合,于室温下得生物粘合剂。
实施例二
将0.5g透明质酸钠干粉(分子量310,000DA)溶解于25mL水中,并调节pH值至5,再加入0.5g多巴胺盐酸盐和0.5g DMTMM,充氮气去氧且避光条件下搅拌反应48h。称取聚赖氨酸0.034g,DMTMM0.0986g加入到上述混合体系中,充氮气去氧且避光条件下反应6h。用pH=5的PBS缓冲液透析2天(截留分子量10000),再用pH=7.2的PBS缓冲液透析2天(截留分子量10000), 冷冻干燥得样品A,待用。
将0.1g样品A溶于1mL PBS溶液中,溶解完全后,加入60uL5%的高碘酸钠溶液,快速混合,于室温下得生物粘合剂。
实施例三
将0.6g透明质酸钠干粉(分子量710,000DA)溶解于25mL水中,并调节pH值至5,再加入0.5g多巴胺盐酸盐和1g DMTMM,充氮气去氧且避光条件下搅拌反应24h。称取聚赖氨酸0.034g,DMTMM0.0986g加入到上述混合体系中,充氮气去氧且避光条件下反应6h。用pH=5的PBS缓冲液透析2天(截留分子量10000),再用pH=7.2的PBS缓冲液透析2天(截留分子量10000),冷冻干燥得样品A,待用。
将0.1g样品A溶于2.5mL PBS溶液中,溶解完全后,加入80uL 3%的高碘酸钠溶液,快速混合,于室温下得生物粘合剂。
实施例四
将0.4g透明质酸钠干粉(分子量950,000DA)溶解于25mL水中,并调节pH值至5,再加入0.5g多巴胺盐酸盐和1g DMTMM,充氮气去氧且避光条件下搅拌反应16h。称取聚赖氨酸0.034g,DMTMM0.0986g加入到上述混合体系中,充氮气去氧且避光条件下反应6h。用pH=5的PBS缓冲液透析3天(截留分子量10000),再用pH=7.2的PBS缓冲液透析3天(截留分子量10000),冷冻干燥得样品A,待用。
将0.1g样品A溶于2.5mL PBS溶液中,溶解完全后,加入50uL 3%的高碘酸钠溶液,快速混合,于室温下得生物粘合剂。
实施例五
用巴胺盐酸盐配制浓度从0.1mg/mL到0.001mg/mL的溶液,共5个点,分别是0.1mg/mL、0.05mg/mL、0.01mg/mL、0.005mg/mL和0.001mg/mL,并用紫外分光光度计在波长λ=280nm处分别测其吸光度,绘制标准曲线。
秤取实施例一中所制备的白色絮状固体样品A(儿茶酚化透明质酸钠)10mg,溶于5mL水中,溶解完全后,用紫外分光光度计测其在波长λ=280nm处的吸光度,根据标准曲线计算而得,制备样品中的儿茶酚基含量为8.55%。(同样条件下,若用羧基活化剂碳化二亚胺和N-羟基琥珀酰亚胺,所得制备样品中的儿 茶酚基含量仅为3.26%。)
实施例六
将实施例二得到0.1g样品A溶于1mL PBS溶液中,溶解完全后,加入60uL 5%的高碘酸钠溶液,并快速混合两者溶液,于旋转流变仪下检测其储存模量G’,损耗模量G”随时间变化曲线,如图3所示。
实施例七
秤取实施例三中所制备的白色絮状固体样品A(儿茶酚化透明质酸钠)0.1g,溶于2.5mLPBS中,溶解完全后,根据组织粘合剂粘结性能试验方法第1部分:搭接-剪切拉伸承载强度(YY/T 0729.1)进行测试,该生物粘合剂在湿态下的搭接-剪切拉伸承载强度曲线如图4所示,图5为搭接-剪切拉伸承载强度实验的装置图。
实施例八
秤取实施例四中所制备的白色絮状固体样品A(儿茶酚化透明质酸钠)0.1g,溶于2.5mLPBS中,溶解完全后,根据组织粘合剂粘结性能试验方法第3部分:拉伸强度(YY/T 0729.3)进行测试,该生物粘合剂在湿态下的拉伸强度曲线如图6所示,图7为拉伸强度实验的装置图。
- 还没有人留言评论。精彩留言会获得点赞!