氯化两面针碱在制备抗骨质疏松和骨丢失疾病中的应用的利记博彩app
本发明涉及药物,具体涉及制备新适应证的药物,尤其涉及氯化两面针碱(Nitidine Chloride)在制备抗骨质疏松症和骨丢失药物中的应用。。
背景技术:
骨质疏松症是多种原因引起的一组骨病,骨组织有正常的钙化,钙盐与基质呈正常比例,以单位体积内骨组织量减少为特点的代谢性骨病变。在多数骨质疏松中,骨组织的减少主要由于骨质吸收增多所致。以骨骼疼痛、易于骨折为特征。
破骨细胞(osteoclast)是骨组织成分的一种,行使骨吸收的功能。破骨细胞起源于骨髓造血干细胞/单核细胞系统,是一种高度分化的多核细胞,其分化主要依赖于 RANKL 的刺激。 RANKL 属于肿瘤坏死因子超家族成员,由成骨细胞,软骨细胞与骨细胞分泌而来。在骨微环境中,RANKL 与前破骨细胞表面受体 RANK 结合,募集 RANK 信号传导的转接蛋白 TRAF6,启动下游信号通路包括 NF-κB,MAPK,NFAT,AKT 以及钙离子通道,促进破骨细胞分化成熟。其中 NF-κB 是破骨细胞分化成熟的关键信号,而 NFAT 介导细胞融合和破骨细胞分化,是破骨细胞终端分化的转录因子。同时,RANKL 还需要免疫受体酪氨酸活化基序(ITAM)介导的信号通路(其中包括破骨细胞相关受体(OSCAR),髓样细胞触发受体-2(TREM2),Fc受体共同γ链(FcRγ),以及DNAX活化蛋白12(DAP12)),来共同激活 NFAT,致使破骨细胞分化,发挥细胞功能。
当前,治疗骨丢失疾病的方法多采用以下几种:一、骨吸收抑制剂治疗,例如双磷酸盐;二、激素替代疗法。但是,研究发现应用激素替代疗法,女性患乳腺癌的风险增大,并且抑制骨吸收的磷酸盐制剂也在临床应用中出现了较大的不良反应,这极大限制了临床推广。因此,寻找可以防治骨丢失疾病的药物一直是人们梦寐以求的愿望。近几年,中草药的治疗骨丢失疾病的研究逐渐开展起来。由于中草药治疗效果明显且安全性较好,目前,已经发现部分中草药单体具有抑制破骨细胞的作用,例如芒果苷,柚皮苷等。两面针为芸香科植物两面针 Zanthorμlum nitidum(Roxb.)DC. 的干燥根,性味苦、辛,具有跌打损伤、活血化瘀等功效,是广西特有中草药。氯化两面针碱是两面针主要活性成分之一。既往的研究主要集中在抗肿瘤以及抗炎的治疗。目前对破骨细胞形成的作用尚未有报道。
申请人研究氯化两面针碱对骨质疏松症的调控作用,通过TARcP 染色发现氯化两面针碱呈剂量依赖性抑制 RANKL 诱导的破骨细胞形成与骨吸收作用; 同时还发现 1 µM 氯化两面针碱也能够干预人外周血单个核细胞体外诱导破骨细胞成熟分化。从作用机制上显示,氯化两面针碱是通过抑制 RANKL 激活的 NF-κB 与 NFATc1 信号通路来发挥作用,并下调了破骨细胞成熟分化标志基因(cathepsin K, D2, calcitonin receptor, NFATc1, TRAcP, OSCAR, FcRγ, TREM2, DAP12)的表达。再通过建立去卵巢小鼠的骨质疏松症模型表明氯化两面针碱可以保护卵巢切除导致的骨丢失。从 HE 染色及组织病理学结果分析,与去卵巢小鼠组相比,氯化两面针碱治疗组明显降低了骨组织中破骨细胞的数量。
基于上述药理作用,可拟开发氯化两面针碱为制备治疗骨质疏松症和骨丢失的药物。
技术实现要素:
本发明所要解决的技术问题在于研究氯化两面针碱对破骨细胞的调控作用,设计在抗骨质疏松症药物中的应用。
本发明提供了氯化两面针碱在制备康骨质疏松症药物中的应用。
申请人首次研究发现氯化两面针碱剂量依赖性抑制破骨细胞形成和骨吸收功能;发现氯化两面针碱通过干预 RANKL 激活的 NF-κB 和 NFAT 信号通路发挥其抑制破骨细胞的作用。为了进一步证明氯化两面针碱对破骨细胞的作用,建立了小鼠去卵巢骨质疏松模型。结果表明,氯化两面针碱给药组能够防治去卵巢诱发的骨丢失。综上所述,氯化两面针碱通过下调 RANKL 激活的 NF-κB 和 NFAT 来干预破骨细胞分化功能。
附图说明
图1两面针碱对 RANKL 诱导的破骨细胞形成以及破骨细胞增殖、凋亡的影响
(A:两面针碱化学结构。B: BMMs 在含有 100 ng/mL 的 M-CSF,100 ng/mL 的RANKL 以及不同浓度的两面针碱的细胞分化液中培养 5 天,然后进行 TRAcP 染色。光学显微镜下观察两面针碱呈剂量依赖性的抑制 RANKL 诱导的破骨细胞形成。 C: 对 TRAcP 染色阳性多核细胞进行计数,对于细胞核 ≥3 归为破骨细胞;
D:利用 Annexin V 凋亡试剂盒检测不同浓度两面针碱对破骨细胞的细胞凋亡的影响;E:利用 MTS 考察两面针碱对 BMMs 孵育 48 小时后,药物对细胞增殖的影响。*p<0.05, **p<0.005 , ***p<0.001)
图2两面针碱对 RANKL 诱导破骨细胞分泌的特异性基因的影响
(BMMs 在含有 100 ng/mL 的 M-CSF,100 ng/mL 的RANKL 以及不同浓度的两面针碱(0,0.125,0.25,0.5 以及 1 µM)的细胞分化液中培养 7 天。利用 RT-PCR 检测相关基因的 mRNA 表达水平。结果用 Image J 分析各条带的灰度值,计算目的基因灰度值与 GAPDH 灰度值的比值,即为各自 mRNA 的相对表达水平,分析各组之间的差异)
图3两面针碱对骨吸收功能的影响
(经 RANKL 诱导 BMMs 分化后的破骨样细胞,按照相同的数目接种于骨板上,并加入含有 RANKL 以及不同浓度的两面针碱的完全培养基进行孵育 48 h; 对照组只含有 RANKL 的完全培养基。A: 通过 SEM 观察各组的骨吸收面积(黑色箭头标示)B:对骨吸收面积进行定量分析。*p<0.05, **p<0.005 , ***p<0.001)
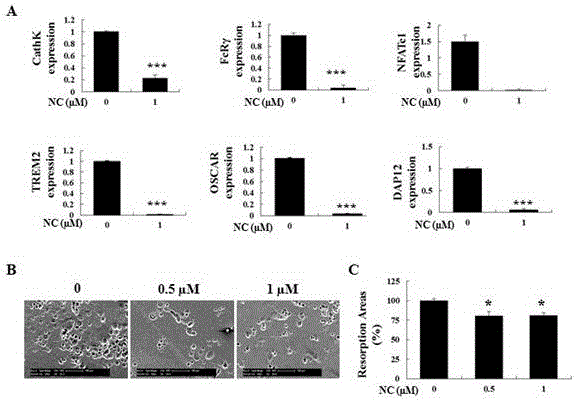
图4两面针碱对 RANKL 诱导的人外周血提取单核细胞相关基因的表达以及骨吸收功能作用
(A: 通过定量 PCR 比较,与只含有 RANKL 的完全培养基处理的阳性对照组比较, 1 µM 两面针碱药物处理组对 RANKL 诱导的人外周血提取单核细胞相关基因表达情况的影响 ;每个目的基因与相应的 GAPDH,进行比较循环阈值对目的基因进行计算;B:RANKL 诱导的人外周血提取单核细胞分化后的破骨样细胞,按照相同的数目种于骨板上,并加入含有 RANKL 以及不同浓度的两面针碱进行孵育 48 h;对照组只含有 RANKL 的完全培养基。通过 SEM 观察各组的骨吸收面积;C:对骨吸收面积进行定量分析。*p<0.05, **p<0.005 , ***p<0.001)
图5两面针对 RANKL 引起的 IκBα 降解的影响
(采用稳定转染 3κB-Luc-SV40 荧光素酶报告基因的 Raw 264.7,检测硫酸小檗碱对 RANKL 活化 NF-κB 的影响。A: RAW 264.7 细胞分为3组, 阴性对照组含有完全培养基; 阳性对照组含有 100 ng/mL RANKL 完全培养基; 给药组含有 100 ng/mL RANKL 与不同浓度的两面针碱(0.5uM 和 1uM)的完全培养基。将各组数据进行比较,分析各组中各组中NF-κB 蛋白的表达情况。B:两面针碱对BMMs进行预孵育 1h,然后按照时间点加入100ng/ml的RANKL 进行刺激。将 β-actin 最为内参,Western-blot 定量分析 IκBα 的表达。*p<0.05, **p<0.005 , ***p<0.001)
图6两面针碱对 RANKL 活化的 NFATc1 的作用
(采用稳定转染 pNFATc1-TA-Luc 荧光素酶报告基因的 Raw 264.7,检测硫酸小檗碱对 RANKL 活化 NFATc 的影响。A:RAW 264.7 细胞分为3组,阴性对照组-含有完全培养基;阳性对照组-含有 100 ng/ml 的RANKL的完全培养基; 给药组-含有 100ng/ml 的RANKL和不同浓度的两面针碱(0.5uM 和 1uM)的完全培养基。将各组数据进行比较,分析各组中 NFATc 蛋白的表达情况。 B:BMMs 在含有 100 ng/mL RANKL 与不同浓度的两面针碱的完全培养基孵育 7 天;将 β-actin 最为内参,Western-blot 定量分析 NFATc1 与 d2 的表达。C:BMMs 预孵育两面针碱(1uM) 1 h 后,按照时间点加入 100 ng/mL RANKL 与两面针碱共孵育。将 β-actin 最为内参,Western-blot 定量分析 NFATc1 与 d2 的表达。*p<0.05, **p<0.005 , ***p<0.001)
图7两面针碱对去卵巢小鼠骨质疏松(OVX)引起的骨丢失的影响
(A:通过 Micro-CT 扫描形态测定分析小鼠胫骨近端干骺端骨小梁微结构的分析。 B: 胫骨标本分为 sham 组-假手术组,给药组(两面针碱 3 mg/kg 以及 6 mg/kg 腹腔注射 OVX 模型小鼠)以及雌激素组(50 ng/kg 腹腔注射 OVX 模型小鼠)。通过各组数据进行比较,分析各组小鼠骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁间距(Tb.Sp)、骨小梁厚度(Tb/Th);实验数据用均数±标准差表示;C:利用 HE 和 TRAcP 染色对骨小梁进行骨组织病理学检测,分析各组骨小梁中骨吸收参数,例如破骨细胞表面积(OcS/BS), 破骨细胞数量 N.Oc/BS(n=3)。*p<0.05, **p<0.005 , ***p<0.001)。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围,若未特别说明,所用的技术手段为本领域技术人员所熟知的技术手段。
实施例1
一、材料与方法
试剂
氯化两面针碱购自中国药品生物制品检定所(北京,中国)。RAW 264.7购自American Type Culture Collection(马里兰州,美国)。鼠源 MCSF 购自 R&D Systems (明尼阿波利斯,美国)。ɑ-MEM 购自 Thermo Fisher,胎牛血清(FBS)购自 TRACE (悉尼,澳大利亚)。重组 GST-rRANKL为本实验室纯化。人外周血单个核细胞诱导所需重组人源 M-CSF 购自 Chemicon (加尼福利亚洲,美国),胎牛血清,青链霉素和 L-谷氨酰胺购自 Invitrogen (加尼福利亚洲,美国)。 IκBα 和 NFATc1 抗体购自 Santa Cruz Biotechnology Com. (加尼福利亚洲,美国)。 V-ATPase d2 抗体来自本实验室合成纯化。
体外骨髓巨噬细胞的分离、培养和诱导分化
骨髓巨噬细胞由C57BL/6J小鼠的骨髓中分离获取。实验方法已经获得西澳大学动物伦理委员会批准 (approval RA/3/100/1244)。骨髓巨噬细胞用含10% 胎牛血清,5 μg/mL青霉素,50 U/mL链霉素,2 mM L-谷氨酰胺以及10 ng/mL MCSF 的 ɑ-MEM 完全培养基,于 37℃ 含 5% CO2 培养箱孵育。
细胞长满后,将BMMs(8×103)接种于96孔板,分为阴性对照组,阳性对照组,给药组。其中阴性对照组不加 RANKL, 阳性对照组只加RANKL,给药组加 RANKL 以及含不同浓度的氯化两面针碱。每 2 天换液 1 次。7 天后,4% 的多聚甲醛固定细胞 20 分钟,加入 TRAcP 染色液进行染色 1小时。光学显微镜下观察 TRAcP 染色阳性多核细胞中细胞核 ≥3 个的细胞定义为破骨细胞,并进行计数。
)体外人外周血单个核细胞分离、培养和诱导分化
从澳大利亚红十字会(阿德莱德,南澳大利亚)健康志愿者中采血。用预热的HANK平衡液冲洗全血中的白膜层,并从聚蔗糖柱分理出人外周血单核细胞。实验方法已经获得西澳大学动物伦理委员会批准。用含有10% 胎牛血清,5 μg/mL青霉素,50 U/mL链霉素,2mM L-谷氨酰胺以及25 ng/mL MCSF 的 ɑ-MEM 完全培养液进行培养。并将细胞接种于12孔板用于mRNA检测,以及含有骨板的 96 孔板用于骨吸收功能的检测。次日,加入RANKL刺激分化并加入不同浓度的氯化两面针碱。对照组加入 0.01% DMSO 进行培养。细胞孵育 7 天,每隔 2 天换 1 次液。
法测定氯化两面针碱对破骨细胞前体增殖的影响
BMMs(6×103)接种于96孔板中培养过夜。更换培养基(含有不同浓度的氯化两面针碱0.1,0.5,1, 5, 10 μM)孵育48小时。然后每孔加入 MTS 孵育2小时,最后进行酶标仪检测。
双染检测凋亡
选用生长状态良好的RAW 264.7细胞(1×106)接种于6孔板中培养过夜。更换培养基(含有不同浓度的氯化两面针碱)进行孵育24小时后,用胰酶消化,收集细胞,用 PBS 冲洗1次,将细胞用 1× Binding缓冲液重悬(1×107 /mL),加入Annexin V-PI液染色。流式细胞仪进行分析,计算凋亡细胞的百分率。
反转录-聚合酶链反应
BMMs(1×105)接种于 6 孔板中培养过夜。更换培养基(含有不同浓度的氯化两面针碱 0.5 和 1 μM)孵育 7 天。用 Trizol 裂解细胞并提取总 RNA。用含有oligo-dT 引物的反转录酶对 RNA 逆转录成 cDNA。然后加入不同基因的引物对 cDNA 进行聚合酶链反应扩增。18sRNA 作为内参。以下是不同基因引物序列:
18sRNA(Forward:ACCATAAACGATGCCGACT;Reverse:TGTCAATCCTGTCCGTGTC),
Calcitonin Receptor(Forward:TGGTTGAGGTTGTGCCCA;Reverse:CTCGTGGGTTTGCCTCATC),
cathepsin K (Forward:GGGAGAAAAACCTGAAGC;Reverse:ATTCTGGGGACTCAGAGC),
V-ATPase d2 (D2) (Forward:GGATCCGAATTCATGCTTGAGACTGCAGAG;Reverse:GGTCTAGATTATAAAATTGGAATGTAGCTC),
NFATc1 (mouse NFATc1) (Forward:CAACGCCCTGACCACCGATAG; Reverse:GGCTGCCTTCCGTCTCATAGT),
TRAcP (Forward:TGTGGCCATCTTTATGCT;Reverse:GTCATTTCTTTGGGGCTT)。
荧光定量PCR
将人外周血单个核细胞种于 12 孔板中并诱导分化 7 天后,Trizol 裂解细胞提取总 RNA。含有 oligo-dT 引物的反转录酶对 RNA 逆转录成 cDNA。将 cDNA 用 SYBR GREEN qPCR SuperMix-UDG 试剂在 Rotor-Gene 3000 扩增出目的基因 hARP,cathepsin K,NFATc1,OSCAR,FcRγ,TREM2,DAP12。所有样本设三个副孔。扩增完成后,通过 Rotor-Gene Series 1.7 软件按照 ddCT 法对目的基因变化进行相对变量。
荧光素酶报告基因
通过 2-二乙氨乙基葡聚糖将 pNFATc1-TA-Luc 稳定转染 RAW 264.7。转染的 RAW 264.7 细胞接种于 24 孔板过夜后,预孵育氯化两面针碱 1 小时,加入100ng/mL RANKL刺激24小时。加入荧光素酶裂解缓冲液,移至白板,加入荧光素酶报告基因底物,荧光酶标仪检测。
κB荧光素酶报告基因
通过 2-二乙氨乙基葡聚糖将 3κB-Luc-SV40 稳定转染 RAW264.7。转染的RAW 264.7 细胞接种于 24 孔板过夜后,预孵育氯化两面针碱 1 小时,加入100ng/mL RANKL刺激8小时。加入荧光素酶裂解缓冲液,移至白板,加入荧光素酶报告基因底物,荧光酶标仪检测。
骨吸收检测
将 BMMs 接种于 6 孔板内,每孔加入含有 100ng/mL RANKL 和 10ng/mL mMCSF的完全培养基孵育3天。当破骨细胞形成,加入胰酶将细胞分离出来,并按照 1×103/well浓度种有 0.75mm 厚度骨板的96孔板内孵育过夜。加入氯化两面针碱孵育48小时。其中一部分骨片用 4% 多聚甲醛固定,加入 TRAcP 染色液进行染色 1小时。光学显微镜下观察 TRAcP 染色阳性多核细胞中细胞核 ≥3 个的细胞定义为破骨细胞,并进行计数。同时清洗另一部分骨片,晾干后,用 Philips XL30 扫描电镜检测骨吸收陷窝,并用Scion Image software计算骨吸收面积百分比。
牙本质片吸收陷窝形成的检测
人外周血单个核细胞接种在置有牙本质片的96孔板内,加入 RANKL 刺激10天。加入胰酶消化细胞,并清洗牙本质片。晾干后,用扫描电镜在150倍下检测牙本质骨吸收陷窝,分别取三处,每处各照1张。用 Image J 计算骨吸收面积。
蛋白免疫印迹法
将 BMMs 接种于 6 孔板内过夜。对于短效蛋白(iκB -ɑ),加入氯化两面针碱预孵育 1 小时,并加入 RANKL 按照0,10,20,30,60,120 分钟时间点刺激;对于长效蛋白(NFATc1,D2),加入氯化两面针碱与RANKL按照0,4,24,72,120,168 小时刺激。在检测时间点后加入细胞裂解液,收集蛋白。
随后配置 SDS-PAGE 凝胶,蛋白上样,转膜。用 5% 脱脂奶粉室温封闭 1 小时后,TBST 洗膜,接下来分别孵育 iκB -ɑ 和 NFATc1,D2 抗体,最后 ECL 发光显影。
构建去卵巢小鼠骨质疏松症模型
C57BL/6J 小鼠实验获得西澳大学伦理委员会与广西医科大学伦理委员会批准(SCXK - (JUN) 2012-0004,Beijing, China)。 30 只 6-8 周龄的雌性小鼠随机分为 5 组(即假手术组,对照组,药物低剂量组,药物高剂量组,雌激素组),每组各6只。除假手术组,每只老鼠腹腔注射 10% 水合氯醛后,双侧卵巢被摘除。术后恢复一周后,隔天给药。根据体重和分组,进行腹腔注射。假手术组合对照组注射 1% DMSO,药物低剂量组和高剂量组分别注射氯化两面针碱(3mg/kg和 6mg/kg),雌激素组注射雌激素(50ng/kg)。给药 6 周后,处死小鼠,并取其胫骨。胫骨用 4%多聚甲醛固定 24 小时后,用micro-CT扫描检测。
分析
用 1×PBS 洗小鼠胫骨三次,装入试管内扫描。应用 Bruker 1176 micro-CT 进行扫描,扫描条件为 50 KV-550 µA,0.5mm 铝制滤波器,空间分辨率为 9 µM。用 NRecron 对数据进行重建 CT 图;CTAn 分析软件对样品校准霍式值和密度。重用 CTAn 软件(Bruker 公司)建后的样本进行分析。以下是参数分析的方法:骨小梁和骨皮质的研究区是基于从生长板的底端来划定。骨小梁的研究区是从生长板底端往下 0.5 毫米到 1.5 毫米区域。具有代表性的骨小梁研究区被通过画曲线的方式从外围的皮质骨中勾画出来。骨小梁研究区通过恒定阈值被二元化,从而通过 CTAn 软件进行量化分析。
骨组织形态学分析
用 4% 多聚甲醛固定胫骨 24 小时,1×PBS 冲洗 3 次。加入 14% EDTA 脱钙 7 天。用石蜡包埋样本,HE 染色或者 TRAcP 染色。通过 BIOQUANT OSTEO 软件进行定量分析,获取 OcS/BS 和 N.Oc/BS 等数据
统计学处理
所有实验数据均重复 3 次。对于人外周血单个核细胞向破骨细胞分化过程中骨吸收功能实验,结果按照均数±标准误(x± SE)表示。通过 Excel 2003 软件对各参数结果值进行处理分析,结果用均数±标准差(x± SEM)表示;假设检验设 P<0.05 具有统计学意义。
二、实验结果
1)氯化两面针碱对破骨细胞形成及前破骨细胞增殖、细胞凋亡的影响
选用来源于野生型小鼠的长骨骨髓中分离获取的 BMMs 作为前破骨细胞,通过 RANKL(100ng/mL)和 M-CSF(10ng/mL)刺激诱导分化破骨细胞形成。RANKL(+) 为阳性对照组,RANKL(-)为空白组,其余加入不同浓度的氯化两面针碱的进行培养(见图 1-A)。通过 TRAcP 染色观察,空白组无明显破骨细胞形成,阳性对照组可见形态巨大、多核的破骨细胞。然而,氯化两面针碱加入诱导体系中,随着其浓度升高,对破骨细胞分化的抑制增强(见图 1-B)。与阳性对照组相比,尤其在0.125 µM 到1 µM的氯化两面针碱的作用下, 破骨细胞数显著降低(见图 1-C)。当药物作用浓度超过 0.5 µM 时,几乎完全没有破骨细胞的形成。结果表明,氯化两面针碱能够抑制 RANKL 诱导的破骨细胞形成,且具有浓度依赖性。
为了证明氯化两面针碱对破骨细胞形成的抑制作用不是通过对其凋亡而实现的,采用 Annexin V-FITC/PI 双染色法,测定了不同浓度的氯化两面针碱对前破骨细胞 RAW264.7 细胞凋亡的影响。结果显示,不同浓度的氯化两面针碱均没有引起细胞的凋亡(见图 1-D)。同时,采用 MTS 检测氯化两面针碱对前破骨细胞 BMMs 的增殖情况。结果显示氯化两面针碱作用浓度不超过 5 µM 时,对细胞的存活率没有影响(见图 1-E)。
2)氯化两面针碱对RANKL诱导的破骨细胞分化相关基因表达的影响
采用 Real-Time PCR 检测不同浓度氯化两面针碱对 RANKL 诱导的BMMs 向破骨细胞分化 7 天后,相关基因 calcitonin receptor,cathepsin K,TRAcP,NFATc1,D2 表达。结果显示,氯化两面针碱能够剂量依赖性的下调calcitonin receptor,cathepsin K,TRAcP,NFATc1,D2 mRNA 的表达(见图 2)。结果在分子水平上证明了氯化两面针碱对破骨细胞分化的抑制。
3)氯化两面针碱对破骨细胞骨吸收功能的影响
破骨细胞是体内唯一具有骨吸收活性的细胞,频繁过度的骨吸收活动是导致骨溶解疾病的根本原因。申请人将破骨样细胞接种于骨板内,观察氯化两面针碱(0.5µM 和 1µM )对成熟破骨细胞骨吸收功能的影响。通过 TRAcP 染色观察,与对照组相比,药物没有抑制已成熟破骨细胞的数量(见图 3-A,B);然后观察骨板,对照组可见大面积骨吸收陷窝;但是 1µM 氯化两面针碱组可见少量骨吸收陷窝,且面积显著减少(见图 3-A,C)。结果表明氯化两面针碱能够抑制破骨细胞骨吸收功能。
4)氯化两面针碱对诱导人外周血单个核细胞向破骨细胞分化相关基因的表达以及牙本质骨吸收功能的影响
选用人外周血单个核细胞作为破骨细胞前体,通过 hMCSF 与 hRANKL 共同诱导向破骨细胞分化。同时加入 1 µM 氯化两面针碱进行孵育,考察其对人源破骨细胞的形成是否与鼠源破骨细胞形成的作用一致。 通过 TRAcP 染色发现,氯化两面针碱显著抑制成熟破骨细胞的标志物,cathepsin K,NFATc1,OSCAR, FcRγ, TREM2,DAP12 的基因表达(见图 4-A)。
另外申请人还考察了氯化两面针碱对人外周血单个核细胞向破骨细胞分化过程中骨吸收功能的影响。结果显示,与对照组相比较,氯化两面针碱(0.5 µM 和 1 µM)能够显著减少骨吸收陷窝面积。这与前文中发现氯化两面针碱抑制鼠源破骨细胞活性结果一致(见图 4-B,C)。
5)氯化两面针碱对 RANKL 诱导的 NF-κB 活化的影响以及相关蛋白表达的调控
为了进一步探讨氯化两面针碱影响 RANKL 诱导破骨细胞分化的机制,申请人采用稳定转染 3kB-Luc-SV40 荧光素酶报告基因的 Raw 264.7,检测氯化两面针碱对 RANKL 活化 NF-κB 的影响。结果显示,100 ng/mL RANKL 能够在 8 小时提高 NF-κB 的表达,提示 RANKL 能够在体系中刺激 NF-κB 活化。并且发现当加入一系列浓度梯度的氯化两面针碱时,能够显著降低 RANKL 诱导的 NF-κB 报告基因的表达,并且是随着药物浓度升高,抑制效果越明显(见图 5-A)。提示氯化两面针碱有可能通过调控 NF-κB 的信号通路来影响破骨细胞的发生发展过程。
为了进一步阐明氯化两面针碱对 NF-κB 信号通路作用,我们通过 Western-blot 检测 NF-κB 活化的抑制因子 iκB -ɑ的蛋白表达情况。结果显示,RANKL 诱导对照组能够降低iκB -ɑ的蛋白表达,释放 NF-κB 发挥作用。但是,氯化两面针碱对 RANKL 刺激导致的 iκB -ɑ 蛋白降解没有影响(见图 5-B),提示氯化两面针碱可能通过调控 iκB -ɑ 下游蛋白实现抑制 NF-κB 的信号通路。
6)氯化两面针碱对 RANKL 诱导的 NFATc1 活化的影响以及相关蛋白表达的调控
NFATc1 目前被认为是破骨细胞关键的转录因子,能够调节破骨细胞的分化,影响 calcitonin receptor,cathepsin K,TRAcP 等基因的表达。通过上述研究可知,氯化两面针碱能够下调上述基因 mRNA 的表达。因此,申请人通过荧光素酶报告基因与 Western-blot 考察了氯化两面针碱对 RANKL 刺激 NFATc1 活化的影响。荧光素酶报告基因结果显示,100 ng/mL RANKL 能够在 24 小时显著提高稳定转染了 pNFATc1-TA-Luc 的 Raw264.7 中 NFATc1 的表达,提示 RANKL 能够在这个体系中活化 NFATc1。当加入一系列浓度梯度的氯化两面针碱时,显著抑制了 RANKL 诱导的 NFATc1 报告基因表达的上升(见图 6-A)。
Western-blot 结果发现,RANKL 诱导的 NFATc1,D2 蛋白水平显著提高,加入氯化两面针碱干预后,呈剂量依赖性降低 NFATc1 和 D2 的表达(见图 6-B)。尤其在 1 µM 氯化两面针碱干预下,不同时间点的 NFATc1 和 D2 的表达均被抑制(见图 6-C)。提示氯化两面针碱通过抑制转录因子 NFATc1 的表达,继而调控其下游基因的表达,从而抑制破骨细胞的分化和功能。
7)氯化两面针碱保护去卵巢骨质疏松小鼠的骨丢失
申请人已经通过体外 RANKL 诱导的破骨细胞体系发现氯化两面针碱能够抑制破骨细胞的形成和骨吸收功能。为了进一步证实氯化两面针碱对破骨细胞的影响,申请人通过建立去卵巢小鼠骨质疏松症模型,考察氯化两面针碱对雌激素丢失引发过度骨吸收活动和破骨细胞的影响。通过 micro-CT 扫描检测发现,建立去卵巢小鼠模型组 6 周后,出现明显的骨丢失现象(见图 7-A),骨小梁分离度明显增加,骨体积分数、骨小梁厚度、以及骨小量数明显降低(见图 7-B)。从去卵巢小鼠骨头组织形态学中发现,破骨细胞表面积/骨表面积与破骨细胞数目均降低(见图 7-C)。而氯化两面针碱高、低浓度剂量给药组能够有效的防止去卵巢小鼠导致的骨丢失(见图 7-A),提升骨体积分数、骨小梁厚度、以及骨小量数,降低骨小梁分离度等骨静态参数(见图 7-B,C),其中高剂量给药组(6mg/kg)的治疗效果能够类同于雌激素给药组的功效(图 7)。
三、讨论
破骨细胞异常活跃的分化增殖和骨吸收功能容易引起骨丢失疾病,例如绝经性的骨质疏松症,变形性骨炎,自身免疫性关节炎,牙周炎。这一过程通常是由 RANKL过度表达所致。RANKL 对破骨细胞前体启动多种有关破骨细胞转录基因的胞内信号级联放大,从而实现破骨细胞的分化与成熟。因此,靶标 RANKL 诱发的信号通路是治疗骨丢失疾病的关注点。
通过体外实验发现,氯化两面针碱可以剂量依赖性抑制 RANKL 诱导的破骨细胞形成以及骨吸收功能作用。因此,详细阐明氯化两面针碱对破骨细胞的分子机制很有必要。破骨细胞前体向成熟的破骨细胞分化,需要多种细胞因子参与激活胞内信号通路。其中有两个条件最为重要:一、MCSF,它是维持破骨细胞生长;二、RANKL,它是促进破骨细胞分化、成熟。目前,RANKL 引发的一系列变化与骨溶解疾病的发生发展紧密联系。RANKL 联合 RANK 作用于前破骨细胞,募集形成 TRAF6 与 c-src 复合蛋白体,并活化 IKK 激酶。IKK 通过降解 iκB-ɑ 来释放 NF-κB 入核,与相应的 DNA 的启动子结合,介导转录。我们发现,利用 NF-κB 荧光素酶报告基因,氯化两面针碱剂量依赖性抑制 NF-κB 的表达。提示氯化两面针碱可以通过 RANKL 诱导的 NF-κB 通路来抑制破骨细胞的形成及功能。但从蛋白免疫印迹结果显示,氯化两面针碱不能干预 RANKL 引起的 iκB-ɑ 降解,这说明氯化两面针碱可能通过 iκB-ɑ 下游基因来抑制 NF-κB的活化。
RANKL 不仅能够激活 NF-κB,还能够通过 TRAF6 诱导活化转录因子 NFATc1 从而介导破骨细胞的成熟分化。通过 NFATc1 荧光素酶报告基因与蛋白免疫印迹发现,氯化两面针碱也能够抑制 NFATc1 的表达,从而影响破骨细胞的分化。并且下调了破骨细胞分化基因的表达;例如 cathepsin K,OSCAR,TREM2,FcRγ,DAP12 等。
为了进一步在体内证实氯化两面针碱对破骨细胞的影响,通过建立去卵巢骨质疏松症小鼠模型发现,氯化两面针碱能够保护去卵巢小鼠的骨丢失。与我们体外的研究结果一致。
综上所述,氯化两面针碱是未来防治破骨细胞引起的骨丢失疾病的一个理想药物。
- 还没有人留言评论。精彩留言会获得点赞!