硼中子捕获治疗系统的利记博彩app
本发明涉及一种放射性射线照射治疗系统,尤其是一种硼中子捕获治疗系统。
背景技术:
随着原子科学的发展,例如钴六十、直线加速器、电子射束等放射线治疗已成为癌症治疗的主要手段之一。然而传统光子或电子治疗受到放射线本身物理条件的限制,在杀死肿瘤细胞的同时,也会对射束途径上大量的正常组织造成伤害;另外由于肿瘤细胞对放射线敏感程度的不同,传统放射治疗对于较具抗辐射性的恶性肿瘤(如:多行性胶质母细胞瘤(glioblastomamultiforme)、黑色素细胞瘤(melanoma))的治疗成效往往不佳。
为了减少肿瘤周边正常组织的辐射伤害,化学治疗(chemotherapy)中的标靶治疗概念便被应用于放射线治疗中;而针对高抗辐射性的肿瘤细胞,目前也积极发展具有高相对生物效应(relativebiologicaleffectiveness,rbe)的辐射源,如质子治疗、重粒子治疗、中子捕获治疗等。其中,中子捕获治疗便是结合上述两种概念,如硼中子捕获治疗,借由含硼药物在肿瘤细胞的特异性集聚,配合精准的中子射束调控,提供比传统放射线更好的癌症治疗选择。
硼中子捕获治疗(boronneutroncapturetherapy,bnct)是利用含硼(10b)药物对热中子具有高捕获截面的特性,借由10b(n,α)7li中子捕获及核分裂反应产生4he和7li两个重荷电粒子。参照如下的10b(n,α)7li中子捕获核反应方程式。
两荷电粒子的平均能量约为2.33mev,具有高线性转移(linearenergytransfer,let)、短射程特征,α粒子的线性能量转移与射程分别为150kev/μm、8μm,而7li重荷粒子则为175kev/μm、5μm,两粒子的总射程约相当于一个细胞大小,因此对于生物体造成的辐射伤害能局限在细胞层级,当含硼药物选择性地聚集在肿瘤细胞中,搭配适当的中子射源,便能在不对正常组织造成太大伤害的前提下,达到局部杀死肿瘤细胞的目的。
因硼中子捕获治疗的成效取决于肿瘤细胞位置含硼药物浓度和热中子数量,故又被称为 二元放射线癌症治疗(binarycancertherapy);由此可知,含硼药物的开发及中子射源通量与品质的改善在硼中子捕获治疗的研究中均占有重要角色。
技术实现要素:
为了实现改善现有的硼中子捕获治疗系统,本发明的一方面提供了一种硼中子捕获治疗系统,其包括:硼中子捕获治疗装置以及类α-氨基酸三氟化硼化物。
所述类α-氨基酸三氟化硼化物具有如式(ⅰ)所示的结构:
其中:r为氢、甲基、异丙基、1-甲基丙基、2-甲基丙基、羟甲基、1-羟基乙基、苯甲基或羟基苯甲基;m为h或金属原子。
所述硼中子捕获治疗装置产生的中子束作用到所述类α-氨基酸三氟化硼化物后产生的能量破坏肿瘤细胞dna。
bnct是一种理想的肿瘤治疗方法,其为许多用传统方法无法治疗的肿瘤提供了一种新的治疗方法。
本发明所述的肿瘤为恶性肿瘤或转移性肿瘤进程,优选脑胶质瘤、复发性头颈部肿瘤、恶性黑色素瘤、乳腺癌或转移性肝癌瘤。恶性肿瘤就是人们常说的癌症,它是100多种相关疾病的统称。当身体内细胞发生突变后,它会不断地分裂,不受身体控制,最后形成癌症。恶性肿瘤的细胞能侵犯、破坏邻近的组织和器官,而且该细胞可从肿瘤中穿出,进入血液或淋巴系统,这就是恶性肿瘤如何从原发的部位到其它器官形成新的肿瘤,这个过程就叫恶性肿瘤的转移。
本发明所述的肿瘤进一步为脑肿瘤或黑色素瘤。脑肿瘤是指生长于颅内的肿瘤,包括由脑实质发生的原发性脑瘤和由身体其他部位转移至颅内的继发性脑瘤。黑色素瘤又称为恶性黑色素瘤,是一种能产生黑色素的高度恶性肿瘤,多发生于皮肤或接近皮肤的黏膜,也见于软脑膜和脉络膜。
本发明所述的脑瘤更进一步为脑胶质瘤。源于神经上皮的肿瘤称为脑胶质瘤,占颅脑肿瘤的40-50%,是常见的颅内恶性肿瘤。
所述类α-氨基酸三氟化硼化物在该硼中子捕获治疗系统中的应用中占有重要作用,将在下文中详述。
优选地,所述类α-氨基酸三氟化硼化物中的m为钾或钠。
优选地,所述类α-氨基酸三氟化硼化物中的b为10b。
为了进一步提高含硼药物中10b含量,所述类α-氨基酸三氟化硼化物中10b的纯度≥95%。
所述类α-氨基酸三氟化硼化物中的至少一个f为18f,这样设置,在放射治疗体积内的肿瘤和所有组织中以及周围的硼浓度和分布可以在照射前和照射期间非侵入地准确而快速地测定。该诊断信息使得通过降低超热中子在已知含有高水平硼的组织区域暴露,可以更快、更准确和更安全地进行硼中子捕获治疗。
进一步地,硼中子捕获治疗装置包括中子产生部和射束整形体,所述射束整形体用于将由中子产生部产生的中子束能谱调整到超热中子能区。
在改善中子射源通量与品质,射束整形体也占有重要作用。所述射束整形体包括邻接于所述中子产生部的缓速体、包围在所述缓速体外的反射体、与所述缓速体邻接的热中子吸收体、设置在所述射束整形体内的辐射屏蔽和射束出口,所述中子产生部与入射的质子束发生核反应以产生中子,所述缓速体将自所述中子产生部产生的中子减速至超热中子能区,所述反射体将偏离的中子导回以提高超热中子射束强度,所述热中子吸收体用于吸收热中子以避免治疗时与浅层正常组织造成过多剂量,所述辐射屏蔽用于屏蔽渗漏的中子和光子以减少非照射区的正常组织剂量。
所述硼中子捕获治疗装置进一步包括设置在射束出口处用于汇聚所述超热中子的准直器。
附图说明
图1是基于加速器型的硼中子捕获治疗系统的平面示意图。
图2是基于反应堆型的硼中子捕获治疗系统的平面示意图。
具体实施方式
下面结合具体实施例及附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。所述实施例的目的仅用于说明和描述本发明当前的最佳模式。本发明的保护范围不以任何方式受此处所述实施例的限制。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它成分或其组合的存在或添加。
本文所述的快中子为能区大于40kev的中子,超热中子能区在0.5ev到40kev之间,热中子能区小于0.5ev。
中子捕获治疗作为一种有效的治疗癌症的手段近年来的应用逐渐增加,其中以硼中子捕获治疗最为常见,供应硼中子捕获治疗的中子可以由核反应堆或加速器供应。本发明的实施 例以加速器硼中子捕获治疗为例,加速器硼中子捕获治疗的基本组件通常包括用于对带电粒子(如质子、氘核等)进行加速的加速器、靶材与热移除系统和射束整形体,其中加速带电粒子与金属靶材作用产生中子,依据所需的中子产率与能量、可提供的加速带电粒子能量与电流大小、金属靶材的物化性等特性来挑选合适的核反应,常被讨论的核反应有7li(p,n)7be及9be(p,n)9b,这两种反应皆为吸热反应。两种核反应的能量阀值分别为1.881mev和2.055mev,由于硼中子捕获治疗的理想中子源为kev能量等级的超热中子,理论上若使用能量仅稍高于阀值的质子轰击金属锂靶材,可产生相对低能的中子,不须太多的缓速处理便可用于临床,然而锂金属(li)和铍金属(be)两种靶材与阀值能量的质子作用截面不高,为产生足够大的中子通量,通常选用较高能量的质子来引发核反应。
理想的靶材应具备高中子产率、产生的中子能量分布接近超热中子能区(将在下文详细描述)、无太多强穿辐射产生、安全便宜易于操作且耐高温等特性,但实际上并无法找到符合所有要求的核反应,本发明的实施例中采用锂金属制成的靶材。但是本领域技术人员熟知的,靶材的材料也可以由其他除了上述谈论到的金属材料之外的金属材料制成。
针对热移除系统的要求则根据选择的核反应而异,如7li(p,n)7be因金属靶材(锂金属)的熔点及热导系数差,对热移除系统的要求便较9be(p,n)9b高。本发明的实施例中采用7li(p,n)7be的核反应。
无论硼中子捕获治疗的中子源来自核反应堆或加速器带电粒子与靶材的核反应,产生的皆为混合辐射场,即射束包含了低能至高能的中子、光子;对于深部肿瘤的硼中子捕获治疗,除了超热中子外,其余的辐射线含量越多,造成正常组织非选择性剂量沉积的比例越大,因此这些会造成不必要剂量的辐射应尽量降低。除了空气射束品质因素,为更了解中子在人体中造成的剂量分布,本发明的实施例中使用人体头部组织假体进行剂量计算,并以假体射束品质因素来作为中子射束的设计参考,将在下文详细描述。
国际原子能机构(iaea)针对临床硼中子捕获治疗用的中子源,给定了五项空气射束品质因素建议,此五项建议可用于比较不同中子源的优劣,并供以作为挑选中子产生途径、设计射束整形体时的参考依据。这五项建议分别如下:
超热中子射束通量epithermalneutronflux>1x109n/cm2s
快中子污染fastneutroncontamination<2x10-13gy-cm2/n
光子污染photoncontamination<2x10-13gy-cm2/n
热中子与超热中子通量比值thermaltoepithermalneutronfluxratio<0.05
中子电流与通量比值epithermalneutroncurrenttofluxratio>0.7
注:超热中子能区在0.5ev到40kev之间,热中子能区小于0.5ev,快中子能区大于40kev。
1、超热中子射束通量:
中子射束通量和肿瘤中含硼药物浓度共同决定了临床治疗时间。若肿瘤含硼药物浓度够高,对于中子射束通量的要求便可降低;反之,若肿瘤中含硼药物浓度低,则需高通量超热中子来给予肿瘤足够的剂量。iaea对于超热中子射束通量的要求为每秒每平方厘米的超热中子个数大于109,此通量下的中子射束对于目前的含硼药物而言可大致控制治疗时间在一小时内,短治疗时间除了对病人定位和舒适度有优势外,也可较有效利用含硼药物在肿瘤内有限的滞留时间。
2、快中子污染:
由于快中子会造成不必要的正常组织剂量,因此视之为污染,此剂量大小和中子能量呈正相关,因此在中子射束设计上应尽量减少快中子的含量。快中子污染定义为单位超热中子通量伴随的快中子剂量,iaea对快中子污染的建议为小于2x10-13gy-cm2/n。
3、光子污染(γ射线污染):
γ射线属于强穿辐射,会非选择性地造成射束路径上所有组织的剂量沉积,因此降低γ射线含量也是中子束设计的必要要求,γ射线污染定义为单位超热中子通量伴随的γ射线剂量,iaea对γ射线污染的建议为小于2x10-13gy-cm2/n。
4、热中子与超热中子通量比值:
由于热中子衰减速度快、穿透能力差,进入人体后大部分能量沉积在皮肤组织,除黑色素细胞瘤等表皮肿瘤需用热中子作为硼中子捕获治疗的中子源外,针对脑瘤等深层肿瘤应降低热中子含量。iaea对热中子与超热中子通量比值建议为小于0.05。
5、中子电流与通量比值:
中子电流与通量比值代表了射束的方向性,比值越大表示中子射束前向性佳,高前向性的中子束可减少因中子发散造成的周围正常组织剂量,另外也提高了可治疗深度及摆位姿势弹性。iaea对中子电流与通量比值建议为大于0.7。利用假体得到组织内的剂量分布,根据正常组织及肿瘤的剂量-深度曲线,推得假体射束品质因素。如下三个参数可用于进行不同中子射束治疗效益的比较。
1、有效治疗深度:
肿瘤剂量等于正常组织最大剂量的深度,在此深度之后的位置,肿瘤细胞得到的剂量小于正常组织最大剂量,即失去了硼中子捕获的优势。此参数代表中子射束的穿透能力, 有效治疗深度越大表示可治疗的肿瘤深度越深,单位为cm。
2、有效治疗深度剂量率:
即有效治疗深度的肿瘤剂量率,亦等于正常组织的最大剂量率。因正常组织接收总剂量为影响可给予肿瘤总剂量大小的因素,因此参数影响治疗时间的长短,有效治疗深度剂量率越大表示给予肿瘤一定剂量所需的照射时间越短,单位为cgy/ma-min。
3、有效治疗剂量比:
从大脑表面到有效治疗深度,肿瘤和正常组织接收的平均剂量比值,称之为有效治疗剂量比;平均剂量的计算,可由剂量-深度曲线积分得到。有效治疗剂量比值越大,代表该中子射束的治疗效益越好。
为了使射束整形体在设计上有比较依据,除了五项iaea建议的空气中射束品质因素和上述的三个参数,本发明实施例中也利用如下的用于评估中子射束剂量表现优劣的参数:
1、照射时间≤30min(加速器使用的质子电流为10ma)
2、30.0rbe-gy可治疗深度≥7cm
3、肿瘤最大剂量≥60.0rbe-gy
4、正常脑组织最大剂量≤12.5rbe-gy
5、皮肤最大剂量≤11.0rbe-gy
注:rbe(relativebiologicaleffectiveness)为相对生物效应,由于光子、中子会造成的生物效应不同,所以如上的剂量项均分别乘上不同组织的相对生物效应以求得等效剂量。
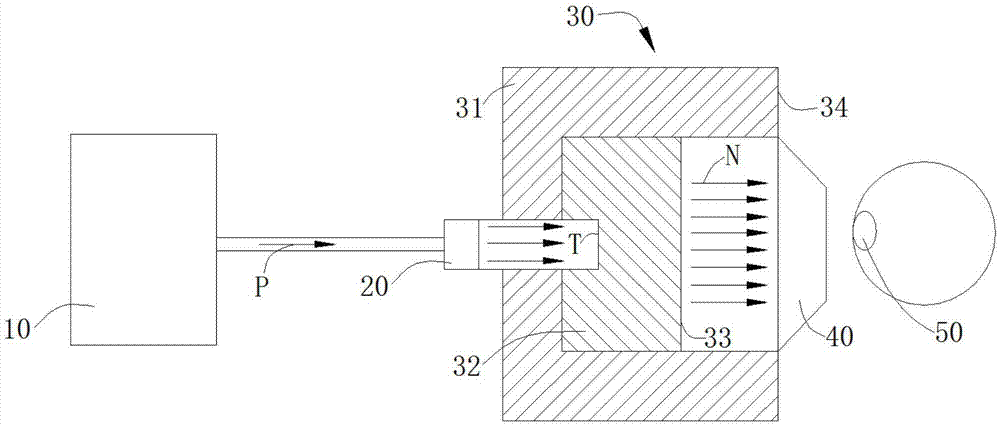
请参见图1,其揭示了一种基于加速器型的硼中子捕获治疗系统的平面示意图,硼中子捕获治疗系统包括加速器10、扩束装置20、用于通过带电粒子束p的带电粒子束入口、带电粒子束p、经与带电粒子束p发生核反应从而产生中子束n的中子产生部t、用于调整经中子产生部t产生的中子射束通量与品质的射束整形体30、邻接于射束整形体30的准直器40和被经准直器40处出来的射束照射的类α-氨基酸三氟化硼化物50。其中,加速器10用来给带电粒子束p加速,可以为回旋加速器或者直线加速器等适用于加速器型中子捕获治疗系统的加速器;这里的带电粒子束p优选为质子束;扩束装置20设置在加速器10及中子产生部t之间;带电粒子束入口紧邻中子产生部t并容纳在射束整形体30内,在中子产生部t及扩束装置20之间的三个箭头作为带电粒子束入口;中子产生部t容纳在射束整形体30内,这里的中子产生部t优选为锂金属;射束整形体30包括反射体31、被反射体31包围并邻接于中子产生部t的缓速体32、与缓速体32邻接的热中子吸收体33、设置在射束整形体30内的辐射屏蔽34,中子产生部t与自带电粒子束入口入射的带电粒子束p发生核反应以产生中子 束n,缓速体32将自中子产生部t产生的中子减速至超热中子能区,反射体31将偏离的中子导回以提高超热中子射束强度,热中子吸收体33用于吸收热中子以避免治疗时与浅层正常组织造成过多剂量,辐射屏蔽34用于屏蔽渗漏的中子和光子以减少非照射区的正常组织剂量,准直器40用于将中子束聚集;经准直器40射出的中子束作用到类α-氨基酸三氟化硼化物50后产生的能量破坏肿瘤细胞dna。
请参见图2,其揭示了一种基于反应堆型的硼中子捕获治疗系统的平面示意图,硼中子捕获治疗系统包括反应堆100(中子束由所述反应堆内产生,因此亦可称之为中子产生部)、扩束装置200、中子束入口、用于调整经中子产生部产生的中子射束通量与品质的射束整形体300、邻接于射束整形体300的准直器400和被经准直器400处出来的射束照射的类α-氨基酸三氟化硼化物500。其中,反应堆100可以由本领域技术人员熟知地能够产生需要的能量的中子的相关核反应,如铀-235或钚-239产生裂变反应时放出来的快中子;扩束装置200设置在反应堆100及中子束入口之间;在扩束装置200之后的三个箭头作为中子束入口;射束整形体300包括反射体310、被反射体310包围的缓速体320、与缓速体320邻接的热中子吸收体330、设置在射束整形体300内的辐射屏蔽340,缓速体320将自中子产生部100产生的中子减速至超热中子能区,反射体310将偏离的中子导回以提高超热中子射束强度,热中子吸收体330用于吸收热中子以避免治疗时与浅层正常组织造成过多剂量,辐射屏蔽340用于屏蔽渗漏的中子和光子以减少非照射区的正常组织剂量,准直器400用于将中子束聚集;经准直器400射出的中子束作用到类α-氨基酸三氟化硼化物500后产生的能量破坏肿瘤细胞dna。
射束整形体30、300能将中子缓速至超热中子能区,并降低热中子及快中子含量。反射体31、310由具有中子反射能力强的材料制成,作为一种优选实施例,反射体31、310由pb或ni中的至少一种制成。缓速体32、320由具有快中子作用截面大、超热中子作用截面小的材料制成,作为一种优选实施例,缓速体32、320由d2o、alf3、fluentaltm、caf2、li2co3、mgf2和al2o3中的至少一种制成。热中子吸收体33、330由与热中子作用截面大的材料制成,作为一种优选实施例,热中子吸收体33、330由6li制成。辐射屏蔽34、340包括光子屏蔽和中子屏蔽,作为一种优选实施例,辐射屏蔽34、340包括由铅(pb)制成的光子屏蔽和由聚乙烯(pe)制成的中子屏蔽。准直器40、400由对中子汇聚能力强的材料制成,作为一种优选实施例,准直器40、400由石墨、铅中的至少一种制成。
本领域技术人员熟知地,除了上述加速器型及反应堆型的中子产生方式,还可以采用其他的中子产生方式,如d-d中子发生器,d-t中子发生器等,也可以根据实际需要对射束整形体的材料、结构及组成进行相应的调整。
在bnct中,当以治疗有效量进行给予时,含硼的化合物必须是无毒的或低毒性的,以及能够选择性地积聚在肿瘤组织中。虽然bpa具有低化学毒性的优势,但是它以低于期望的水平积聚在临界正常组织中。尤其是,肿瘤中的硼浓度相对于正常脑以及肿瘤相对于血液的比率大约为3:1。这样低的特异性(专一性)限制了bpa对肿瘤的最大剂量,这是因为用于正常组织的可允许的剂量是限制性因素。
因此,需要开发新的化合物,其在肿瘤中具有较长的保留时间,并选择性地靶向和破坏肿瘤细胞而对正常组织具有最小的损伤。
α-氨基酸是蛋白质的主要组分,是生物体中最重要的氨基酸,在atp的产生和神经传递过程中发挥着非常重要的作用。此外,α-氨基酸还是癌细胞生存和增殖的关键营养素。α-氨基酸中的-cooh被-bf3取代即得到类α-氨基酸的三氟化硼化物,其为α-氨基酸的等电子体化合物。有研究表明,细胞摄取类α-氨基酸的三氟化硼化物的途径跟α-氨基酸相同,都是通过酶介导途径,且两者具有相同的转运蛋白。类α-氨基酸的三氟化硼化物在用于bnct的新型硼载体化合物的设计中引起我们强烈的关注,该化合物稳定性高,靶向性好,在肿瘤细胞内富集度高。相比较fdg,炎症区域对该化合物的吸收几乎可忽略不计。此外,类α-氨基酸的三氟化硼化物易于合成,通常由相应的硼酸酯在酸性条件下与khf2反应制得。
此外,在bnct中利用18f标记的类α-氨基酸的三氟化硼化合物,在放射治疗体积内的肿瘤和所有组织中以及周围的硼浓度和分布可以在照射前和照射期间非侵入地准确而快速地测定。该诊断信息使得通过降低超热中子在已知含有高水平硼的组织区域暴露,可以更快、更准确和更安全地进行硼中子俘获治疗。
下面将结合具体实施例对类α-氨基酸的三氟化硼化合物进行详细的阐述。
实施例1phe-bf3制备
反应路线
于1.5ml微量反应器中加入苄基硼酸酯(15mg,0.05mmol),kf(0.15mmol,0.05ml)溶液,hcl(0.2mmol,0.03ml)溶液,0.1mlmecn溶液,室温条件下反应2h,得到phe-bf3粗品。粗品经hplc进一步纯化,得到phe-bf3。1hnmr(300mhz,meod):δppm7.30(m,5h),3.04(d,j=9.8hz,1h),2.67(t,j=9.8hz,1h),2.42(brs,1h);[m-h]-188.0901,found:188.0589。
根据本发明的化合物的体外研究
对本实施例1的纯化材料(以下称作phe-bf3)进行的体外试验使用四种不同的来源于人 的肿瘤细胞株u343mga、人的肝癌细胞株hep3b、人的乳腺癌细胞株mcf7和人的肉瘤细胞株4ss。将细胞平铺在未涂覆的组织培养皿上,并且在37℃下在具有用5%co2平衡的湿润空气的温育器中进行培养(所述培养基中添加了10%的fcs和pest(青霉素100iu/ml和链霉素100mg/ml))。为了细胞的通过,将细胞用胰蛋白酶-edta(具有0.25%的胰蛋白酶和0.02%的edta、不含钙和镁的磷酸盐缓冲盐水(pbs))进行胰蛋白酶化。
实施例2phe-bf3的细胞摄取
将u343mga细胞以75%的细胞密度平铺在petri培养皿上,并且用溶于组织培养基的1,4-二羟基硼苯丙氨酸(bpa)或phe-bf3温育6小时。两种含硼化合物均以相对于硼含量(5×10-4mol/l硼)的等摩尔浓度加入并溶解在组织培养基中。通过除去含硼组织培养基以及为了从细胞上洗去过量的培养基而加入冷磷酸缓冲盐溶液(pbs缓冲液)来结束温育。通过使用橡胶淀帚从培养皿上铲下来而即刻收获细胞,它们在冷的pbs中收集并且通过离心形成沉淀。
根据bradford标准程序对细胞样品进行总蛋白分析。通过直流原生质原子发射光谱(dcp-aes)对沉淀细胞进行硼分析。在60℃下用硫酸/硝酸(1/1)对样品(50-130mg)消化。加入tritonx-100和水从而得到50mg组织/ml、15%总酸v/v和5%tritonx-100v/v的浓度。硼浓度是基于已知对照样品的。结果见下表1。由表1可以看出,phe-bf3优于对作为硼苯丙氨酸(bpa)的硼的摄取。
表1:不同的硼化合物的细胞摄取
对于两个平行试验(试验1和2)中的不同的硼化合物来说,硼含量表示为u343mga细胞中总细胞蛋白的函数(μg硼/g细胞蛋白)(在试验1和试验2中分别为7.2和7.7μg硼/ml培养基)。
实施例3不同肿瘤细胞对phe-bf3的摄取
将四种来源于人的不同肿瘤细胞株:u343mga、hep3b、mcf7和4ss以40-50%(低)以及90-100%(高)细胞密度平铺在petri培养皿上,并且如上述用溶于组织培养基的phe-bf3温育6小时。通过除去含硼培养基以及为了从细胞上洗去过量的培养基而加入冷的pbs缓冲液来结束温育。通过使用橡胶淀帚从培养皿上铲下来而即刻收获细胞,它们在冷的pbs中收集并且通过离心形成沉淀。根据bradford标准程序对细胞样品进行总蛋白分析(如上)。结果 见下表2。对于以低和高细胞密度测试的所有四种人的肿瘤细胞株(胶质母细胞瘤(u343mga)、肝癌(hep3b)、乳腺癌(mcf7)、肉瘤(4ss))对比中,发现phe-bf3是一种高效的硼载体。
表2:phe-bf3的细胞摄取。硼含量表示为总细胞蛋白的函数(μg硼/g细胞蛋白)。
实施例4phe-bf3的细胞内保留
将u343mga细胞以75%的细胞密度平铺在petri培养皿上,并且用于组织培养基中的1,4-二羟基硼苯丙氨酸(bpa)或phe-bf3温育18小时。两种硼化合物均以相对于硼含量(5×10-4mol/l硼)的等摩尔的浓度加入组织培养基中。通过用没有硼的培养基代替含硼培养基而结束温育。细胞样品分别在时间点0、2和7小时进行取样,其中0时间点代表刚好用硼化合物温育18小时。
细胞用冷的pbs洗涤,并通过使用橡胶淀帚从培养皿上铲下来而即刻将其收获,它们在冷的pbs中收集并且通过离心形成沉淀。同上述操作对细胞沉淀进行总蛋白和硼含量的分析。结果见下表3。随着细胞内的摄取,在培养基中的ⅰa完全耗尽后7h时,保留在肿瘤细胞中的式(i)化合物为总摄取的50%。
表3:在清除含硼培养基之后的0、2和7h时u343mga细胞中的硼含量(μg硼/g细胞沉淀)。
综上所述,正如实施例2-4中显示的,化合物phe-bf3已经在体外试验中显示出预期的结果,其在肿瘤细胞摄取、积累和保留方面都优于bpa。
实施例5phe-bf3细胞毒性研究试验
将含肽牛血清的细胞培养液置于37℃培养24h。将传代培养的小鼠成纤细胞l-929细胞,用细胞培养液制成1×105个/ml的细胞悬液,将该细胞悬液接种于96孔细胞培养板(100μl/孔),置37℃二氧化碳培养箱中培养24h。等细胞贴壁生长后,去除上清液,加入对照液(不含化合物ⅰa),试验组(phe-bf3的浓度为5mmol/l)的培养液进行交换,置37℃二氧化碳培养箱中继续培养。于2天后取出,加入mtt液继续培养4h。吸除原液,加入dmso,振 荡10min。用酶联免疫检测仪在波长为630nm下测定其吸光度值,并根据其吸光度按公式计算细胞的相对增殖度(rgr)。结果见下表4。
表4:mtt比色法测得的细胞相对增殖度(rgr)结果
注:
根据细胞相对增殖度来评定细胞的毒性反应,见下表5。
表5:细胞毒性反应评定
结论:由表5可以看出,phe-bf3并没有出现任何毒性的迹象。
本发明揭示的硼中子捕获治疗系统并不局限于以上实施例所述的内容以及附图所表示的结构。在本发明的基础上对其中构件的材料、形状及位置所做的显而易见地改变、替代或者修改,都在本发明要求保护的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!