光控温敏脂质体及其制备方法和用途与流程
本发明属于医药化工技术领域,具体涉及一种光控温敏脂质体及其制备方法。本发明还涉及将上述光控温敏脂质体用于包载疏水性和亲水性化疗药物的应用,以及制备抑制癌细胞的转移和/或逆转癌细胞的多药耐药性的药物的应用。
背景技术:
脂质体(liposomes)是由脂质双分子层排列而成的类生物膜结构的封闭囊状结构,由于它的脂质双分子层与细胞膜结构相似,其可作为药物的载体将药物包裹在脂质体双分子层的双分子层内或内腔内,利用脂质体的被动靶向作用使载药脂质体富集于病变部位,进而释放药物。
温度敏感性脂质体有效利用了脂质体和热疗的双重优势来提高治疗效果,降低毒副作用。普通的温度敏感性脂质体是将不同的磷脂和胆固醇按照一定的比例混合,从而使其具有特定的相转变温度(tm),当环境温度高于tm时可以增加药物的释放,但是生理温度无法精确控制,脂质体包载的药物难以快速定位释放而发挥药效。
光热技术可以利用激光照射肿瘤组织,使其产生热效应,从而改变肿瘤细胞微环境,抑制肿瘤血管形成和肿瘤细胞转移,并使其凋亡、坏死,达到治疗肿瘤的目的。肿瘤组织中血流量较少,容易储存热量,升温明显;而正常组织血流量较多,散热较快,无明显的升温效果,因此肿瘤激光技术既能有效的杀死肿瘤细胞,又不会损伤正常细胞。且由于其无创伤性、毒副作用小、耐受性高等特点,被越来越频繁的应用于临床。
光控温敏脂质体主要通过以激光照射肿瘤部位,使富集在肿瘤部位的光敏脂质体产生热效应,这样既可以提高肿瘤组织微环境的温度,使其温度迅速达到并维持在光控温敏脂质体相转变温度(tm)之上,促进药物从光控温敏脂质体中快速释放,又可以增强肿瘤组织的渗透性,使药物更容易进入肿瘤组织内部,进而发挥药效。
技术实现要素:
[技术问题]
基于以上背景,本发明的发明人通过将光控温敏性材料插入到脂质体双分子层中而构建了新型的光控温敏脂质体,这种脂质体由于结合了激光技术和温敏脂质体各自优点,显著提高了药物释放的可控性,进而改善了药物的疗效。
[技术方案]
因此,本发明的一个方面提供了一种光控温敏脂质体,所述光控温敏脂质体包含脂质体和嵌入所述脂质体的双分子层中的聚乙二醇化光敏分子。
根据本发明的光控温敏脂质体中,所述脂质体包含磷脂和胆固醇,所述聚乙二醇化光敏分子为两亲性光敏材料,所述磷脂和胆固醇与所述聚乙二醇化光敏分子的比例为:磷脂、胆固醇、聚乙二醇化光敏分子的质量比为(5-20):(1-3):(2-6)。
根据本发明的光控温敏脂质体中,优选地,所述磷脂可为选自大豆卵磷脂(pc)、氢化大豆卵磷脂(hspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰乙醇胺(dppe)、二硬酯酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二硬脂酰磷脂酰甘油(dspg)和二月桂酰磷脂酰胆碱(dlpc)的一种或多种。
根据本发明的光控温敏脂质体中,所述聚乙二醇化光敏分子可为以下式1a至式1c所表示的氨基化聚乙二醇单甲醚与光敏分子的偶联物:
其中,r源自下式2-5所表示的化合物的任意一种,其通过在*处的羧基与所述氨基化聚乙二醇单甲醚的氨基或者gflg或plglag的氨基端形成酰胺键:
其中,gflg为由甘氨酸-苯丙氨酸-亮氨酸-甘氨酸组成的寡肽(seqidno:1),以及plglag为由脯氨酸-亮氨酸-甘氨酸-亮氨酸-丙氨酸-甘氨酸组成的寡肽(seqidno:2),并且,gflg和plglag各自的氨基端可与r的羧基形成酰胺键,羧基端可与所述氨基化聚乙二醇单甲醚的氨基形成酰胺键,以及
其中,n为25-225的整数,优选45-225的整数,更优选45、113和225。
此处所用的术语“偶联物”可指的是氨基化聚乙二醇单甲醚通过其氨基与光敏分子的羧基形成酰胺键而与光敏分子相连接的化合物(例如,式1a所示的化合物),或者是氨基化聚乙二醇单甲醚通过与其连接的gflg或plglag的氨基端与光敏分子的羧基形成酰胺键而与光敏分子相连接的化合物(例如,式1b和1c所示的化合物)。在此,gflg或plglag通过其羧基端与氨基化聚乙二醇单甲醚的氨基形成酰胺键而与氨基化聚乙二醇单甲醚相连接。
根据本发明的一个实施方式,所述聚乙二醇化光敏分子的制备方法包括如下步骤:将式2-5所示光敏剂的任意一种溶于有机溶剂中,同时加入与光敏剂等摩尔数的羧基活化剂,密封,在0-40℃之间的任意温度下恒温反应0.5-6h后,加入与光敏剂等摩尔数的所述氨基化聚乙二醇单甲醚(其中聚乙二醇的聚合度(n)为25-225的整数,重均或数均分子量范围为1000-10000da),在0-40℃之间的任意温度下恒定反应0.5-48h后,除去有机溶剂,制备液相色谱进行分离,乙醚沉淀结晶,即得本发明作为两亲性光敏材料的聚乙二醇化光敏分子。本发明中,非必须地,可以包括在加入氨基化聚乙二醇单甲醚之前用寡肽(例如,gflg或plglag)对所述光敏分子进行修饰以得到寡肽修饰的光敏分子的步骤。
优选地,所述羧基活化剂可以包括选自1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、二环己基碳二亚胺、1-羟基苯并三唑和n-羟基琥珀酰亚胺等的一种或多种。
优选地,所述有机溶剂可以包括,但不仅限于:甲醇、乙腈、二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺和二甲基亚砜。
根据本发明的光控温敏脂质体由所述聚乙二醇化光敏分子嵌入所述脂质体的双分子层中而形成。
本发明另一个方面提供了一种制备光控温敏脂质体的方法,所述方法包括:
步骤1:聚乙二醇化光敏分子的制备:方法如上所述。
步骤2:将磷脂、胆固醇和上述聚乙二醇化光敏分子溶解于有机溶剂中,旋转蒸发除去有机溶剂以在瓶壁形成均匀薄膜层,加入缓冲溶液(例如磷酸缓冲溶液,0.2m,ph=7.4)水化,充分振荡使磷脂膜水化完全,超声,高压均质或通过挤出器滤膜,即得根据本发明的光控温敏脂质体。
其中,优选地,所述有机溶剂可为选自二氯甲烷、氯仿、甲醇、乙醇、乙腈、四氢呋喃和丙酮的至少一种。
优选地,所述的缓冲溶液可选自ph3.0-8.0的磷酸缓冲液、ph3.0-8.0的磷酸氢二钠-柠檬酸缓冲液、ph3.0-7.0的柠檬酸-柠檬酸钠缓冲液、ph3.0-6.0的乙酸-乙酸钠缓冲液的任意一种。
优选地,所述光控温敏脂质体的平均流体力学粒径为20-300纳米。
本发明中,所述光控温敏脂质体可以包载药物。例如,所述药物可为用于治疗癌症的药物,如疏水性化疗药物和/或亲水性化疗药物。所述用于治疗癌症的药物,只要出于本发明的目的,可以选自任何的化疗药物,其中所述疏水性化疗药物可以包括选自紫杉醇、多烯紫杉醇、阿霉素、喜树碱、10-羟基喜树碱、5-氨基喜树碱、长春碱、长春新碱、依托泊苷、顺铂等药物分子及它们的修饰物的一种或多种,所述亲水性化疗药物可以包括选自盐酸阿霉素、盐酸伊立替康、奥沙利铂、盐酸吉西他滨、重酒石酸长春瑞滨、甲磺酸伊马替尼等药物分子及它们的修饰物的一种或多种。
根据本发明的一个实施方式,优选地,包载药物的光控温敏脂质体的平均流体力学粒径为20-300纳米。
根据本发明的另一个方面提供了一种包载药物的光控温敏脂质体,其通过使本发明的光控温敏脂质体包载药物而形成。
根据本发明的一个实施方式,制备包载疏水性化疗药物的光控温敏脂质体的方法包括:将所述疏水性化疗药物与磷脂、胆固醇和上述聚乙二醇化光敏分子溶解于有机溶剂中,旋转蒸发除去有机溶剂在瓶壁形成均匀的薄膜层,加入缓冲溶液水化,充分振荡使磷脂膜水化完全,超声,滤膜挤出,即得包载疏水性化疗药物的光控温敏脂质体。
其中,优选地,所述有机溶剂为选自二氯甲烷、氯仿、甲醇、乙醇、乙腈、四氢呋喃和丙酮的至少一种,
优选地,所述的缓冲溶液可选自ph3.0-8.0的磷酸缓冲液、ph3.0-8.0的磷酸氢二钠-柠檬酸缓冲液、ph3.0-7.0的柠檬酸-柠檬酸钠缓冲液、ph3.0-6.0的乙酸-乙酸钠缓冲液的一种。
优选地,所包载的疏水性化疗药物的质量占载药光控温敏脂质体总质量的5-30%。
优选地,所述包载疏水性化疗药物的光控温敏脂质体的平均流体力学粒径为20-300纳米。
根据本发明的一个实施方式,制备包载亲水性化疗药物的光控温敏脂质体的方法包括:将磷脂、胆固醇、上述聚乙二醇化光敏分子溶解于有机溶剂中,旋转蒸发除去有机溶剂并在瓶壁形成均匀的薄膜层,加入硫酸铵溶液水化,充分振荡使磷脂膜水化完全、超声、滤膜挤出,在去离子水中透析6-48小时后(截留分子量为1000-10000da的透析袋中),升温至30-80℃,加入亲水性化疗药物,并保温5-40min,去离子水透析除去游离的亲水性化疗药物即得包载亲水性化疗药物的光控温敏脂质体。
其中,优选地,所述有机溶剂可为选自二氯甲烷、氯仿、甲醇、乙醇、乙腈、四氢呋喃和丙酮的至少一种。
优选地,所包载的亲水性化疗药物的质量占所述载药光控温敏脂质体总质量的5-30%。
优选地,所述包载疏水性化疗药物的光控温敏脂质体的平均流体力学粒径为20-300纳米。
根据本发明的一个实施方式,制备包载疏水性和亲水性化疗药物的光控温敏性脂质体的方法包括:将磷脂、胆固醇、上述聚乙二醇化光敏分子、疏水性化疗药物溶解于有机溶剂中,旋转蒸发除去有机溶剂以在瓶壁形成均匀的薄膜层,加入适量的硫酸铵溶液水化,充分振荡使磷脂膜水化完全,超声,滤膜挤出,用截留分子量为1000-10000da的透析袋在去离子水中透析6-48小时,升温至30-80℃,加入亲水性化疗药物并保温5-40min,去离子水透析除去游离的亲水性化疗药物即得包载疏水性和亲水性化疗药物的光控温敏脂质体。
其中,优选地,所述的有机溶剂可为选自二氯甲烷、氯仿、甲醇、乙醇、乙腈、四氢呋喃和丙酮的至少一种。
优选地,所包载的疏水性和亲水性化疗药物的质量各占所述载药的光控温敏脂质体总质量的5-30%。
优选地,所述包载疏水性和亲水性化疗药物的光控温敏脂质体的平均流体力学粒径为20-300纳米。
本发明的再一个方面提供了所述光控温敏脂质体在制备用于治疗癌症的药物的应用,以及利用本发明所述的光控温敏脂质体制备的治疗癌症的药物组合物。其中所述药物组合物中的治疗癌症的有效组分主要用于抑制癌细胞的转移和/或逆转癌细胞的多药耐药性。
在本发明中如无特别限定,所述用于治疗癌症的化疗药物,只要出于本发明的目的,可以选自任何的化疗药物,其中疏水性化疗药物可以包括选自紫杉醇、多烯紫杉醇、阿霉素、喜树碱、10-羟基喜树碱、5-氨基喜树碱、长春碱、长春新碱、依托泊苷、顺铂等药物分子及其修饰物的一种或多种,其中亲水性化疗药物可以包括选自盐酸阿霉素、盐酸伊立替康、奥沙利铂、盐酸吉西他滨、重酒石酸长春瑞滨、甲磺酸伊马替尼等药物分子及其修饰物的一种或多种。
根据本发明,所述癌症的类型主要为转移性或耐药性的乳腺癌、肺癌、肝癌、胃癌、头颈部癌、宫颈癌、胰腺癌、卵巢癌、结肠癌及前列腺癌等实体性恶性肿瘤。
本发明提供的光控温敏脂质体的相变温度接近40摄氏度,可在体温条件下稳定存在,防止脂质体在血液循环中发生药物泄露。脂质体到达病变部位(肿瘤)后可通过激光选择性照射肿瘤部位,使富集在肿瘤部位的光敏脂质体产生光热效应,可使病灶部位的温度迅速达光控温敏脂质体相转变温度(tm)之上,促进药物从温敏脂质体中快速释放,实现化疗药物定点释放,又可以增强肿瘤组织的渗透性,使药物更容易进入肿瘤组织内部,进而提高药效并降低毒副作用。同时光控脂质体可在激光照射下发挥光热治疗作用,与化疗药物协同增效。
附图说明
图1为本发明实施例3制备的聚乙二醇化的光敏分子4的质谱图;
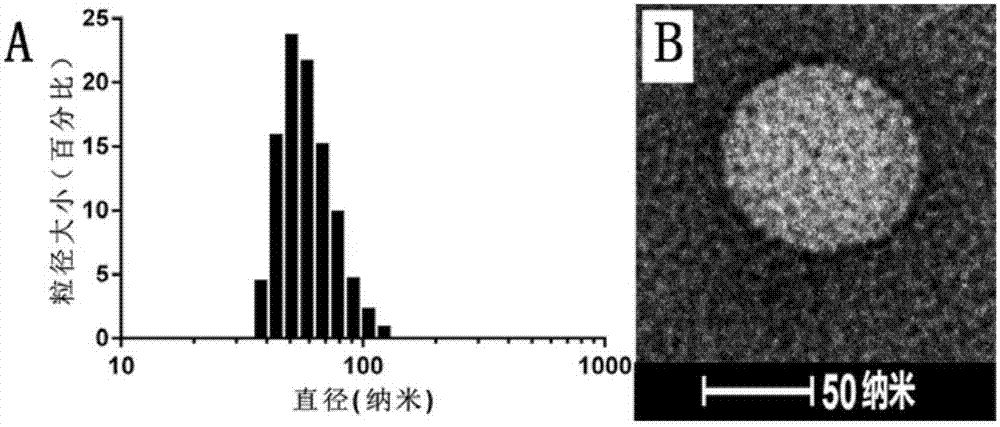
图2为本发明的实施例4制备的光控温敏脂质体的流体力学粒径分布图(a)和透射电子显微镜照片(b);
图3为本发明的实施例5制备的包载紫杉醇的光控温敏脂质体的流体力学粒径分布图(a)和透射电子显微镜照片(b);
图4为本发明的实施例6制备的包载盐酸阿霉素的光控温敏脂质体的流体力学粒径分布图(a)和透射电子显微镜照片(b);
图5为本发明的实施例7制备的包载紫杉醇和盐酸阿霉素的光控温敏脂质体的流体力学粒径分布图(a)和透射电子显微镜照片(b);
图6为本发明的实施例7中包载紫杉醇和盐酸阿霉素的光控温敏脂质体的升温曲线;
图7为本发明的实施例6中包载盐酸阿霉素的光控温敏脂质体的药物释放曲线;
图8为本发明的实施例4-7中制备的光控温敏脂质体对4t1乳腺癌细胞的mtt毒性实验数据。
具体实施方式
本发明将通过以下示例性的具体实施例进行详细说明,但本发明的精神和权利要求书的保护范围不受这些具体实施例的限定。
实施例中所用的二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、胆固醇购自上海艾韦特医药科技有限公司;氨基化聚乙二醇单甲醚(mpeg-nh2,mw=5000da)购自西宝生物科技有限公司;式2或3所示的光敏分子参照文献方法合成(angew.chem.int.ed.2013,52,10325–10329);式4或5所示的光敏分子购自上海笛柏化学品有限公司;羧基活化剂1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐购自梯希爱(上海)化成工业发展有限公司;羧基活化剂1-羟基苯并三唑、n,n-二甲基甲酰胺、三乙胺、四氢呋喃购自上海百灵威科技有限公司;短肽序列甘氨酸-苯丙氨酸-亮氨酸-甘氨酸(gflg)、脯氨酸-亮氨酸-甘氨酸-亮氨酸-丙氨酸-甘氨酸(plglag)由上海吉尔生化有限公司合成;盐酸阿霉素购自大连美仑生物技术有限公司;紫杉醇购自大连美仑物科技有限公司。在本申请中,如无特殊说明,其余所用试剂和溶剂均购自国药集团(上海)化学试剂有限公司。4t1乳腺癌细胞购自美国atcc细胞库,细胞培养用rpim1640培养基和胎牛血清均购自gibco公司。
如无特殊说明,所用设备及测试方法均为本领域常规的设备和方法。透射电镜照片由tecnaig2f20s-twin型透射电子显微镜获得。脂质体的流体力学粒径由malvernnanosizer型激光粒径测定仪测得。分离纯化由waters制备液相色谱仪(waterse2695色谱泵,xbridgec185μm19*250mm色谱柱,waters2998紫外检测器)完成。升温曲线由ai150-15-m型红外热成像仪和mdl-n-670型激光器测得。
实施例1:聚乙二醇化光敏分子2的制备
取式2所示的光敏分子57mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐26.9mg和1-羟基苯并三唑19.0mg加入到20ml四氢呋喃与1mln,n-二甲基甲酰胺的混合溶剂中,密封,室温下反应2h。然后,将36.7mggflg短肽(甘氨酸-苯丙氨酸-亮氨酸-甘氨酸)溶于2ml四氢呋喃中制成混合溶液,再将此混合溶液加入到上述反应溶液中,继续在室温下密闭反应24h。旋转蒸发除去有机溶剂,所得物质溶解于甲醇,制备液相色谱进行分离纯化,乙醚沉淀结晶,即得gflg修饰的光敏分子2。取50mggflg修饰的光敏分子2、11.6mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和8.12mg1-羟基苯并三唑加入到20ml四氢呋喃与1mln,n-二甲基甲酰胺的混合溶剂中,室温下反应2h,然后将氨基化聚乙二醇单甲醚400mg和无水三乙胺10μl溶于10ml二氯甲烷中制成混合溶液,再将此混合溶液加入到上述反应溶液中,继续在室温下密闭反应24h。旋转蒸发除去有机溶剂,利用制备液相色谱进行分离纯化,乙醚沉淀结晶,即得聚乙二醇化光敏分子2。
实施例2:聚乙二醇化光敏分子3的制备
取式3所示的光敏分子68mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐26.9mg和1-羟基苯并三唑19.0mg加入到20ml四氢呋喃与1mln,n-二甲基甲酰胺的混合溶剂中,密封,室温下反应2h。然后将54.6mg脯氨酸-亮氨酸-甘氨酸-亮氨酸-丙氨酸-甘氨酸(plglag)溶于2ml四氢呋喃中制成混合溶液,再将此混合溶液加入到上述反应溶液中,继续在室温下密闭反应24h。旋转蒸发除去有机溶剂,所得物质溶解于甲醇,制备液相色谱进行分离纯化,乙醚沉淀结晶,即得plglag化的光敏分子3,然后取67.7mgplglag化的光敏分子2、11.6mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和8.12mg1-羟基苯并三唑加入到20ml四氢呋喃与1mln,n-二甲基甲酰胺的混合溶剂中,密封,室温下反应2h,然后,将氨基化聚乙二醇单甲醚400mg和无水三乙胺10μl溶于10ml二氯甲烷中制成混合溶液,再将此混合溶液加入到上述反应溶液中,继续在室温下密闭反应24h。旋转蒸发除去有机溶剂,所得物质溶解于甲醇,制备液相色谱进行分离纯化,乙醚沉淀结晶,即得聚乙二醇化光敏分子3。
实施例3:聚乙二醇化光敏分子4的制备
取式4所示的光敏分子50mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐26.9mg和1-羟基苯并三唑19.0mg加入到20ml四氢呋喃与1mln,n-二甲基甲酰胺的混合溶剂中,密封,室温下反应2h。然后,将氨基化聚乙二醇单甲醚421mg和无水三乙胺12μl溶于10ml二氯甲烷中制成混合溶液,再将此混合溶液加入到上述反应溶液中,继续在室温下密闭反应24h。旋转蒸发除去有机溶剂,所得物质溶解于甲醇,制备液相色谱进行分离纯化,乙醚沉淀结晶,即得聚乙二醇化光敏分子4。
图1所示为实施例3制得的聚乙二醇化光敏分子4的质谱图,结果显示合成产物的分子量为5574,与目标产物相符。
实施例4:光控温敏脂质体的制备
将70.0mg二棕榈酰磷脂酰胆碱(dppc)、25.0mg二硬脂酰磷脂酰胆碱(dspc)、9.5mg胆固醇和30.0mg实施例1制得的聚乙二醇化光敏分子2,加入到500ml圆底烧瓶中,加入10ml混合溶剂(氯仿/甲醇体积比=9:1)溶解。旋转蒸发直至上述原料在瓶壁上形成均匀薄膜层。加入5ml的ph=7.4的pbs缓冲溶液,60℃下充分旋转震荡水化,超声,之后依次用孔径为100nm和50nm的微孔滤膜各挤出20次,即得光控温敏脂质体。
实施例5:包载疏水性化疗药物的光控温敏脂质体的制备
将二棕榈酰磷脂酰胆碱(dppc)70.0mg、二硬脂酰磷脂酰胆碱(dspc)25.0mg、胆固醇9.5mg、实施例3制得的聚乙二醇化光敏分子430.0mg和紫杉醇20.0mg加入到500ml圆底烧瓶中,加入10ml混合溶剂(氯仿/甲醇体积比=9:1)溶解。旋转蒸发直至上述原料在瓶壁上形成均匀薄膜层且完全除去有机溶剂。加入5ml的ph=7.4的pbs缓冲溶液,60℃下充分旋转震荡水化,超声,之后依次用孔径为100nm和50nm的微孔滤膜各挤出20次后,用截留分子量为7000da的透析袋(购自上海绿鸟科技发展有限公司),在去离子水中透析12h,即得包载紫杉醇的光控温敏脂质体。
实施例6:包载亲水性化疗药物的光控温敏脂质体的制备
将二棕榈酰磷脂酰胆碱(dppc)70.0mg、二硬脂酰磷脂酰胆碱(dspc)25.0mg、胆固醇9.5mg、实施例3制得的聚乙二醇化光敏分子430.0mg加入到500ml圆底烧瓶中,加入10ml混合溶剂(氯仿/甲醇体积比=9:1)溶解。旋转蒸发直至上述原料在瓶壁上形成均匀薄膜层且完全除去有机溶剂。加入5ml的硫酸铵(300mm)水溶液,60℃下充分旋转震荡水化,超声,之后依次用孔径为100nm和50nm的微孔滤膜各挤出20次后,用截留分子量为7000da的透析袋(购自上海绿鸟科技发展有限公司),在去离子水中透析12h。透析完毕后将溶液转移至ep管内,升温至65℃,加入含有15mg盐酸阿霉素的水溶液1ml,65℃恒温15min,去离子水透析除去游离的盐酸阿霉素,即得包载盐酸阿霉素的光控温敏脂质体。
实施例7:包载疏水性和亲水性化疗药物的光控温敏脂质体的制备
将二棕榈酰磷脂酰胆碱(dppc)70.0mg、二硬脂酰磷脂酰胆碱(dspc)25.0mg、胆固醇9.5mg、实施例3制得的聚乙二醇化光敏分子430.0mg和紫杉醇20mg加入到500ml圆底烧瓶中,加入10ml混合溶剂(氯仿/甲醇体积比=9:1)溶解。旋转蒸发直至上述原料在瓶壁上形成均匀薄膜层且完全除去有机溶剂。加入5ml的硫酸铵(300mm)水溶液,60℃下充分旋转震荡水化,超声,之后依次用孔径为100nm和50nm的微孔滤膜各挤出20次后,用截留分子量为7000da的透析袋(购自上海绿鸟科技发展有限公司),在去离子水中透析12h。升温至65℃,加入含有15mg盐酸阿霉素的水溶液1ml,65℃恒温15min,去离子水透析纯化,即得包载紫杉醇和盐酸阿霉素的光控温敏脂质体。
如图5所示,实施例7制得的光控温敏脂质体的流体力学粒径为30-200nm,透射电镜显示其能够在水中形成直径为约50nm的球形粒子。
实施例8:光控升温效果评价
将实施例7中制备的包载紫杉醇和盐酸阿霉素的光控温敏脂质体依次梯度稀释至溶液中光敏分子的浓度为50.0μg/ml、25.0μg/ml、12.5μg/ml、6.25μg/ml和3.13μg/ml,各取稀释溶液50μl置于ep管中,用670nm激光器以400mw功率照射上述稀释溶液,利用红外热成像仪记录60秒内的升温曲线。
结果如图6所示,实施例7制得的光控温敏脂质体具有显著的升温效果,并与光敏分子的浓度正相关。
实施例9:药物释放的评价
将实施例6中制备的包载盐酸阿霉素的光控温敏脂质体分为5组,一组不经任何处理作为空白对照,其中两组各取100μl于ep管中,分别置于37℃和45℃的水浴中保温0.5min、1min、2min、3min、5min。另外两组各取100μl于ep管中,用670nm激光器分别以300mw和400mw的功率下照射0.5min、1min、2min、3min、5min。将上述处理后的样品以及100μl空白对照用ph=7.4的磷酸缓冲溶液稀释至4ml,超滤收集脂质体释放的阿霉素,利用酶标仪测定浓度,计算阿霉素累积释放量。
结果如图7所示,在45℃水浴保温5min后,阿霉素的累积释放率为57%;而当用400mw的激光照射5min后,阿霉素的累积释放率可达95%,为水浴控温释放量的1.67倍,表明本发明的光控温敏脂质体的累积释放率大大高于普通温敏脂质体。
实施例10.细胞评价
用细胞培养基rpim1640(含10%血清)将实施例5-7中制备的光控温敏脂质体稀释至光敏分子的浓度为0.2μg/ml。将4t1细胞接种于96孔细胞培养板中,每孔加入0.1ml含10%血清细胞培养基rpim1640。24h后换液,加入含有上述4种脂质体的细胞培养基。再将癌细胞避光孵育24h后,用670nm激光以150mw、200mw、300mw和400mw功率照射1min,之后放置培养箱中继续孵育12h,利用mtt法测定细胞代谢活性。
结果如图8所示,将实施例7制得的包载紫杉醇和盐酸阿霉素的光控温敏脂质体的样本用670nm激光以400mw功率照射1min后,癌细胞存活率仅为18%,表明本发明的包载疏水性和亲水性化疗药物的光控温敏脂质体可显著抑制肿瘤细胞的生长。
- 还没有人留言评论。精彩留言会获得点赞!