过敏性鼻炎动物模型的构建方法与流程
本专利涉及新药研发、药效评价技术和实验动物技术领域,特别的,涉及一种天然蛋白过敏性鼻炎小鼠模型的构建。
背景技术:
过敏性鼻炎即变应性鼻炎(allergicrhinitis,ar),是指特应性个体接触变应原后,主要由ige介导的介质(主要是组胺)释放,并有多种免疫活性细胞和细胞因子等参与的鼻黏膜非感染性炎性疾病。其发生的必要条件有3个:特异性抗原即引起机体免疫反应的物质;特应性个体,即所谓过敏体质的个体;特异性抗原与特应型个体二者相遇。过敏性鼻炎是一个全球性健康问题,可引起睡眠紊乱、食欲减退、全身乏力、疲劳、情绪失调、注意力减退和学习障碍等症状,并继发多种呼吸系统疾病,严重者可导致劳动力丧失。
根据2008年版“过敏性鼻炎及其对哮喘的影响”(allergicrhinitisanditsimpactonasthma,aria)的数据,保守估计全球的ar患者超过5亿,其中,欧洲和北美超过1亿,亚太地区超过1.5亿,印巴及周边地区超过1亿,中南美洲超过7.5千万,非洲超过3千万,其他国家超过1亿。ar在患病率较低的国家和地区呈上升趋势,而在患病率较高地区较平稳,甚至下降。根据中心城市自报患病率,保守估计我国ar实际患者应在5千万以上。
过敏性鼻炎的发病率高,发病机制复杂,因此建立一种既能反应过敏性鼻炎典型症状,又能反映其病理生理改变的动物模型,有助于对其发病机制的阐述以及治疗性药物的开发。目前对ar动物模型也已有一定的研究,现阶段常用的ar动物模型动物有豚鼠、balb/c小鼠、c57bl/6小鼠、wistar大鼠、新西兰兔等动物,其中豚鼠是最早用来建立ar模型的动物,虽然豚鼠属于易致敏动物,但是其过敏性模型的制备需要消耗大量的变应原;对变应原的选择方面目前还主要是甲苯-2,4二异氰酸酯(tdi)、ova、艾蒿花粉、豚草花粉、雪松花粉、真菌变应原、蛔虫变应原、蟑螂变应原及血吸虫蛋白抗原等(李萌、魏肖云等人,变应性鼻炎动物模型的研究现状)、(冯纬纭、谢芳,变应性鼻炎动物模型造模综述)、(赵宇、c.andrewvanhasselt、吴港生等人,卵白蛋白经鼻致敏建立变应性鼻炎动物模型)。然而,对于最重要的变应原之一——尘螨,还没有成功建立ar动物模型的报道。
尘螨是最重要的过敏原之一,普遍存在于室内外,是一种普通存在的生物,肉眼一般看不见。1964年荷兰医学生物学家voorhorst和spieksma证明尘螨是屋尘中最强烈的过敏原,继后70-80年代,西欧、美国、日本等相机研究报道,肯定尘螨是一种分布广泛、最为重要 的室内过敏原。国际上一致认为在不同的地理位置和生活环境,优势螨种分布也有不同,但是在全世界范围内,居室内最优势的螨是粉尘螨和户尘螨。我国男性占前4位的过敏原依次为粉尘螨、户尘螨、艾蒿、德国小蠊,女性依次为粉尘螨、户尘螨、艾蒿和藜。
由于不同变应原的免疫原性等性质的差异,不同动物致敏后的ar症状不尽相同,因此采用不同的变应原针对不同的模型动物构建ar模型的方法并不具有统一性。此外,ar动物模型一般包括致敏和激发两个阶段,但由于变应原的不同,致敏和激发的最优条件往往差异很大。其中致敏次数、致敏剂量、激发剂量、激发方式对小鼠ar模型的成模率和稳定性有较大的影响,本专利期望通过对上述条件的系统优化,找到一种构建尘螨变应原蛋白提取物为变应原的小鼠ar模型的有效方法。
技术实现要素:
本发明的技术方案提供一种过敏性鼻炎动物模型,它利用尘螨变应原蛋白提取物作为变应原,以腹腔注射致敏,滴鼻激发的方式,建立小鼠的过敏性鼻炎模型。
本发明首先提供一种过敏性鼻炎(ar)动物模型的构建方法,包括致敏步骤和激发步骤,所述方法以尘螨变应原蛋白提取物进行致敏和激发,所述动物为balb/c小鼠。
优选的,所述尘螨变应原蛋白提取物用于致敏步骤时,还包含al(oh)3佐剂。
优选的,过敏性鼻炎(ar)动物模型的构建方法,包括下列步骤:
1.选取balb/c小鼠,适应性饲养;
2.致敏步骤:进行腹腔注射尘螨变应原蛋白提取物及al(oh)3佐剂,致敏阶段尘螨变应原蛋白提取物剂量为10μg/只~225μg/只;
3.激发步骤:以尘螨变应原蛋白提取物滴鼻激发,为连续7天、每天1次,激发阶段尘螨变应原蛋白提取物剂量是致敏阶段剂量的2倍。
作为优选,致敏阶段进行4次腹腔注射,每次间隔7天。
所述尘螨变应原是粉尘螨变应原或户尘螨变应原。
所述尘螨变应原是天然变应原或重组变应原。
优选的,致敏步骤用的所述致敏溶液通过以下制备得到:称取尘螨变应原蛋白提取物粉末,pbs溶解,加入一定量的al(oh)3佐剂,最后以pbs定容al(oh)3的含量为1%,配制成尘螨变应原蛋白提取物溶液;激发步骤用的激发溶液通过以下制备得到:称取尘螨变应原蛋白提取物粉末,pbs溶解,最后以pbs定容,配制成尘螨变应原蛋白提取物溶液。
激发后小鼠进行鼻部症状观察及评分,并检测血清中ige、igg含量。可见尘螨蛋白致敏组动物的鼻部症状评分明显高于阴性对照组,出现明显的过敏性鼻炎症状;血清中ige、igg 含量与阴性对照组相比极显著升高。
同时,本发明还提供一种尘螨变应原蛋白提取物用于诱导动物发生过敏性鼻炎的应用。
优选的,所述哺乳动物为balb/c种小鼠。
本发明过敏性鼻炎(ar)动物模型的构建的有益效果在于提供了一种尘螨蛋白诱导小鼠过敏性鼻炎的方法,并通过对致敏次数、致敏剂量、激发剂量、激发方式的优化,制备出成熟稳定的小鼠ar模型。与豚鼠ar动物模型的制备相比,大大减少变应原使用量;此外,滴鼻激发与传统雾化激发的方式相比,不仅明确了激发阶段反应原的用量,也避免了反应原的浪费。本发明制备的小鼠ar模型具有低成本,操作较简便,重复性好的优点,是一种研究过敏性鼻炎较为理想的模型,为过敏性鼻炎药物的开发提供了动物模型基础。
对于本发明的具体操作步骤和流程,将在下面结合实例作出进一步的详细说明。
说明书附图
图1实施例1各组小鼠鼻部症状评分结果
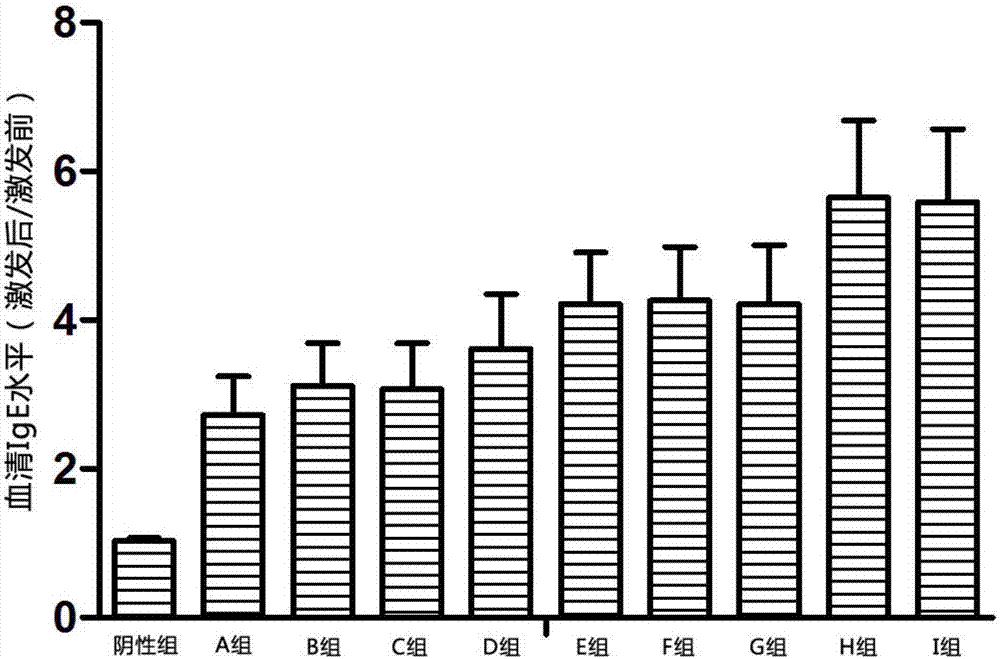
图2实施例1各组小鼠血清ige水平(激发后/激发前)结果
图3实施例2各组小鼠鼻部症状评分结果
图4实施例2各组小鼠血清ige、igg水平(激发后/激发前)结果
图5实施例3各组小鼠鼻部症状评分结果
图6实施例3各组小鼠血清ige、igg水平(激发后/激发前)结果
图7实施例4各组小鼠鼻部症状评分结果
图8实施例4各组小鼠血清ige、igg水平(激发后/激发前)结果
具体实施方式
实施例1
1.实验动物:balb/c种小鼠,spf级,雌雄各半,体重16-20g,5-6周龄,由常州卡文斯实验动物有限公司提供。环境温度22-26℃,湿度40%—70%。12小时交替光照,自由采食、饮水。spf级全价颗粒鼠粮,由江苏协同医药生物工程有限责任公司提供。
2.变应原:天然户尘螨变应原蛋白提取物,货号:lg-5449,由lsl株式会社提供。
3.致敏及激发
根据激发后小鼠鼻部症状评分及血清中ige含量,对致敏次数进行优化。
3.1动物分组:120只balb/c种小鼠按照体重随机分为10组,每组12只,分别为阴性对照组、a组(2次致敏,激发剂量为致敏剂量的1倍)、b组(2次致敏,激发剂量为致敏剂 量的2倍)、c组(2次致敏,激发剂量为致敏剂量的4倍)、d组(3次致敏,激发剂量为致敏剂量的1倍)、e组(3次致敏,激发剂量为致敏剂量的2倍)、f组(3次致敏,激发剂量为致敏剂量的4倍)、g组(4次致敏,激发剂量为致敏剂量的1倍)、h组(4次致敏,激发剂量为致敏剂量的2倍)、i组(4次致敏,激发剂量为致敏剂量的4倍)。分组方案详见表1。
3.2致敏、激发溶液配制。
致敏溶液的配制:按照各组剂量要求称取天然户尘螨变应原蛋白提取物粉末,pbs溶解,加入一定量的al(oh)3佐剂,最后以pbs定容,配制成al(oh)3的含量为1%(质量百分比)、天然户尘螨变应原蛋白提取物浓度为375μg/ml的致敏溶液。
激发溶液的配制:按照各组剂量要求称取天然户尘螨变应原蛋白提取物粉末,pbs溶解,最后以pbs定容,配制成天然户尘螨变应原蛋白提取物浓度分别为1.875mg/ml、3.75mg/ml、7.5mg/ml的激发溶液。
3.3致敏:各组小鼠于对应的致敏时间腹腔注射200μl对应注射液,对照组注射相同体积的pbs。
3.4激发:各组小鼠于末次致敏的7d后进行激发给药,每天1次,连续7d,各组小鼠使用对应的滴鼻液各20μl滴于双侧前鼻孔,维持致敏状态。
3.5鼻部症状观察及评分:最后一次激发在滴鼻激发30分钟内观察小鼠鼻部症状。按照鼻部症状评分标准记录积分:a鼻痒:1分为轻擦鼻几次,2分为抓挠鼻、面不止,到处擦磨;b.喷嚏:1分为1次连续喷嚏1-3个,2分为1次连续喷嚏4-10个,3分为1次连续喷嚏10个以上;c.清涕:1分为清涕流至前鼻孔,2分为超过前鼻孔,3分为流涕满面。记录结果以叠加法记总分,总分>5分者,动物模型建立成功。
3.6血清中ige含量:小鼠致敏前眼眶采血,离心(1000g,10分钟)制备血清,置于-80℃ 保存,用于自身对照。小鼠激发出现致敏症状后,致敏组和阴性对照组小鼠采血,离心(1000g,10分钟)制备血清,置于-80℃保存。以天然户尘螨变应原蛋白作为抗原,采用酶联免疫吸附法(elisa)检测ige含量。
4结果:
致敏阶段给予4次致敏与2次或3次致敏相比,小鼠的鼻部症状评分与血清ige水平均较高,具有显著或极显著差异;激发阶段给予小鼠2倍或4倍于致敏剂量的天然户尘螨变应原蛋白提取物的组,与给予小鼠1倍于致敏剂量的天然户尘螨变应原蛋白提取物的组相比,鼻部症状评分与血清ige水平均较高,而激发阶段给予小鼠4倍于致敏剂量的天然户尘螨变应原蛋白提取物的组与2倍剂量组相比,鼻部症状评分与血清ige水平相近,无显著变化。详见表2、图1、图2。
注:同列数据肩标大写字母完全不同的,表示差异显著(p<0.01),有任何相同大写字母的表示差异不显著(p>0.01);同列数据肩标小写字母完全不同的,表示差异显著(p<0.05),有任何相同小写字母的表示差异不显著(p>0.05)。
依据以上结果,在建立小鼠ar模型的过程中,将致敏次数优化为4次,激发剂量优化为致敏剂量的2倍,增强致敏效果的同时减少了天然户尘螨变应原蛋白提取物的用量。
实施例2
1、实验方案
1.1动物分组:48只balb/c种小鼠按照体重随机分为4组,每组12只,分别为阴性对照组、低剂量天然户尘螨变应原蛋白提取物组、中剂量天然户尘螨变应原蛋白提取物组、高剂量天然户尘螨变应原蛋白提取物组,适应性饲养5天后进行实验。
1.2致敏溶液的配制:按照各组剂量要求称取天然户尘螨变应原蛋白提取物粉末,pbs溶解,加入一定量的al(oh)3佐剂,最后以pbs定容,配制成al(oh)3的含量为1%(质量百分比)、天然户尘螨变应原蛋白提取物浓度为125μg/ml、375μg/ml、1125μg/ml的致敏溶液。
激发溶液的配制:按照各组剂量要求称取天然户尘螨变应原蛋白提取物粉末,pbs溶解,最后以pbs定容,配制成天然户尘螨变应原蛋白提取物浓度为1.25mg/ml、3.75mg/ml、11.25mg/ml的激发溶液。
1.3致敏:于试验的第1天、8天、15天、22天各组小鼠腹腔注射200μl对应注射液,对照组注射相同体积的pbs,详见表3。
1.4激发:于试验的29天进行激发,每天1次,连续7天,即29天、30天、31天、32天、33天、34天、35天激发给药。各组小鼠使用对应的滴鼻液各20μl滴于双侧前鼻孔,维持致敏状态,详见表4。
1.5鼻部症状观察及评分:同实施例1。
1.6血清中ige、igg含量:小鼠致敏前眼眶采血,离心(1000g,10分钟)制备血清,置于-80℃保存,用于自身对照。小鼠激发出现致敏症状后,各组小鼠采血,离心(1000g,10分钟)制备血清,置于-80℃保存。参照elisa试剂盒说明检测ige、igg含量。
2结果:
2.1鼻部症状观察及评分:结果显示低剂量天然户尘螨变应原蛋白提取物组、中剂量天然户尘螨变应原蛋白提取物组、高剂量天然户尘螨变应原蛋白提取物组动物的鼻部症状评分明显高于阴性对照组,出现明显的过敏性鼻炎症状,详见表5、图3。
注:同列数据肩标大写字母完全不同的,表示差异显著(p<0.01),有任何相同大写字母的表示差异不显著(p>0.01)。
2.2血清中ige、igg含量:结果显示低剂量天然户尘螨变应原蛋白提取物组、中剂量天然户尘螨变应原蛋白提取物组、高剂量天然户尘螨变应原蛋白提取物组动物血清中ige、igg含量与阴性对照组相比极显著升高,详见表6。
注:同列数据肩标大写字母完全不同的,表示差异显著(p<0.01),有任何相同大写字母的表示差异不显著(p>0.01)。优化后的模型构建方法采用4次致敏、致敏剂量75ug/只、激发剂量是致敏剂量2倍,该方法相比优化前成模率提高了40%-60%,重复性能达到95%以上。
实施例3
1、实验方案
1.1动物分组:20只雌性balb/c种小鼠按照体重分层随机数字表法分为2组,每组10只,分别为阴性对照组、粉尘螨变应原蛋白提取物组,适应性饲养5天后进行实验。
1.2致敏溶液的配制:按照各组剂量要求称取天然粉尘螨变应原蛋白提取物粉末,pbs溶解,加入一定量的al(oh)3佐剂,最后以pbs定容(al(oh)3的含量为1%),配制成天然粉尘螨变应原蛋白提取物浓度为100μg/ml的致敏溶液。
激发溶液的配制:按照各组剂量要求称取天然粉尘螨变应原蛋白提取物粉末,pbs溶解,最后以pbs定容,配制成天然粉尘螨变应原蛋白提取物浓度为666.7μg/ml的激发溶液。
1.3致敏:于试验的第1天、8天、15天、22天各组小鼠腹腔注射100μl对应注射液,对照组注射相同体积的pbs,详见表7。
1.4激发:于试验的29天进行激发,每天1次,连续7天,即29天、30天、31天、32天、33天、34天、35天激发给药。各组小鼠使用对应的滴鼻液各15μl滴于双侧前鼻孔,维持致敏状态,详见表8。
1.5鼻部症状观察及评分:同实施例1。
1.6血清中ige、igg含量:小鼠致敏前眼眶采血,离心(1000g,10分钟)制备血清,置于-80℃保存,用于自身对照。小鼠激发出现致敏症状后,各组小鼠采血,离心(1000g,10分钟)制备血清,置于-80℃保存。参照elisa试剂盒说明检测ige、igg含量。
2结果:
2.1鼻部症状观察及评分:结果显示粉尘螨变应原蛋白提取物组动物的鼻部症状评分明显高于阴性对照组,出现明显的过敏性鼻炎症状,详见表9、图5。
注:**表示与阴性对照组相比差异显著(p<0.01)。
2.2血清中ige、igg含量:结果显示粉尘螨变应原蛋白提取物组动物血清中ige、igg含量与阴性对照组相比极显著升高,详见表10。
注:**表示与阴性对照组相比差异显著(p<0.01)。
优化后的模型构建方法采用4次致敏、致敏剂量10ug/只、激发剂量是致敏剂量2倍,该方法相比优化前成模率提高了50%以上,重复性能达到95%以上。
实施例4
1、实验方案
1.1动物分组:24只balb/c种小鼠按照体重随机分为2组,每组12只,分别为阴性对照组、重组户尘螨变应原蛋白(genbank:p08176.2)组,适应性饲养5天后进行实验。
1.2致敏溶液的配制:按照各组剂量要求称取重组尘螨变应原蛋白粉末,pbs溶解,加入一定量的al(oh)3佐剂,最后以pbs定容,配制成al(oh)3的含量为1%(质量百分比)、重组户尘螨变应原蛋白提取物浓度为250μg/ml的致敏溶液。
激发溶液的配制:按照各组剂量要求称取重组户尘螨变应原蛋白粉末,pbs溶解,最后以pbs定容,配制成重组户尘螨变应原蛋白浓度为2.5mg/ml的激发溶液。
1.3致敏:于试验的第1天、8天、15天、22天各组小鼠腹腔注射200μl对应注射液,对照组注射相同体积的pbs,详见表11。
1.4激发:于试验的29天进行激发,每天1次,连续7天,即29天、30天、31天、32天、33天、34天、35天激发给药。各组小鼠使用对应的滴鼻液各20μl滴于双侧前鼻孔,维持致敏状态,详见表12。
1.5鼻部症状观察及评分:同实施例1。
1.6血清中ige、igg含量:小鼠致敏前眼眶采血,离心(1000g,10分钟)制备血清,置于-80℃保存,用于自身对照。小鼠激发出现致敏症状后,各组小鼠采血,离心(1000g,10分钟)制备血清,置于-80℃保存。参照elisa试剂盒说明检测ige、igg含量。
2结果:
2.1鼻部症状观察及评分:结果显示重组户尘螨变应原蛋白组动物的鼻部症状评分明显高于阴性对照组,出现明显的过敏性鼻炎症状,详见表12、图7。
注:**表示与阴性对照组相比差异显著(p<0.01)。
2.2血清中ige、igg含量:结果显示重组户尘螨变应原蛋白组动物血清中ige、igg含量与阴性对照组相比极显著升高,详见表13、图8。
注:**表示与阴性对照组相比差异显著(p<0.01)。
优化后的模型构建方法采用4次致敏、致敏剂量50ug/只、激发剂量是致敏剂量2倍,该方法相比优化前成模率提高了60%-70%,重复性能达到95%以上。
- 还没有人留言评论。精彩留言会获得点赞!