β‑葡聚糖与影响肿瘤微环境的抗癌剂的组合的利记博彩app
本申请要求于2014年7月10日提交的序列号为62/022,754、2014年11月6日提交的序列号为62/076,094、2015年2月13日提交的序列号为62/115,895和2015年4月20日提交的序列号为62/149,892的美国临时专利申请的优先权,所有这些申请都通过引用而并入本文。
背景技术:
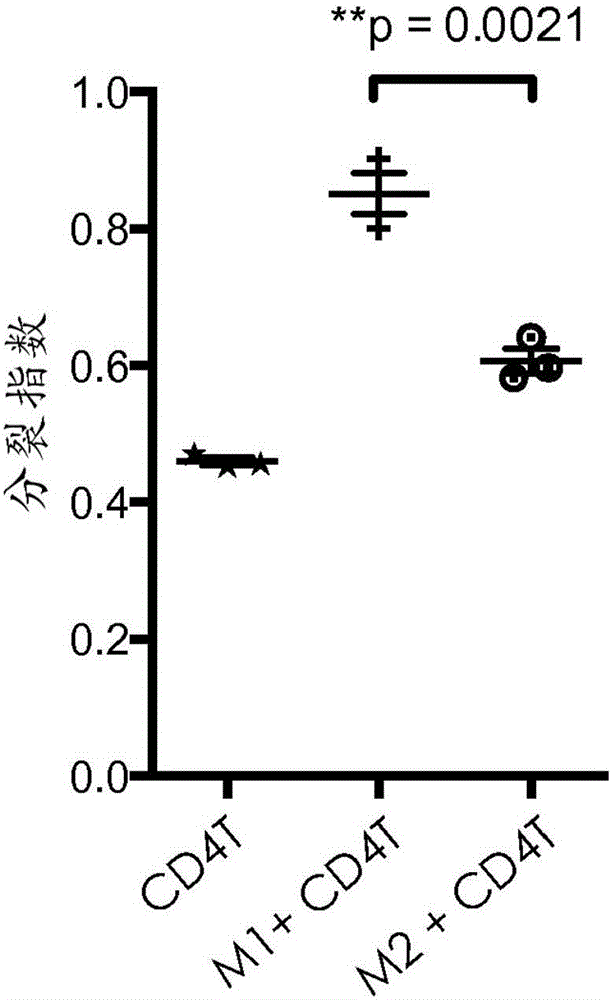
:本发明涉及可溶性β-葡聚糖与包括减轻免疫抑制的抗癌剂在内的影响肿瘤微环境的抗癌剂的组合。β-葡聚糖为真菌PAMP,并且被血清中的模式识别分子C3以及在包括嗜中性粒细胞和单核细胞在内的先天性免疫细胞上的模式识别受体——补体受体3(CR3)识别。来源于酵母的多糖β-葡聚糖——β-葡聚糖(β(1,6)-[聚-(1,3)-D-吡喃葡萄糖基]-聚-β(1,3)-D-吡喃葡萄糖)正在作为与抗肿瘤单克隆抗体组合用于治疗若干种癌症的免疫治疗剂进行研发。β-葡聚糖使得先天性免疫效应细胞能够通过补体CR3依赖性机制杀死补体包被的肿瘤细胞。许多动物肿瘤模型已经证明,与单独的任一药剂相比,可溶性β-葡聚糖与补体激活性、肿瘤靶向性抗体的联合施用导致显著降低的肿瘤生长和改善的总体存活率。然而,癌症不仅仅是大量的恶性细胞,其还是募集并利用许多其他非转化细胞的复杂“器官”。恶性细胞与非转化细胞之间的相互作用产生肿瘤微环境(TME)。TME中的非恶性细胞在癌发生的各个阶段具有动态且多为肿瘤促进性的功能。细胞因子、趋化因子、生长因子和炎症因子以及基质重塑酶的复杂且动态的网络驱动受影响组织内的细胞间通讯。因此,为了有效对抗癌症,必须开发出抑制TME的肿瘤促进性质的疗法。技术实现要素:在一个方面,本公开内容描述了可溶性β-葡聚糖与影响肿瘤微环境的抗癌剂组合的用途和组合物。以上对本发明的概述并非旨在描述本发明的每一个公开的实施方案或每一次实施。下面的描述更具体地举例说明了说明性的实施方案。在整个申请中的若干部分,通过实例列表提供了指导,这些实例可以以各种组合的方式来使用。在每种情况下,所记载的列表仅用作代表性的组,而不应被解释为排他性列表。附图说明图1A-1D.体外培养的人M1和M2巨噬细胞的形态和功能表征。图2A-2D.可溶性β-葡聚糖处理的M2巨噬细胞的形态、表型和功能表征。图3A-3D.在β-葡聚糖处理的来自强结合者和弱结合者的M1和M2巨噬细胞中,CD4T细胞增殖以及对IFN-γ和IL-4产生的调节的评估。图4.在免疫抑制条件下,β-葡聚糖处理的M2和M2a巨噬细胞中的T细胞增殖和IFN-γ调节的评估。图5A-5E.在Treg的存在下β-葡聚糖对CD4/CD8T细胞增殖和活化作用的评估。图6A-6B.体外培养的人未成熟单核细胞来源的树突细胞(imMoDC)和成熟单核细胞来源的树突细胞(mMoDC)的表征。图7A-7D.β-葡聚糖对MoDC成熟的影响的评估。图8A-8C.由于细胞-细胞接触而导致的M2-β-葡聚糖增加CD4T细胞增殖的结果。图9.由于可溶性因子而导致的M2-β-葡聚糖增加CD4T细胞增殖的结果。图10.强结合者与弱结合者中β-葡聚糖处理的M2巨噬细胞的分析。图11A-11B.在来自强结合者的血清的存在下,来源于弱结合者的单核细胞的M2-β-葡聚糖的功能评估结果。图12A-12B.在免疫抑制细胞因子(TCM)的存在下培养的β-葡聚糖处理的M2巨噬细胞上的PD-L1上调。图13.MiaPaCa中的PD-L1上调。图14A-14B.可溶性β-葡聚糖对骨髓来源的抑制细胞(MDSC)的影响。图15.肿瘤细胞上的β-葡聚糖诱导的PD-L1表达的评估。图16.采用IMPRIMEPGG与DC101抗体组合的小鼠研究的结果。图17A-17C.可溶性β-葡聚糖和贝伐珠单抗(bevicizumab)对肿瘤微环境的体内影响。具体实施方式β-葡聚糖是来源于包括例如酵母、细菌、藻类、海藻、蘑菇、燕麦和大麦在内的多种微生物和植物源的葡萄糖聚合物。其中,已经对酵母β-葡聚糖就其免疫调节性质进行了广泛研究。酵母β-葡聚糖可以以多种形式存在,例如,完整酵母、酵母聚糖、纯化的全葡聚糖颗粒、溶解的酵母聚糖多糖或不同分子量的高度纯化的可溶性β-葡聚糖。在结构上,酵母β-葡聚糖由排列为β-(1,3)-连接的吡喃葡萄糖骨架的葡萄糖单体和经由β-(1,6)糖苷键连接至该骨架上的周期性β-(1,3)吡喃葡萄糖分支构成。不同形式的酵母β-葡聚糖可以彼此不同地发挥作用。酵母β-葡聚糖发挥其免疫调节作用的机制可受到不同形式的β-葡聚糖之间的结构差异例如其颗粒或可溶性性质、三级构象、主链长度、侧链长度和侧链频率的影响。酵母β-葡聚糖的免疫刺激功能还依赖于在不同物种的不同细胞类型中所涉及的受体,该受体也可依赖于β-葡聚糖的结构性质。通常,β-葡聚糖免疫疗法可包括向受试者施用任何适宜形式的β-葡聚糖或两种或更多种形式的β-葡聚糖的任意组合。适宜的β-葡聚糖以及适宜的β-葡聚糖从其天然来源的制备在例如公开号为US2008/0103112A1的美国专利申请中描述。在一些情况下,β-葡聚糖可以来源于酵母,例如酿酒酵母(Saccharomycescerevisiae)。在某些情况下,β-葡聚糖可以是或衍生自β(1,6)-[聚-(1,3)-D-吡喃葡萄糖基]-聚-β(1,3)-D-吡喃葡萄糖,其在本文中也称为PGG(IMPRIMEPGG,Biothera,Eagan,MN),为酵母来源的可溶性β-葡聚糖的一种高度纯化且充分表征的形式。此外,基于β-葡聚糖的免疫疗法可涉及使用例如修饰的和/或衍生的β-葡聚糖,如申请号为PCT/US12/36795的国际专利申请中描述的那些。在其他情况下,β-葡聚糖免疫疗法可涉及施用例如颗粒状可溶性β-葡聚糖或颗粒状可溶性β-葡聚糖制品,它们在例如第7,981,447号美国专利中均有描述。抗癌免疫治疗药物通过多种方式杀死癌细胞:1)先天性免疫细胞的直接激活,2)适应性免疫细胞的直接激活,3)通过使肿瘤细胞更具免疫原性或通过摧毁肿瘤诱导的免疫抑制而对先天性和适应性免疫细胞的间接激活。越来越多的证据表明,肿瘤微环境(TME)下的骨髓细胞,包括M2巨噬细胞、N2嗜中性粒细胞和骨髓来源的抑制细胞(MDSC),通过直接引起细胞毒性T细胞的功能性耗竭或通过间接增加T调节细胞(Treg)的抑制能力而在免疫抑制中起到关键作用。这导致TME中免疫刺激与免疫抑制平衡出现偏移。TME的免疫刺激环境主要受细胞毒性T细胞和NK细胞、细胞溶解和诱导吞噬的M1巨噬细胞、细胞毒性N1嗜中性粒细胞、诱导体液应答的B细胞以及抗原呈递免疫原性树突细胞(DC)的存在而影响。免疫刺激细胞因子和趋化因子如干扰素γ(IFN-γ)、白介素-12(IL-12)、肿瘤坏死因子-α(TNF-α)等是免疫刺激活性的关键协调物。使得TME的免疫抑制性质发生偏移的重要参与者为抗炎Th2细胞、N2嗜中性粒细胞、M2巨噬细胞、Treg和致耐受性DC。免疫抑制性细胞因子和趋化因子如转化生长因子-β(TGF-β)、白介素-10(IL-10)、巨噬细胞集落刺激因子(M-CSF)、白介素-4(IL-4)等是免疫抑制活性的关键协调物。凭借与骨髓来源的细胞(即嗜中性粒细胞和单核细胞)上的CD11b结合的病原体相关分子模式(PAMP),可溶性β-葡聚糖与N1嗜中性粒细胞和M1巨噬细胞结合并增加它们的免疫刺激功能,并且降低MDSC、N2嗜中性粒细胞和M2巨噬细胞的免疫抑制功能。这种调节导致TME中不同的先天性和适应性细胞亚群之间的交互(cross-talk),并最终使平衡朝免疫刺激方向倾斜。更具体地,一旦与外周血单核细胞结合,可溶性β-葡聚糖就在M1/抗致瘤性极化相比M2/促致瘤性极化条件下调节单核细胞向巨噬细胞的分化,使得M1极化得到增强从而增加巨噬细胞免疫刺激功能,而M2极化得到抑制从而降低巨噬细胞免疫抑制功能。可溶性β-葡聚糖直接影响M2复极化为M1表型并驱动Th1极化,并且即使在Treg的存在下,可溶性β-葡聚糖引发的先天性免疫细胞产生细胞因子以间接影响CD4和CD8T细胞增殖,并最终驱动Th1极化。可溶性β-葡聚糖通过已知将先天性和适应性免疫应答联系起来的两个先天性细胞亚群(单核细胞来源的巨噬细胞和树突细胞)而引发适应性免疫应答,并将会上调在单核细胞来源的巨噬细胞和树突细胞两者上的PD-L1表达。尽管PD-L1上调,但可溶性β-葡聚糖处理的单核细胞来源的巨噬细胞和树突细胞使T细胞活化和增殖增强,并且由可溶性β-葡聚糖引发的协调的免疫应答引起类似于适应性免疫抗性的肿瘤反应,即PD-L1表面表达的上调。可溶性β-葡聚糖可与非补体激活性、肿瘤靶向性减轻免疫抑制的MAb组合。例如,可溶性β-葡聚糖可在包括黑素瘤、肾细胞癌、肺癌等若干种癌症的治疗中与抗PD-L1免疫检查点抑制剂(Fc-工程化的IgG1MAb)进行组合。已报道,抗-PD1/PD-L1抗体的效力依赖于肿瘤上PD-L1的表达水平。肿瘤上PD-L1表达的机制之一被称为适应性免疫抗性,其中由于肿瘤微环境内的免疫应答(例如,活化T细胞的干扰素γ产生)而适应性地诱导PD-L1表达。可溶性β-葡聚糖直接或间接诱导Th1极化。这种作用使PD-L1在肿瘤细胞上的表达上调,从而增强抗-PD1/PD-L1抗体的抗肿瘤活性。检验点抑制剂的实例为纳武单抗(nivolumab)和派姆单抗(pembrolizumab)。可溶性β-葡聚糖可与增强免疫共刺激的非补体激活性、非肿瘤靶向性MAb组合。例如,a)靶向树突细胞的抗-CD40MAb(IgG2MAb),b)若干种癌症治疗中T细胞共刺激的增强剂:抗-OX40、抗-41BB。可溶性β-葡聚糖还可与非补体激活性、非肿瘤靶向性减轻免疫抑制的小分子以及非补体激活性、肿瘤靶向性减轻免疫抑制的小分子进行组合。其可用作癌症疫苗中的佐剂以驱动Th1极化。其可在治疗上用来减弱慢性疾病(即,TB)中的抑制机制,以加速感染的完全清除。最后,其可用来使Th2占优势的自身免疫性疾病(变态反应、哮喘、特应性疾病)中的Th2-Th1平衡向Th1极化环境方向偏移。虽然非补体激活性免疫抑制减轻剂可能是优选的,特别是对于非肿瘤靶向剂而言,但本发明也可利用补体激活性免疫抑制减轻剂来进行。一个实例可为巴维昔单抗(bavituximab)。本发明部分地包括共施用β-葡聚糖与另一种药剂,如本文所用的,该药剂可为抗体制品或小分子制品或为了影响TME而施用的任何制品。如本文所用的,“共施用”是指两种或更多种组分的组合施用,使得该组合的治疗或预防效果可大于任一组分单独施用时的治疗或预防效果。两种组分可以同时共施用或顺序地共施用。同时共施用的组分可以在一个或多个药物组合物中提供。两种或更多种组分的顺序共施用包括这样的情况,其中施用这些组分使得所有组分在施用后是同时生物可利用的。无论组分是同时共施用还是顺序地共施用,组分均可在单一部位或在不同部位处共施用。在另一方面,所述方法包括向受试者施用组合物,该组合物包含与抗体、治疗性抗体、抗肿瘤抗体或抗体片段如抗体的Fc部分缀合的β-葡聚糖部分。申请号为PCT/US12/36795的国际专利申请中描述了修饰的和/或衍生的可溶性β-葡聚糖,包括β-葡聚糖部分与抗体的β-葡聚糖缀合物,这也可应用于抗体片段的缀合物。β-葡聚糖部分可以是或衍生自β-1,3/1,6葡聚糖。在这种语境中,“衍生自”表示缀合物可能必须通过产生替换β-葡聚糖的一个或多个原子的共价键来制备。如本文所用的,“衍生自β-1,3/1,6葡聚糖”是指在替换β-葡聚糖的一个或多个原子以形成缀合物的共价键之后作为该缀合物的一部分而保留的β-葡聚糖的一部分。可将β-葡聚糖、抗体或小分子制品和/或两种组分的组合与“载体”一起配制于组合物中。如本文所用的,“载体”包括任何溶剂、分散介质、媒介物、涂料、稀释剂、抗细菌剂和/或抗真菌剂、等渗剂、吸收延迟剂、缓冲液、载体溶液、悬浮液、胶体等。这类介质和/或试剂作为药物活性物质的应用是本领域公知的。除非任何常规介质或试剂均与β-葡聚糖或抗体不相容,否则将涵盖其在治疗组合物中的应用。补充的活性成分也可掺入组合物中。“药学上可接受的”意指在生物学上或在其他方面并非不期望的物质,即,该物质可与β-葡聚糖和/或药剂一起施用至个体,而不会引起任何不期望的生物效应或不会以有害的方式与包含它的药物组合物中的任何其他组分相互作用。可将β-葡聚糖、药剂和/或两种组分的组合配制成药物组合物。在一些实施方案中,β-葡聚糖和药剂可以在单一制剂中提供。在其他实施方案中,β-葡聚糖和药剂可以在分开的制剂中提供。可将药物组合物配制成适应于一种或多种优选的给药途径的各种和/或多种形式。因此,药物组合物可经由一种或多种已知的途径来施用,包括例如口服、肠胃外(例如,皮内、经皮、皮下、肌内、静脉内、腹膜内等)或局部(例如,鼻内、肺内、乳房内、阴道内、子宫内、皮内、经皮、直肠等)给药途径。可以将药物组合物或其部分施用于粘膜表面,例如通过向例如鼻或呼吸道粘膜(例如,通过喷雾或气雾剂)施用。还可经由持续或延迟释放来施用药物组合物或其部分。制剂可以方便地以单位剂型提供,并且可通过药学领域公知的方法来制备。制备具有药学上可接受的载体的组合物的方法包括使β-葡聚糖和/或药剂与构成一种或多种辅助成分的载体相结合的步骤。通常,可通过使活性化合物与液体载体、精细粉碎的固体载体或两者均匀和/或紧密地结合,并且如果需要,然后将产物成形为所需的制剂而制备该制剂。β-葡聚糖、药剂和/或两种组分的组合可以以任何合适的形式提供,包括但不限于溶液、悬浮液、乳液、喷雾剂、气雾剂或任何形式的混合物。该组合物可以与任何药学上可接受的赋形剂、载体或媒介物一起在制剂中递送。例如,该制剂可以以常规的局部剂型来递送,例如乳膏、软膏、气雾制剂、非气雾喷雾剂、凝胶、洗剂等。该制剂可进一步包含一种或多种添加剂,包括例如佐剂、皮肤渗透促进剂、着色剂、香料、调味剂、保湿剂、增稠剂等。在一些实施方案中,β-葡聚糖可来源于酵母,例如酿酒酵母。在一些实施方案中,β-葡聚糖可包括β-1,3/1,6葡聚糖,例如,β(1,6)-[聚-(1,3)-D-吡喃葡萄糖基]-聚-β(1,3)-D-吡喃葡萄糖。在一些实施方案中,所述方法可包括施用足够的β-葡聚糖以向受试者提供例如约100ng/kg至约50mg/kg的剂量,但在一些实施方案中,可通过以该范围之外的剂量施用β-葡聚糖来实施该方法。在一些实施方案中,所述方法包括施用足够的β-葡聚糖以向受试者提供约10μg/kg至约5mg/kg的剂量,例如约4mg/kg的剂量。或者,可采用在治疗过程临开始前获得的实际体重来计算剂量。对于以这种方式计算的剂量,利用Dubois方法在治疗过程开始前计算体表面积(m2):m2=(体重kg0.425×身高cm0.725)×0.007184。因此,在一些实施方案中,所述方法可包括施用足够的β-葡聚糖以提供例如约0.01mg/m2至约10mg/m2的剂量。在一些实施方案中,所述方法可包括施用足够的能与β-葡聚糖特异性结合的抗体,以向受试者提供例如约100ng/kg至约50mg/kg的剂量,但在一些实施方案中,可通过以该范围之外的剂量施用该抗体来实施该方法。在一些实施方案中,所述方法包括施用足够的抗体以向受试者提供约10μg/kg至约5mg/kg的剂量,例如约100μg/kg至约1mg/kg的剂量。或者,可采用在治疗过程临开始前获得的实际体重来计算剂量。对于以这种方式计算的剂量,利用Dubois方法在治疗过程开始前计算体表面积(m2):m2=(体重kg0.425×身高cm0.725)×0.007184。因此,在一些实施方案中,所述方法可包括施用足够的抗体以提供例如约0.01mg/m2至约10mg/m2的剂量。在一些实施方案中,β-葡聚糖和药剂可以例如以每周单剂量到多剂量来共施用,但在一些实施方案中,可以通过以该范围之外的频率来共施用β-葡聚糖和药剂而实施该方法。在某些实施方案中,β-葡聚糖和药剂可以大约每年施用一次至每周施用一次。术语“和/或”意指所列出的要素的一个或全部,或任意两个或更多个所列出的要素的组合;术语“包括”及其变化形式在说明书和权利要求中出现时不具有限制性含义;除非另有说明,否则“一个”、“一种”、“该”和“至少一个”可互换使用,并且意指一个或超过一个;并且利用端点对数值范围的表述包括包含在该范围内的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等)。在前面的描述中,为清楚起见,可以单独地描述特定的实施方案。除非另外明确说明特定实施方案的特征与另一实施方案的特征不兼容,否则某些实施方案可包括本文关于一个或多个实施方案所描述的兼容特征的组合。对于包括离散步骤的本文公开的任何方法,这些步骤可以以任何可行的顺序进行。并且根据需要,可以同时进行两个或更多个步骤的任何组合。本发明通过以下实施例予以说明。应当理解,特定的实施例、材料、量和程序应根据本文所述的本发明的范围和精神而进行宽泛地解释。实施例实施例1体外培养的人M1和M2巨噬细胞的建立和表征:采用Ficoll梯度和磁珠分离来富集来自人全血的CD14+单核细胞。然后将所富集的单核细胞(5×105个细胞/mL)于M1-极化(补充有5%自体血清和100ng/mL重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)(R&DSystems)的XVivo10培养基(LonzaGroup))或M2-极化(补充有10%自体血清和50ng/mL重组人巨噬细胞集落刺激因子(rhM-CSF)(R&DSystems)的XVivo10培养基)条件下培养6天。在为了评价β-葡聚糖的作用而进行的实验中,首先将全血与媒介物(柠檬酸钠缓冲液)或25μg/mL可溶性β-葡聚糖在37℃下温育2小时,然后分离单核细胞并使其分化。在收集巨噬细胞以供表型分析之前检查其形态。收集第6天巨噬细胞培养物(MCM)的培养基,离心(spundown)以除去污染的细胞沉淀,然后冷冻以供随后通过ELISA进行细胞因子分析或用来建立与CD3和CD28刺激的CD4T细胞的共培养物(MCM-CD4T)以用于评估表面标志物或CD4T细胞增殖。在第6天,利用巨噬细胞建立与CD3和CD28刺激或仅CD3刺激的CD4T细胞(Mac-CD4T)的共培养物,以用于评估表面标志物调节或对CD4T细胞增殖的影响。对于Mac-CD4T细胞增殖研究,以1:10比例将M1或M2巨噬细胞与CD3和CD28刺激或仅CD3刺激的、CFSE标记的自体CD4T细胞一起培养。在实验结束时(第9天至第11天)通过流式细胞术测量T细胞增殖,并且结果以图形表示为CFSE-稀释峰。始终在第11天进行仅CD3刺激的T细胞的评估。定量结果被报告为在每个培养条件下针对三个重复孔中的每一个计算的分裂指数(群体经历的细胞分裂的平均次数)。收集Mac-CD4T共培养物的培养上清液用于随后的细胞因子分析。为了评估Mac-CD4T细胞表面标志物调节,如上所述将M2巨噬细胞与T细胞一起共培养,并在第8天、第9天和第10天收获细胞以对M2巨噬细胞和T细胞二者进行表面受体染色。对于MCM-CD4T细胞增殖研究,用50%MCM来培养CD3和CD28刺激的CFSE标记的CD4T细胞。如上所述在第11天测量T细胞增殖。收集MCM-CD4T细胞共培养物的培养上清液用于随后的细胞因子分析。如上所述进行MCM-CD4T细胞表面标志物评估。对于如上所述制备和表征的M1和M2巨噬细胞,表征了A)形态,B)表型,C)Mac-CD4T细胞增殖的功能评价,和D)共培养物中的细胞因子分析。图1A-图1C包括来自5个不同实验的代表性结果。根据文献所述,M1的形态似乎更圆,而M2则更类似于细长的成纤维细胞(图1A)。通过流式细胞术评估M1/M2特异性标志物的表达。计算了同种型对照染色和表面抗原染色的MFI中值,该结果示于表1中。表1与关于表型的文献一致,M1巨噬细胞通常表达更高水平的HLA-DR和CD274(PD-L1),而M2巨噬细胞则表达更高水平的CD163和CD14。此外,如图1B所示,与体外分化的M2巨噬细胞相比,M1巨噬细胞还明显有助于CD4T细胞增殖。随着增殖增强,在M1和CD4T细胞共培养物的上清液中观察到干扰素γ(IFN-γ)的产生增加(图1C)。用于体外培养和表征人巨噬细胞的备选方法的步骤(包括M1和M2巨噬细胞的活化(称为M1a和M2a巨噬细胞))概述如下。该方法在以下一系列实验中使用。表征了如上所述制备和表征的活化M1a和M2s巨噬细胞的形态和表型。在此示出了来自5个不同实验的代表性结果。图1D示出了M1a和M2a巨噬细胞的形态。通过流式细胞术评估M1a/M2a特异性标志物的表达。计算了同种型对照染色和表面抗原染色的MFI中值,该结果示于表2中。表2实施例2β-葡聚糖对M2至M1复极化的影响:如上所述制备来自媒介物处理的或β-葡聚糖处理的全血的M1和M2巨噬细胞。通过流式细胞术测量一组M1/M2特异性标志物(包括HLA-DR、CD163、CD206、CD209、CD80、CD86和PD-L1)的表达。β-葡聚糖预处理不影响M1巨噬细胞表型,但的确影响M2巨噬细胞表型。如图2A所示,CD163的平均荧光强度(MFI)在β-葡聚糖处理的M2巨噬细胞中下调。此外,CD86的表面表达以及PD-L1的蛋白质和mRNA水平都得到增强(图2B)。接下来,将媒介物处理的或β-葡聚糖处理的M1或M2巨噬细胞与CD3和CD28刺激的、羧基荧光素二乙酸琥珀酰亚胺酯(CFSE)标记的自体CD4T细胞一起培养,并在实验结束时通过流式细胞术来测量T细胞增殖,并将结果定量地报告为分裂指数(群体已经经历的细胞分裂的平均次数)。图2C是通过将T细胞与β-葡聚糖处理的M2巨噬细胞共培养而进行的代表性CFSE稀释T细胞增殖试验,并且结果显示出β-葡聚糖处理的M2巨噬细胞增强CD4T细胞增殖的能力。还通过ELISA测量了来自CFSE稀释T细胞增殖试验(图2B)的培养上清液的IFN-γ水平。图2D是IFN-γ水平的代表图,其显示出IFN-γ产生的伴随增加。因此,β-葡聚糖影响M2至M1复极化并驱动抗肿瘤发生的Th1极化。实施例3在来自强结合受试者和弱结合受试者的细胞中,β-葡聚糖对M2至M1复极化的影响:评估可溶性β-葡聚糖与嗜中性粒细胞和单核细胞的结合的早期研究揭示,受试者具有不同的结合能力。进一步的研究发现,可溶性β-葡聚糖与至少一些强结合受试者的免疫细胞结合,并且强结合受试者还具有更高水平的天然抗β-葡聚糖抗体。功能研究鉴定了结合的总体截止值和抗体水平,用其将受试者鉴别为强结合者(对β-葡聚糖具有高反应)和弱结合者(对β-葡聚糖具有低反应)。为此,对来源于可溶性β-葡聚糖处理的来自强结合者和弱结合者的单核细胞的M1/M2巨噬细胞进行了评估。随后评估来自强结合者和弱结合者的M1和M2巨噬细胞的A)表型,B)CD4T细胞增殖的增强,和C)IFN-γ和IL-4产生的调节。图3A-图3C示出了来自4个不同实验的代表性结果。通过流式细胞术评估了对媒介物处理的和β-葡聚糖处理的、来源于强结合者的M1和M2巨噬细胞的一组标志物的表达(对CD163评估两次)。计算了同种型对照染色和表面抗原染色的MFI中值,该结果示于表3中。表3-强结合者通过流式细胞术评估了媒介物处理的和β-葡聚糖处理的、来源于弱结合者的M1和M2巨噬细胞的CD163和CD86。计算了同种型对照染色和表面抗原染色的MFI中值,结果示于表4中。表4-弱结合者关键的结果是β-葡聚糖处理的M2巨噬细胞具有更低的CD163表达,CD163是关键的M2标志物之一。有趣的是,该结果对强结合者是特异的,因为CD163的表达在媒介物处理的和β-葡聚糖处理的M2巨噬细胞之间保持相同。接下来,评估了来源于可溶性β-葡聚糖处理的来自强结合者和弱结合者的单核细胞的M1/M2巨噬细胞增强CD3和CD28刺激的CD4T细胞增殖的能力。图3A显示了强结合者中CD4T细胞增殖试验的结果,而图3B则示出了弱结合者中的结果。在强结合者中与采用媒介物处理的M2巨噬细胞观察到的相比,β-葡聚糖处理的M2巨噬细胞具有显著更高的增强CD3和CD28刺激的CD4T细胞增殖的能力,而在弱结合者中增殖没有增强。此外,无论在强结合者中还是在弱结合者中,与媒介物处理的M2巨噬细胞相比,β-葡聚糖处理的M1巨噬细胞在该功能能力方面没有显示出差异。然后评估了对媒介物处理的和β-葡聚糖处理的M2巨噬细胞的IFN-γ和IL-4产生的调节。随着增殖增强,在强结合者(图3C)而非弱结合者(图3D)中的β-葡聚糖处理的M2巨噬细胞和CD4T细胞的共培养物中观察到IFN-γ产生显著增加,但IL-4并非如此。因此,来源于β-葡聚糖处理的单核细胞的M2巨噬细胞在强结合受试者中是M1样的。实施例4免疫抑制条件下β-葡聚糖对M2至M1复极化的影响:在免疫抑制细胞因子的存在下,对β-葡聚糖处理的M2a巨噬细胞和β-葡聚糖处理的M2巨噬细胞进行了表型和功能评估。如上所述制备M2或M2a巨噬细胞。在第3天,向M2巨噬细胞培养物添加肿瘤条件培养基(TCM)直到占培养物体积的70%,然后在第6天评估CD163表达和功能活性。已证明,来自BxPC3(一种胰腺癌细胞系)的TCM含有若干种免疫抑制细胞因子,包括M-CSF、TGF-β、IL-4等。如上所述在IL-4中培养M2a巨噬细胞。首先评估了在IL-4中培养的β-葡聚糖处理的M2a巨噬细胞和在TCM中培养的M2巨噬细胞的CD163和CD86表达。通过流式细胞术评估CD163和CD86,并计算同种型对照染色和表面抗原染色的MFI中值,该结果示于表5中。表5-免疫抑制条件如在先前使用M-CSF的M2分化实验中所见,在TCM中培养的β-葡聚糖处理的单核细胞也显示出CD163的显著下调。此外,β-葡聚糖处理的M2巨噬细胞具有更高的HLA-DR表达(数据未示出)。然后通过CD4T细胞增殖试验(每个条件重复三次或六次)对调节CD4T细胞增殖的能力进行功能评估。与采用媒介物处理的M2和M2a巨噬细胞观察到的相比,在TCM中培养的β-葡聚糖处理的M2巨噬细胞和在IL-4中培养的M2a巨噬细胞保持增强CD4T细胞增殖的能力。随着增殖增强,在巨噬细胞和CD4T细胞的共培养物中观察到IFN-γ产生的显著增加(图4)。上述实施例证明,如通过CD163表达降低、CD86表达增加以及通过M2抑制CD4T细胞增殖的能力受到抑制所证明的,可溶性β-葡聚糖具有抑制M2极化并诱导更类似于M1的细胞的能力。即使在通过存在IL-4与M-CSF或肿瘤条件培养基(TCM)的组合而模拟的免疫抑制条件下,可溶性β-葡聚糖也能够抑制M2极化并增强其帮助CD4T细胞增殖的能力。M2-可溶性β-葡聚糖对CD4T细胞增殖的增强伴随着促炎性Th1极化细胞因子IFN-γ的增加,而免疫抑制性细胞因子IL-4的产生没有变化。实施例5在Treg的存在下β-葡聚糖对CD4/CD8T细胞增殖和活化的影响:为获得血浆,用25μg/mLβ-葡聚糖或媒介物处理全血6小时、离心并取出血浆。在50,000个T细胞活化CD3/28珠子(用于T细胞扩充和活化的DYNABEADS人T-激活剂CD3/CD28)的存在下,将50,000个自体CFSE标记的PBMC于处理的血浆中培养3天。在培养结束时,用CD4和CD8将PBMC染色,并通过CFSE稀释测量T细胞增殖。如图5A中的代表性CFSE稀释图所示,与媒介物处理的对照相比,来自β-葡聚糖处理的全血的血浆提供了CD4和CD8两者增殖的显著增强。接下来,为了显示可溶性β-葡聚糖对CD4和CD8细胞活化的影响,再次进行了上述的T细胞增殖试验。但是在第3天,针对包括粒酶B产生和CD25上调在内的激活标志将细胞染色。图5B中示出的图形证明,β-葡聚糖处理的血浆增强了CD4和CD8细胞活化。当在血浆分离前将全血处理6小时的温育期时,对增殖的增强最大,表明对T细胞增殖的这种影响是间接机制(即由先天性免疫细胞的细胞因子释放)的结果。为了确定β-葡聚糖对T细胞增殖的增强是直接还是间接的,除了在添加至自体PBMC之前将来自未处理的(媒介物)全血的血浆用β-葡聚糖或媒介物处理之外,如上所述进行T细胞增殖试验。利用FLOWJO软件通过分裂指数对CFSE稀释进行定量,并以相对于媒介物对照的倍数变化作图。图5C中所示的结果表明,β-葡聚糖的增强效应由间接机制造成。由于这些PBMC培养物含有Treg,因此Treg的抑制能力似乎在可溶性β-葡聚糖的存在下而改变,并进行研究以确定β-葡聚糖是否影响了Treg抑制。将来自β-葡聚糖处理的或媒介物处理的全血的血浆(如上所述)与数目逐渐增加的分离的自体Treg(CD4+CD25+)一起添加至25,000个分离的CFSE标记的自体CD4T细胞(CD4+CD25-),产生具有逐渐提高的比例的孔。然后用50,000个T细胞活化CD3/28珠子刺激细胞3天。随后通过CFSE稀释测量增殖,并通过分裂指数将其定量,该分裂指数用来计算共培养物中Treg的%抑制。%抑制=100-(Treg孔的分裂指数/1:0孔的分裂指数)/100。结果示于图5D中。与来自媒介物处理的全血的血浆相比,来自β-葡聚糖处理的全血的血浆显示出Treg的抑制能力的显著降低。β-葡聚糖对Treg的抑制还导致增强的IFN-γ产生。如上所述进行Treg抑制试验,并且在共培养3天后,分析上清液的IFN-γ产生。图5E显示了来自以8:1的T细胞:Treg比培养的孔的IFN-γ产生的结果。总之,这些结果显示,β-葡聚糖影响CD4和CD8增殖以及Treg功能,导致抗肿瘤适应性效应子功能的增强。实施例6体外培养的人未成熟单核细胞来源的树突细胞(imMoDC)和成熟单核细胞来源的树突细胞(mMoDC)的建立和表征:鉴于巨噬细胞和树突细胞是将先天性和适应性免疫联系起来的两种关键的抗原呈递细胞类型,因此还在人单核细胞来源的树突细胞(MoDC)上评估了可溶性β-葡聚糖的表型效果和功能效果。将从可溶性β-葡聚糖处理的或媒介物处理的全血中富集的单核细胞在含有适当细胞因子GM-CSF加IL-4的培养基中培养以供树突细胞的分化。用于体外培养和表征人MoDC的方法中包括的步骤概述如下。如上所述制备的imMoDC和mMoDC于图6A中示出。mMoDC形态的特征在于存在长突起或树突。通过流式细胞术对mMoDC的CD80、CD83、CD86和HLA-DR表达进行了评估,并计算了同种型对照染色和表面抗原染色的MFI中值,该结果示于表6中。表6mMoDC显示成熟和共刺激标志物CD80、CD83、CD86以及HLA-DR的表面表达增加。此外,这些mMoDC还在同种异体混合淋巴细胞反应中显示出免疫原性(每个条件重复四次),触发CD4和CD8T细胞扩充的增加(图6B)。实施例7β-葡聚糖对MoDC成熟的影响:进行了由可溶性β-葡聚糖处理的强结合者和弱结合者的全血制备的mMoDC的表型和功能评估。如上所述制备来自强结合者和弱结合者的mMoDC。通过流式细胞术对mMoDC的CD80、CD83、CD86和HLA-DR表达进行了评估,并计算了同种型对照染色和表面抗原染色的MFI中值,该结果示于表7中。表7-mMoDCβ-葡聚糖处理的来源于强结合者的mMoDC上CD80、CD86、CD83和HLA-DR的表达增加表明这些mMoDC比来源于弱结合者的那些更成熟。β-葡聚糖处理的来源于强结合者的mMoDC还在allo-MLR中显示出免疫原性的增加(每个条件重复四次),从而再次触发相对于来源于弱结合者的细胞(图7B)增加的CD4和CD8T细胞扩充(图7A)。此外,相对来源于弱结合者的细胞和媒介物处理的mMoDC,β-葡聚糖处理的来源于强结合者的mMoDC能够调节IFN-γ产生(图7C)。来源于β-葡聚糖处理的单核细胞的MoDC即使在免疫抑制条件下也是更成熟的。如上所述制备MoDC。在第0天添加TCM直到占培养物体积的70%,并且TCM在整个培养期间都存在。随后评估在TCM存在下培养的mMoDC的表型改变。计算同种型对照染色和表面抗原染色的MFI中值,该结果示于表8中。表8-免疫抑制条件实施例8细胞-细胞接触和可溶性因子增加由β-葡聚糖处理的M2巨噬细胞引起的CD4T细胞增殖:利用CD4T细胞增殖作为读出(read-out),研究了在由β-葡聚糖处理的M2巨噬细胞引发增殖中对细胞-细胞接触或可溶性因子的要求。为了研究巨噬细胞与T细胞之间的细胞-细胞接触,当在不存在CD28共刺激的情况下与β-葡聚糖处理的M2巨噬细胞共培养时测量了CD4T细胞增殖,并在共培养物中的β-葡聚糖处理的M2巨噬细胞和T细胞二者上研究了表面活化标志物的调节。细胞-细胞接触的评估如下进行:将媒介物处理的和β-葡聚糖处理的M2巨噬细胞以及CD3和CD28刺激与仅CD3刺激的CD4T细胞共培养物用于测量CD4T细胞增殖和IFN-γ产生。如图8A所示,在不存在外源CD28抗体的情况下与CD4T细胞一起培养的β-葡聚糖处理的M2巨噬细胞表现出显著更高的增强CD4T细胞增殖的能力。随着增殖增强,在β-葡聚糖处理的M2巨噬细胞与CD4T细胞的共培养物中观察到显著增加的IFN-γ产生(图8B)。还测量了巨噬细胞以及CD3和CD28刺激的T细胞二者上表面标志物表达的变化。通过流式细胞术评估了来自共培养物的媒介物处理的和β-葡聚糖处理的M2巨噬细胞和CDT细胞对于共刺激分子或共抑制分子的调节。图8C和表9为来自2个不同实验的代表性结果。表9表面标志物巨噬细胞上MFI的变化*T细胞上MFI的变化*HLA-DR无变化NACD86增加NACD80无变化NACD28NA无变化CTLA-4NA无变化CD40无变化NACD40LNA无变化4-1BBL无变化NA4-1BBNA无变化OX40无变化NAPD1(CD279)NA增加PD-L1(CD274)增加NACD209无变化NACD172无变化NA*β-葡聚糖处理的M2巨噬细胞/T细胞上的MFI相对于在媒介物处理的M2巨噬细胞/T细胞中观察到的MFI的变化在所有测试的表面标志物中,与媒介物处理的M2巨噬细胞上所观察到的相比,在β-葡聚糖处理的M2巨噬细胞的表面上观察到CD86(第8天)和PD-L1(第9天)的表面表达的相对增加。在与β-葡聚糖处理的M2巨噬细胞共培养的T细胞的表面上观察到PD-1(第9天)表达的增加。为了确定是否需要由β-葡聚糖处理的M2巨噬细胞分泌的可溶性因子,对与β-葡聚糖处理的M2巨噬细胞MCM(50%体积)共培养的CD4T细胞增殖进行了测量,并观察了与MCM一起温育的T细胞上的表面活化标志物调节。图9代表2个不同的实验。当通过CD4T细胞增殖试验评估时,与媒介物处理的M2巨噬细胞MCM相比,与CD4T细胞一起培养的β-葡聚糖处理的M2巨噬细胞MCM表现出显著更高的增强CD4T细胞增殖的能力(图9)。此外,评估了在媒介物处理的和β-葡聚糖处理的M2巨噬细胞MCM中培养的CD4T细胞对共刺激或共抑制分子(CD80、CD28、CTLA-4、4-1BB和PD-1)的调节。令人惊讶的是,未观察到任何T细胞标志物的变化(数据未示出)。实施例9强结合者与弱结合者中β-葡聚糖处理的M2巨噬细胞的分析:如前所述,已显示,受试者中的抗β-葡聚糖抗体(ABA)阈值对β-葡聚糖免疫疗法是重要的。因此,研究了ABA阈值对β-葡聚糖调节M1/M2极化的能力的重要性。通过表型评估和功能评估确定了β-葡聚糖调节强结合者与弱结合者中的M1/M2极化的能力。制备了来自4位强结合者和4位弱结合者的M2巨噬细胞,并评估了它们调节CD4T细胞增殖的能力。通过ELISA来测量来自各种CD4T细胞增殖条件的上清液的IFN-γ。图10所示的结果是来自4个不同实验的代表。针对4位供体中的每一位,以相对于在媒介物处理的M2巨噬细胞和CD4T细胞的共培养物中产生的IFN-γ水平的倍数变化进行绘图。在弱结合者中,β-葡聚糖在M1/M2极化条件下未调节单核细胞来源的巨噬细胞上的任何表型标志物(数据未示出),并且在通过CD4T细胞增殖试验对弱结合者的功能评估中,β-葡聚糖处理的M2巨噬细胞既未增强CD4T细胞增殖也未增加IFN-γ产生。实施例10血清交叉研究:因为β-葡聚糖未能在弱结合者中显示出M1/M2极化的调节,所以在含有更高水平ABA的血清的存在下(来自强结合者的血清交叉),评估了采用来自弱结合者的单核细胞由β-葡聚糖引起的调节。为检验这一点,在进行了少许修改的情况下如上所述制备M2巨噬细胞。将弱结合者的全血离心以去除血浆,然后用从强结合者中获得的血清来重建细胞。在37℃下用媒介物或β-葡聚糖(25μg/mL)将重建的血液处理2小时。通过采用抗β-葡聚糖特异性单克隆抗体及随后采用流式细胞术来评估单核细胞的结合。然后分离全血中媒介物处理的或β-葡聚糖处理的单核细胞,并使其分化成M2巨噬细胞,并且采用上述方法使用M2细胞(数据未示出)或MCM来评估它们增强CD4T细胞增殖(每个条件重复六次)和增加IFN-γ产生的能力。弱结合者的全血中的单核细胞未与β-葡聚糖结合,但当将含有更高水平ABA的强结合者的血清添加至弱结合者的全血中时,显示出显著更高的结合(图11A)。此外,与采用媒介物处理的M2巨噬细胞上所观察到的相比,来自与强结合者的血清交叉的β-葡聚糖处理的弱结合者M2巨噬细胞的MCM具有显著更高的增强CD4T细胞增殖的能力。随着增殖增强,在β-葡聚糖处理的M2巨噬细胞与CD4T细胞的共培养物中观察到显著增加的IFN-γ产生(图11B)。实施例11在免疫抑制细胞因子(TCM)的存在下培养的β-葡聚糖处理的M2巨噬细胞上的PD-L1上调:如上所述制备单核细胞或M2巨噬细胞。在第3天,添加TCM直到占培养物体积的70%,然后评估TCM下的PD-L1表达,然后在与CD4T细胞共培养时再次评估PD-L1表达。在TCM中培养的β-葡聚糖处理的M2巨噬细胞具有更高的PD-L1表面表达(图12A)。在与CD4T细胞共培养时,表达也增加(图12B)。利用上述系统,如通过关键M2标志物CD163的表达降低以及通过M2抑制CD4T细胞增殖的能力受到抑制所证明的,确定了β-葡聚糖具有抑制M2极化的能力。即使在通过存在IL-4与M-CSF(数据未示出)或肿瘤条件培养基(TCM)的组合而模拟的免疫抑制环境下,β-葡聚糖也能够抑制M2极化并增强其帮助CD4T细胞增殖的能力。M2-β-葡聚糖对CD4T细胞增殖的增强伴随着促炎性Th1极化细胞因子IFN-γ的增加,而免疫抑制性细胞因子IL-4的产生没有变化。如随着T细胞活化和IFN-γ产生增加所预期的,观察到PD-L1在β-葡聚糖处理的M2巨噬细胞上的表面表达和PD-1在T细胞上的表面表达的增加。β-葡聚糖处理的M2巨噬细胞本身以及由该细胞分泌的可溶性因子对于增强CD4T细胞增殖是重要的。最后,β-葡聚糖仅在来自具有更高水平ABA的健康供体的细胞中抑制M2极化。实施例12MiaPaCa中的PD-L1上调:用强结合者血清和弱结合者血清培养β-葡聚糖处理的和媒介物处理的M2巨噬细胞和β-葡聚糖处理的M2巨噬细胞+ABA,以评估肿瘤细胞上的PD-L1表达。图13显示,β-葡聚糖处理的M2巨噬细胞使强结合者中的肿瘤细胞上的PD-L1表达增加,并且随着ABA的添加,β-葡聚糖处理的M2巨噬细胞还使弱结合者中的肿瘤细胞上的PD-L1表达增加。实施例13可溶性β-葡聚糖对骨髓来源的抑制细胞(MDSC)的影响:MDSC积聚在大多数患有癌症的患者和实验动物的血液、淋巴结和骨髓中以及肿瘤部位处,并且既抑制适应性免疫又抑制先天性免疫。MDSC由肿瘤分泌的因子和宿主分泌的因子诱导,其中许多因子都是促炎分子。促炎介质对MDSC的诱导产生以下假说:炎症促进使免疫监视和抗肿瘤免疫下调的MDSC的积聚,从而促进肿瘤生长。在不同时间从进行MPRIMEPGG治疗的病例研究受试者中抽取血液,并分析MDSC的存在。第一次抽血在输注前,第8循环,第1天进行。如图14A所示,外周血中存在大量的CD33+MDSC。第二次抽血在输注后,第8循环,第1天进行。如图14A中的第二幅图所示,在输注后的几小时内,MDSC短暂消失。最后一个血液样品在在输注前,第8循环,第15天抽取。CD33+MDSC再次出现在外周血中。在另一项研究中,将人脐带血经针对CD34+细胞进行富集,并培养9天以产生CD33+CD11b+细胞(MDSC)。然后用可溶性β-葡聚糖或柠檬酸盐缓冲液(对照)处理MDSC,并评估其抑制T细胞增殖的能力。在CD8T细胞与处理或未处理的MDSC的比例为2:1的条件下进行T细胞增殖试验。如图14B所示,β-葡聚糖处理的MDSC对T细胞增殖的抑制性较低。这些结果表明,β-葡聚糖调节MDSC群体,使它们短暂地离开外周血液循环并且对T细胞增殖的抑制性较低。因此,如果一种或多种癌症免疫治疗药物或化疗药物与可溶性β-葡聚糖联合施用(特别是在CD33+细胞群体短暂缺失期间),那么该疗法将对肿瘤更加有效。实施例14来自β-葡聚糖处理的M2巨噬细胞/MoDC和T细胞共培养物的上清液诱导肿瘤细胞上的PD-L1表达:M2巨噬细胞和MoDC如上所述制备。随后将巨噬细胞和MoDC如前所述用于T细胞增殖试验。收获来自这些增殖试验的上清液,并将其与包括NSCLC、乳腺癌、胰腺癌、结肠癌和B细胞淋巴瘤在内的各种肿瘤细胞系一起温育。在48小时后通过流式细胞术评估PD-L1在这些肿瘤细胞系上的表达。图15示出了来自3个不同实验的代表性结果。T细胞的效应机理需要三种信号。信号1是在抗原呈递细胞(APC)上的MHC分子的背景下呈递的抗原,信号2由APC上的膜共刺激分子提供,而信号3则为在效应子功能的环境中产生的细胞因子。共抑制分子如PD-L1可以抑制T细胞的效应子功能。来源于β-葡聚糖处理的单核细胞的巨噬细胞和树突细胞在体外具有更高的PD-L1表达水平,但该处理也增加了共刺激分子CD86(信号2)和细胞因子(信号3)的表达,从而使得T细胞效应子功能增强。由β-葡聚糖引起的更广泛的先天性和适应性免疫应答也增强了肿瘤细胞系上的PD-L1表达。这些结果证明,免疫细胞和肿瘤细胞两者上由β-葡聚糖诱导的PD-L1表达上调使其成为检查点抑制剂癌症免疫疗法的有希望的组合配偶体。同样重要的是注意到,β-葡聚糖还具有通过补偿机制如增加共刺激分子的表达和免疫刺激性细胞因子的产生而抵消对PD-L1上调的抑制作用的能力。实施例15可溶性β-葡聚糖与抗血管生成剂组合对TME的影响:肿瘤血管生成改变TME中的免疫功能,从而导致免疫抑制环境。已经证明抗血管生成剂如抗VEGFR2抗体DC101(小鼠雷莫芦单抗(ramucirumab)在癌症治疗中有用。因为可溶性β-葡聚糖可使TME倾向于更为抗肿瘤的环境,所以将其与DC101组合用于治疗小鼠中的NCI-H441非小细胞肺癌(NSCLC)皮下异种移植物,以增加DC101抗体的有效性。6至8周龄的雌性无胸腺裸鼠在胁腹皮下注射0.2ml体积的5×106个H441肿瘤细胞。当平均肿瘤体积达到约150mm3时,每两周一次给予小鼠以下药剂:·0.2ml/小鼠媒介物·1.2mg/小鼠IMPRIMEPGG(Biothera,Inc.)·10mg/kg或20mg/kgDC101(克隆:DC101目录号:BE0060)在第10天和最后一次给药后2小时收集血液样品。处理组包括媒介物(PBS对照)、单独的IMPRIMEPGG、单独的DC101和DC101+IMPRIMEPGG。一旦肿瘤大小达到组平均值150mm3,则将肿瘤随机分入处理组。10mg/kg处理组的结果在图16中示出。从图中可见,IMPRIMEPGG+DC101(补体激活性、非肿瘤靶向性抗体)协同作用而使肿瘤的生长降至最低。因此,可溶性β-葡聚糖与抗血管生成剂(其可以是或可以不是补体激活性、非肿瘤靶向性抗体)组合是有效的癌症疗法。实施例16可溶性β-葡聚糖与抗PD-L1抗体组合提高无肿瘤存活率:在另一项动物研究中,向小鼠注射MC38肿瘤细胞并将其随机分入处理组。8至12周龄的雌性C57BL/6小鼠在胁腹皮下注射0.1ml体积的1×106个MC38肿瘤细胞(表达低水平PD-L1的结肠腺癌)。在第3天开始每两周一次给予小鼠以下药剂:·0.2ml/小鼠媒介物·1.2mg/小鼠IMPRIMEPGG(Biothera,Inc.)·100μg/小鼠抗-PDL-1克隆:10F.9G2BioXcell目录号:BE0101在第1次给药前1小时、第3次给药后2小时、终点和最后一次给药后2小时(第20天)收集血液样品。处理组包括媒介物(PBS对照)、单独的IMPRIMEPGG、单独的抗PD-L1抗体和抗PD-L1+IMPRIMEPGG。一旦肿瘤大小达到组平均值150mm3,则将肿瘤随机分入处理组。该结果示于表10中。表10处理组无肿瘤存活者(第29天)媒介物1/18IMPRIMEPGG2/18抗-PD-L16/18抗-PD-L1+IMPRIMEPGG14/17再次,抗PD-L1抗体+可溶性β-葡聚糖的组合协同作用,以有效地提高无肿瘤存活率。还应注意,肿瘤上的PD-L1表达是抗PD-1抗体反应性的生物标志。因此,由于可溶性β-葡聚糖诱导肿瘤上的PD-L1表达,因此可溶性β-葡聚糖还将增强抗PD-1抗体的有效性。这通过上述可溶性β-葡聚糖处理诱导的PD-1表达增加而得到证实。实施例17可溶性β-葡聚糖和抗血管生成剂对TME的体内影响:如上文针对其他小鼠研究所描述的,向携带H1299NSCLC肿瘤的小鼠施用贝伐珠单抗(bevacizumab)(一种抗血管生成抗体)和IMPRIMEPGG。如图17A所示,施用贝伐珠单抗与IMPRIMEPGG的组合的处理组显示出PD-L1表达的增加,图17B显示精氨酸酶1的下调,而图17C显示与单独施用贝伐珠单抗的组相比,TME的C11b阳性先天性免疫浸润物中的iNOS表达增加。iNOS增加和精氨酸酶1减少是指示M1免疫刺激环境的标志。该数据清楚地说明,可溶性β-葡聚糖增强了抗血管生成剂的有效性并在体内调节TME。本文引用的所有专利、专利申请和出版物以及可通过电子方式获得的材料(例如,包括例如GenBank和RefSeq形式的核苷酸序列提交材料,以及例如SwissProt、PIR、PRF、PDB形式的氨基酸序列提交材料,以及GenBank和RefSeq形式的来自注释编码区的翻译)的完整公开内容通过引用整体并入本文。在本申请的公开内容与通过引用而并入本文的任何文献的公开内容之间存在任何不一致的情况下,应以本申请的公开内容为准。前面的详述和实施例仅仅是为了清楚理解的目的而提供的。不应从中得出不必要的限制。本发明不限于所示出和描述的确切细节,因为对于本领域技术人员显而易见的变化将包括在由权利要求限定的发明内。除非另有说明,否则在说明书和权利要求书中使用的表示组分的量、分子量等的全部数字应被理解为在所有情况下均被术语“约”修饰。因此,除非另有相反的指示,否则说明书和权利要求书中所述的数值参数为近似值,其可以根据本发明所寻求获得的预期性质而变化。至少,并且并非试图将等同原则限制于权利要求的范围,每个数值参数均应当至少根据所报告的有效数字的位数以及通过应用普通的舍入技术来解释。尽管阐述本发明的宽范围的数值范围和参数是近似值,但在具体实施例中阐述的数值是尽可能精确地报告的。然而,所有数值都固有地包括必定由在其各自的测试量度中出现的标准偏差导致的范围。所有标题均是为了方便读者,并且不应被用来限制标题后的正文的含义,除非是如此规定的。权利要求书(按照条约第19条的修改)1.一种组合物,其包含:可溶性β-葡聚糖;以及减轻免疫抑制的抗癌剂。2.如权利要求1所述的组合物,其中所述减轻免疫抑制的抗癌剂为检查点抑制剂。3.如权利要求2所述的组合物,其中所述检查点抑制剂为抗-PD-L1抗体。4.如权利要求1-3中任一项所述的组合物,其进一步包含:增强免疫共刺激的非肿瘤靶向性抗体。5.如权利要求1-3中任一项所述的组合物,其进一步包含:抗血管生成剂。6.如权利要求5所述的组合物,其中所述抗血管生成剂为抗血管生成抗体。7.如权利要求1-6中任一项所述的组合物,其中所述可溶性β-葡聚糖来源于酵母。8.如权利要求7所述的组合物,其中所述可溶性β-葡聚糖包含β-1,3/1,6葡聚糖。9.在单一制剂中提供的任何前述权利要求的组合物。10.如任何前述权利要求所述的组合物,其中所述可溶性β-葡聚糖组分和所述减轻免疫抑制的抗癌剂组分在分开的制剂中提供。11.可溶性β-葡聚糖和抗-PD-L1抗体在可溶性β-葡聚糖免疫疗法中的用途。12.如权利要求11所述的用途,其中所述抗-PD-L1抗体为非补体激活性抗体。13.如权利要求11-12中任一项所述的用途,其进一步包括增强免疫共刺激的非肿瘤靶向性抗体。14.如权利要求11所述的用途,其中所述可溶性β-葡聚糖来源于酵母。15.如权利要求11所述的用途,其中所述可溶性β-葡聚糖包含β-1,3/1,6葡聚糖。16.如权利要求11所述的用途,其中所述可溶性β-葡聚糖和抗-PD-L1抗体协同作用以提高无肿瘤存活率。17.可溶性β-葡聚糖和抗-VEGFR2抗体在可溶性β-葡聚糖免疫疗法中的用途。18.如权利要求17所述的用途,其中所述抗-VEGFR2抗体为非补体激活性抗体。19.如权利要求17所述的用途,其中所述可溶性β-葡聚糖和抗-VEGFR2抗体协同作用以使肿瘤生长降至最低。20.如权利要求17所述的用途,其中所述可溶性β-葡聚糖来源于酵母。21.如权利要求17所述的用途,其中所述可溶性β-葡聚糖包含β-1,3/1,6葡聚糖。22.如权利要求17所述的用途,其中所述可溶性β-葡聚糖包含β(1,6)-[聚-(1,3)-D-吡喃葡萄糖基]-聚-β(1,3)-D-吡喃葡萄糖。23.一种治疗癌症的方法,该方法包括共施用包含可溶性β-葡聚糖和减轻免疫抑制的抗癌剂的组合物。24.如权利要求23所述的方法,其中所述可溶性β-葡聚糖和所述减轻免疫抑制的抗癌剂同时共施用。25.如权利要求23所述的方法,其中所述可溶性β-葡聚糖和所述减轻免疫抑制的抗癌剂在不同时间共施用。26.如权利要求23-25中任一项所述的方法,其中与所述癌症有关的肿瘤细胞在所述组合物共施用之前表达低水平的PD-L1。27.如权利要求23所述的方法,其中所述减轻免疫抑制的抗癌剂为抗-PD-L1抗体。28.如权利要求23所述的方法,其中所述癌症为非小细胞肺癌、乳腺癌、胰腺癌、结肠癌、B细胞淋巴瘤、黑素瘤和肾细胞癌中的一种。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1