PSGL‑1调控剂及其用途的利记博彩app
本申请要求2014年7月8日提交的美国流水号62/022,191依据35U.S.C.§119(e)的优先权,通过援引将其全部内容完整收入本文。
本发明是部分利用(美国)国家卫生研究院授予的基金No.P01AI046530-14,No.R01AI06895-01A1和No.P30CA030199-32在政府支持下做出的。美国政府享有本发明的某些权利。
发明领域
一般而言,本发明涉及抗体,更具体而言,涉及P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂的用途及其调控免疫应答和治疗传染病,癌症和免疫性和炎性相关疾病和病症的用途。
发明背景
由T淋巴细胞进行的免疫应答对于针对微生物保护宿主至关重要的,但是它们在慢性感染中会变成功能障碍的。有慢性病毒感染,诸如HIV和丙型和乙型肝炎时,T细胞应答逐渐丧失功能且许多T细胞经历凋亡。剩余T细胞阻滞于功能障碍性状态,即表型衰竭。虽然了解不完全,但是已经在克隆13株(Cl13)慢性感染的淋巴细胞性脉络丛脑膜炎病毒(LCMV)模型中为T细胞衰竭鉴定了数种根本机制。在此模型中,将病毒特异性CD8+ T细胞长期暴露于抗原和I型干扰素,导致包括PD-1,LAG-3,CD160,和BTLA在内的免疫抑制性受体表达上调。细胞还损失活动力,显示改变的转录调节,且具有升高的抑制性细胞因子IL-10和TGFβ生成。随着时间,CD8+ T细胞损失它们的增殖潜力,细胞毒性功能和生成IL-2,TNF-α和IFN-γ的能力。CD4+ T细胞展示类似改变的分化及抑制性受体上调和功能损失。重要的是,病毒特异性CD4+ T细胞能挽救衰竭的CD8+ T细胞,使得它们能够介导病毒清除。认为由CD4+ T细胞生成的IL-2和IL-21有助于逆转缺陷型CD8+ T细胞应答–暗示适宜的效应器分化必需的关键细胞因子在慢性感染后变成限制性的。因此,数种整合过程的相互作用联合起来废除免疫系统消除慢性病毒感染的能力。
包括皮肤,肺,和肾在内的许多癌症建立与在包括HIV,丙型和乙型肝炎在内的慢性病毒感染中观察到的那些相似的免疫遏制状态且共享免疫功能障碍的许多共同特征。这些包括响应的T细胞死亡及包括PD-1,Lag-3和CTLA-4在内的抑制性受体上调。因此,致力于强化抗肿瘤T细胞应答的至关重要功能的免疫疗法是在这些设置中根除癌症所必需的。现在清楚慢性病毒和肿瘤通过强占防止过度免疫应答的天然检查来侵占免疫系统。生物医学研究的一项主要难题是如何开发逆转这种免疫遏制和促进肿瘤消除的疗法。
现在清楚逆转T细胞功能障碍能在广泛的临床设置中重建免疫应答和实现疾病消退。粘附机制调节T细胞在淋巴样和非淋巴样组织二者中的积累。已经使用调控粘附分子表达来影响效应和记忆T细胞发育和区分处于不同分化阶段的细胞。P-选择蛋白糖蛋白配体-1(PSGL-1)(它是L,E,和P选择蛋白受体家族的一种配体)在慢性LCMV感染后在T细胞上高度诱导。主要认识到PSGL-1调节T细胞运输入发炎组织中,和在稳态条件下和在炎性应答后介导T细胞迁移入淋巴样组织中。PSGL-1还能在应答消退后调节记忆T细胞归巢至骨髓。
尽管有通过阻断免疫抑制性受体(例如PD-1/PD-L1,CTLA-4)和通过抗肿瘤T细胞能极大改善广泛癌症的免疫破坏的新治疗,但是功效限于患者子集(常常<30%)。如此,存在至关重要的需要开发利用免疫系统的新策略在非响应性患者中实现有效的免疫疗法。
发明概述
本发明涉及P-选择蛋白糖蛋白配体-1(PSGL-1)调控免疫系统和免疫应答的开创性发现。具体而言,本发明提供提高多功能T细胞存活和病毒清除的PSGL-1激动剂和拮抗剂。本发明进一步提供使用PSGL-1调控剂治疗传染病,癌症和免疫性和炎性疾病和病症的方法。
在一个实施方案中,本发明提供一种治疗T细胞介导的疾病或病症的方法,其包括对有需要的受试者施用P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂。在一个方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个具体方面,该PSGL-1调控剂是激动剂且该T细胞介导的疾病或病症是自身免疫性或炎性疾病或病症。在某些方面,该PSGL-1调控剂是拮抗剂且该T细胞介导的疾病或病症是癌症或传染病。
在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或升高。在一个方面,CD25和T-bet的表达升高。在另一个方面,病毒清除升高。
在一个另外的实施方案中,本发明提供一种引发T细胞应答的方法,其包括对有需要的受试者施用PSGL-1调控剂。在一方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或升高。在一个方面,CD25和T-bet的表达升高。
在又一个实施方案中,本发明提供一种恢复T细胞功能的方法,其包括对有需要的受试者施用P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂。在一方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或升高。在一个方面,CD25和T-bet的表达升高。
在一个实施方案中,本发明提供一种药物组合物,其包含P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂和制药学载剂。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个另外的方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。
附图简述
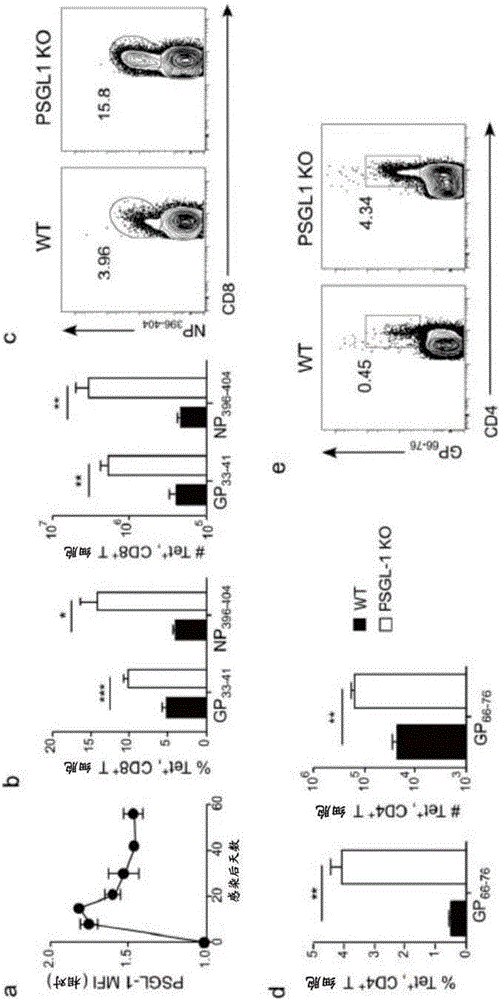
图1A-E显示PSGL-1动力学和LCMV Cl13感染后PSGL-1 KO小鼠中病毒特异性T细胞的积累。WT小鼠以黑色柱或黑色圆圈代表,PSGL-1 KO小鼠以白色柱代表。(A)相对于来自未感染WT小鼠的血液中的CD8+ T细胞,GP33-41+ CD8+ T细胞上PSGL-1水平的均值荧光强度(MFI)。(B)感染后8天时脾中计数的病毒特异性CD8+ T细胞频率和绝对数。(C)GP33-41+ CD8+ T细胞上的病毒特异性CD8+ T细胞频率的FACS图。(D)感染后8天脾中病毒特异性GP66-76+ CD4+ T细胞的频率和绝对数。(E)病毒特异性GP66-76+ CD4+ T细胞上的病毒特异性CD8+ T细胞频率的FACS图。
图2A-E显示病毒特异性PSGL-1 KO T细胞展示增强的存活但不展示增强的增殖。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A-B)来自感染后8天分离的WT和PSGL-1脾的GP33-41+ CD4+细胞(A)和GP66-76+ CD4+细胞(B)的水平。(C-D)来自感染后10天分离的WT和PSGL-1脾的IL7Rα(C)和Bcl-2(D)的水平。(E)来自感染后10天的WT和PSGL-1血液的CD25的水平。
图3A-G显示PSGL-1 KO小鼠中增强的效应器T细胞功能。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A)GP33-41+ CD8+细胞中的INF-γ和INF-γ+TNF-α生成。(B)NP396-404+ CD8+细胞中的INF-γ和INF-γ+TNF-α生成。(C)CD107+INF-γ+Tet+细胞的生成。(D)GP33-41+ CD8+细胞中的粒酶B生成。(E)GP33-41+ CD8+细胞中的T-bet生成。(F)GP33-41+ CD8+细胞中的Eomes生成。(G)GP66-76+ CD4+细胞中的INF-γ,INF-γ+TNF-α和INF-γ+TNF-α+IL-2生成。
图4A-D显示病毒特异性T细胞上的抑制性受体表达。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A)感染后7天病毒特异性GP66-76+CD4+ T细胞上的PD-1水平。(B)感染后8天病毒特异性GP66-76+ CD4+ T细胞上的PD-1水平。(C)感染后8天病毒特异性GP33-41+ CD8+细胞和NP396-404+ CD8+细胞上的PD-1水平。(D)病毒特异性GP33-41+ CD8+细胞上的CD160和BTLA水平。
图5A-G显示PSGL-1 KO病毒特异性CD8+和CD4+ T细胞的积累是细胞固有的且衰竭的CD8+ T细胞的PSGL-1连接降低它们的存活。WT和PSG-L-1 KO幼稚P14转基因T细胞以圆圈代表或1PSGL-1 KO幼稚Smarta转基因CD4+ T细胞以方框代表。(A-B)感染后1天来自WT和PSG-L-1 KO幼稚P14转基因T细胞(圆圈)或1PSGL-1 KO幼稚Smarta转基因CD4+ T细胞(方框)的脾(A)或肺(B)中PSGL-1 KO对WT的比。(C-D)感染后1天脾中WT(圆圈)和PSGL-1 KO(方框)P14细胞(C)或Smarta细胞(D)的数目。(E)感染后2天WT或PSGL-1 KO P14细胞中的CFSE稀释。(F-G)来自感染后9天分离的脾细胞的丙啶阴性GP33-41+ CD8+ T细胞频率(F)和GP33-41+ CD8+ T细胞上的PD-1水平(G)。
图6A-E显示PSGL-1 KO小鼠具有加速的病毒控制和广泛的免疫病理。(A-C)感染后8天来自以黑色圆圈或黑色柱代表的WT小鼠和以白色方框或白色柱代表的PSGL-1 KO小鼠的血清LCMV病毒水平(A),存活曲线(B)和血清激酶水平(C)。(D)未感染的和感染后第8天的WT和PSGL-1 KO肺的H&E组织学。(E)未感染和感染后8天的WT和PSGL-1 KO的肺中的病理学得分。
图7A-E显示PSGL-1 KO小鼠中的最佳病毒特异性CD8+ T细胞功能依赖于CD4+ T细胞辅助。以黑色柱或黑色圆圈代表WT小鼠,以白色柱或白色方框代表PSGL-1 KO小鼠和以灰色柱或灰色三角形代表PSGL-1 KO CD4消减小鼠。(A)脾中GP66-76+ CD4+ T细胞的绝对数。(B)感染后8天时血液中GP33-41和NP396-404CD8+ T细胞的频率。(C)感染后10天时脾中生成细胞因子的GP33-41CD8+ T细胞的绝对数。(D)感染后10天时脾中GP33-41+和NP396-404+特异性CD8+ T细胞上的PD-1水平。(E)感染后10天时的存活和血清病毒水平。
图8A-E显示Cl13感染后病毒特异性CD8+ T细胞应答的动力学。WT(黑色方框或柱)或PSGL1-KO(白色方框或柱)小鼠。(A-D)感染后4,6,和8天(A,B,C)和感染后30天(D)时GP33-41+或NP396-404+ CD8+ T细胞的绝对数。(E)点图呈现一只代表性小鼠。
图9A-D显示PSGL-1 KO病毒特异性T细胞有效迁移及在肺中积累。(A-D)感染后7.5天时来自WT(黑色柱)或PSGL1-KO(白色柱)小鼠肺的细胞,用DbGP33-41四聚体或DbNP396-404四聚体(A-B)或IAb-GP66-76(C-D)染色。
图10A-E显示病毒特异性T细胞上的细胞因子受体水平。以黑色方框或柱代表WT小鼠和以白色方框或柱代表PSGL-1 KO小鼠。(A)感染后4,6和8天时GP33-41细胞上IL-7Rα的水平。(B)感染后4,6和8天时NP396-404细胞上IL-7Rα的水平。(C)感染后9天时IL-21的水平。(D)感染后9天时CD122的水平。(E)感染后9天时IL-6R的水平。
图11A-E显示由来自PSGL-1 KO小鼠的效应T细胞表达的升高的细胞因子水平。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO小鼠。(A-C)感染后10天时CD8+ T细胞上INF-γ(A,C)和TNF-α(B)的生成。(D-E)感染后10天时CD4+ T细胞上TNF-α(D)和IL-2(E)的生成。
图12A-E显示病毒特异性T细胞上的抑制性受体表达。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO小鼠。(A-E)感染后8天脾中(A-B),感染后15天(C),感染后30天(D)时血液中,和感染后112天时脾中(E)病毒特异性GP33-41-和NP396-404-CD8+ T细胞上PD-1,CD160,和BTLA的水平。
图13A-E显示幼稚WT和PSGL-1 KO P14细胞的感染前表型和WT和PSGL-1 KO P14细胞的增殖。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO转基因P14+Tg小鼠。(A-B)用CD44和CD62L(A)和CD25,CD69,和CDI27(B)染色的脾。(C)感染后13天时脾和肺中WT或PSGL-1 KO P14细胞的频率。(D)感染后13天时脾和肺中的Brdu掺入。(E)脾中的代表性柱状图。
图14A-B显示PSGL-1 KO小鼠中的更高病理。以黑色圆圈代表未感染WT小鼠,以白色柱或方框代表未感染PSGL-1 KO小鼠,以黑色三角形代表受感染WT小鼠,以白色三角形代表受感染PSGL-1 KO小鼠。(A)WT和PSGL-1 KO肺和肝的病理学得分。(B)感染后9天时自WT和PSGL-1 KO小鼠分离的胃,小肠和大肠。
图15A-D显示Cl13感染后病毒特异性PSGL-1KO T细胞的积累。(A-D)感染后8天(A)和感染后30天(B)时血液中和感染后8天时脾(C)和肺(D)中病毒特异性CD8+ T细胞的计数。
图16A-C显示来自PSGL-1 KO的CD8+ T细胞的增强的抗病毒功能。(A-C)用NP396-404或GP33-41肽刺激脾细胞并分析IFN-γ和TNF-α(A,B)或CD107(C)。
图17A-B显示病毒特异性CD8+ T细胞的降低的抑制性受体表达。(A-B)自PD-1(A)和CD60和BTLA(B)的水平评估病毒特异性T细胞。
图18A-C显示PSGL-1 KO CD4+ T细胞展示改善的存活和功能及降低的抑制性受体表达。(A-C)感染后8天时测量的频率(A),细胞因子应答(B)和PD-1和BTLA水平(C)。
图19A-B显示PSGL-1 KO小鼠清除慢性LCMV且具有更高的循环中炎性细胞因子。(A)感染后的病毒滴度。(B)感染后8天时的细胞因子水平。
图20A-D显示响应病毒感染后和PSGL-1阻断后T细胞存活和PD-1受到PGSL-1缺陷调控。(A-D)感染后分析的特异性CD8+ T细胞的NP396-404(A)和GP33-41(B)水平。(C)自WT和PSGL-1 KO小鼠测量的病毒特异性CD8+ T细胞的PD-1水平。(D)感染后8天时测量的IAV特异性NP396-404或LCMV特异性NP396-404CD8+ T细胞上的PD-1水平。
图21A-B显示肿瘤微环境中T细胞的PSGL-1和PD-1表达。(A)CD4+细胞的频率(左边),它们的PSGL-1表达(中间)和PSGL-1低细胞较之高PSGL-1高细胞的PD-1表达(右边)。(B)CD8+ T细胞的频率(左边),它们的高PSGL-1表达(中间)和异质PD-1表达。
图22A-B显示黑素瘤阳性耳中CD8+ T细胞的PSGL-1表达和PSGL-1结合。(A)CD44高较之CD44低CD8+ T细胞中的PD-1和PSGL-1表达。(B)具有功能性PSGL-1结合的CD8+ T细胞的频率。
图23A-B显示黑素瘤肿瘤中的CD3+ T细胞,和CD4+Treg和CD4+非Treg的频率。(A)CD3+ T细胞单个核细胞。(B)破裂的肿瘤内高频率的PSGL-1+,PD-1+(双重阳性)CD4+非Treg(效应T细胞)和Treg,通过流式细胞术进行。
图24显示黑素瘤中免疫细胞的存在,和它们的PSGL-1表达。(A)黑素瘤肿瘤内鉴定的T细胞(CD4+非Treg,Treg,CD8+细胞),NK T细胞,NK细胞,树突细胞(DC,MHC II+,CD11c),髓样衍生抑制细胞(MDSC,Gr1+,CD11b)和巨噬细胞(MΦ,F4/80+,CD11b+)。(B)这些免疫细胞子集表达PSGL-1。
图25A-F显示PSGL-1缺陷小鼠与WT小鼠相比的抗肿瘤应答。(A)肿瘤体积和重量。(B)效应CD8+和CD4+ T细胞的频率。(C)CD8+和CD4+ T细胞的PD-1表达。(D-F)CD8+和CD4+ T细胞的细胞因子生成。
发明详述
本发明涉及P-选择蛋白糖蛋白配体-1(PSGL-1)调控免疫系统和免疫应答的开创性发现。具体而言,本发明提供提高多功能T细胞存活和病毒清除的PSGL-1激动剂和拮抗剂。本发明进一步提供使用PSGL-1调控剂治疗传染病,癌症和免疫性和炎性疾病和病症的方法。
在描述本发明组合物和方法之前,要理解的是,本发明不限于所描述的特定组合物,方法,和实验条件,因为此类组合物,方法,和条件可以有所变化。还要理解的是,本文中使用的术语仅仅是出于描述特定实施方案的目的,并非意图是限制性的,因为本发明的范围只会在所附权利要求书中限制。
除非另有定义,本文中使用的所有技术和科学术语具有与本发明所属领域普通技术人员的共同理解相同的含义。虽然可以在本发明的实施或检验中使用与本文中描述的方法和材料相似或等同的任何方法和材料,但是现在描述优选的方法和材料。下文所列定义用于理解公开内容,但是决不应视为取代本领域普通技术人员对术语的理解。
如此说明书和所附权利要求书中使用的,单数形式“一个”,“一种”,和“该”包括复数提及物,除非上下文另有清楚叙述。如此,例如,提到“该方法”包括一种或多种方法,和/或本领域技术人员在阅读此公开文本后会变得显而易见的本文所述类型的步骤,等等。
抗体通常是约150,000道尔顿的异四聚体糖蛋白,由两条相同的轻(L)链和两条相同的重(H)链构成。每条轻链通过一个共价二硫键连接至一条重链,而二硫化物连接的数目在不同免疫球蛋白同种型的重链间有所变化。每条重和轻链还具有间隔规律的链内二硫桥。每条重链具有一端处的一个可变域(VH),接着是多个恒定域。每条轻链具有一端处的一个可变域(VL)和它的另一端处的一个恒定域;轻链的恒定域与重链的第一恒定域对齐,而轻链可变域与重链可变域对齐。认为特定氨基酸残基形成轻和重链可变域之间的界面。每个可变区包含称作互补决定区(CDR)或高变区的三个区段,而可变域中更加高度保守的部分称作框架区(FR)。重和轻链的可变域各自包含四个FR区,它们大多采取β-片层构象,通过三个CDR连接,三个CDR形成环连接,而且在一些情况中形成β-片层结构的一部分。每条链中的CDR通过FR密切接近地保持在一起,而且与来自另一条链的CDR促成抗体的抗原结合位点形成。恒定域不直接牵涉抗体对抗原的结合,但是展现多种效应器功能,诸如抗体在抗体依赖性细胞的细胞毒性中的参与。
根据它们的重链恒定域的氨基酸序列,免疫球蛋白可以指派至不同的类。有五大类免疫球蛋白:IgA,IgD,IgE,IgG,和IgM,而且这些中的数类可以进一步分成亚类(同种型),例如IgG1,IgG2,IgG3,IgG4,IgA1,和IgA2。与不同类的免疫球蛋白对应的重链恒定域分别称作α,δ,ε,γ,和μ。不同类的免疫球蛋白的亚基结构和三维构造是公知的。
抗体的Fc区是抗体中与细胞表面受体和补体系统的一些蛋白质相互作用的尾部区域。这种特性容许抗体激活免疫系统。在IgG,IgA和IgD抗体同种型中,Fc区由自抗体的两条重链的第二和第三恒定域衍生的两个相同的蛋白质片段构成;IgM和IgE Fc区在多肽链中每条含有三个重链恒定域(CH域2-4)。IgG的Fc区携带高度保守的N-糖基化位点。Fc片段的糖基化对于Fc受体介导的活性是必要的。附着至这个位点的N-聚糖主要是核心岩藻糖基化的复合类型的双触角结构。另外,小量的这些N-聚糖还携带两分型GlcNAc和α-2,6连接的唾液酸残基。
如本文中使用的,术语“抗体”指完整单克隆抗体,多克隆抗体,自至少两种完整抗体形成的多特异性抗体(例如双特异性抗体),和抗体片段,只要它们展现期望的生物学活性。
“抗体片段”包含完整抗体的一部分,优选完整抗体的抗原结合或可变区。抗体片段的例子包括Fab,Fab',F(ab')2,和Fv片段;双抗体,三抗体等等;线性抗体;单链抗体分子;和自抗体片段形成的多特异性抗体。
如本文中使用的,术语“单克隆抗体”指自一群基本上同质的抗体获得的抗体,即构成群体的抗体个体是相同的,除了可以以微小量存在的可能的天然发生的突变。单克隆抗体是高度特异性的,针对单一抗原性位点。而且,每种单克隆抗体针对抗原上的单一决定簇。在它们的特异性以外,单克隆抗体的优点在于它们由杂交瘤培养物合成,未受到其它免疫球蛋白污染。例如,要依照本发明使用的单克隆抗体可以由杂交瘤生成,通过重组DNA方法生成或自噬菌体抗体文库分离。
本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重和/或轻链的一部分与来自特定物种衍生的或属于特定抗体类或亚类的抗体中的对应序列相同或同源,而链的剩余部分与自另一个物种衍生的或属于另一个抗体类或亚类的抗体中的对应序列相同或同源,以及此类抗体的片段,只要它们展现期望的生物学活性。
非人(例如鼠)抗体的“人源化”形式是含有自非人免疫球蛋白衍生的最少序列的嵌合免疫球蛋白,免疫球蛋白链或其片段(诸如Fv,Fab,Fab',F(ab')2或抗体的其它抗原结合亚序列)。在极大程度上,人源化抗体是如下的人免疫球蛋白(受体抗体),其中来自受体的互补决定区(CDR)的残基用来自具有期望特异性,亲和力,和能力的非人物种(供体抗体)诸如小鼠,大鼠或家兔的CDR的残基替换。在一些情况中,人免疫球蛋白的Fv框架区(FR)残基用对应的非人残基替换。而且,人源化抗体可包含在受体抗体中和在输入CDR或框架序列中都没有找到的残基。进行这些修饰是为了进一步提升和最大化抗体性能。一般而言,人源化抗体会包含至少一种,和通常两种如下的基本上整个可变域,其中所有或基本上所有CDR对应于非人免疫球蛋白的CDR且所有或基本上所有FR是人免疫球蛋白序列的FR。最佳地,人源化抗体还会至少包含免疫球蛋白恒定区(Fc)的一部分,通常是人免疫球蛋白的。
“单链Fv”或“sFv”抗体片段包含抗体的VH和VL域,其中这些域存在于一条多肽链中。优选地,Fv多肽进一步包含VH和VL域之间的多肽接头,使sFv能够形成抗原结合所期望的结构。
术语“融合分子”和“融合蛋白”可互换使用且意图指通过重组,化学或其它合适方法共价连接(即融合)的生物学活性多肽(通常是HVEM或抗体)和效应器分子(通常是蛋白质或肽序列)。如果想要的话,融合分子可以经由肽接头序列在一个或数个位点处融合。或者,可以使用肽接头来帮助构建融合分子。具体优选的融合分子是融合蛋白。通常,融合分子也可以由缀合物分子构成。
Fc融合蛋白(也称作Fc嵌合融合蛋白,Fc-Ig,基于Ig的嵌合融合蛋白和带Fc标签的蛋白质)由遗传连接至感兴趣肽或蛋白质的IgG Fc域构成。Fc融合蛋白已经变成对于体内和体外研究有价值的试剂。
Fc融合的结合配偶的范围可以包括单一肽,一旦与细胞表面受体结合就活化细胞表面受体的配体,信号分子,一旦二聚化就被活化的或作为用于在蛋白质微阵列中鉴定结合配偶的诱饵蛋白的受体的胞外域。
Fc域在体内最有价值的特征之一是它能显著延长感兴趣蛋白质的血浆半衰期,这对于生物治疗性药物导致改善的治疗功效;这一属性使得Fc融合蛋白成为有吸引力的生物治疗剂。
如本文中使用的,术语“核酸”或“核酸序列”指寡核苷酸,核苷酸,多核苷酸,或任何这些的任何片段;而且包括基因组或合成起源的DNA或RNA(例如mRNA,rRNA,tRNA,iRNA),可以是单链的或双链的;而且可以是有义或反义链,或肽核酸(PNA),或任何DNA样或RNA样物质,天然或合成起源的,包括例如iRNA,核糖核蛋白(例如双链iRNA,例如iRNP),核酸,即寡核苷酸,含有天然核苷酸的已知类似物的。
如本文中使用的,术语“多肽”和“蛋白质”在本文中可互换使用且指两个或更多个子单元氨基酸,氨基酸类似物,或其它肽模拟物的化合物,不管翻译后修饰,例如磷酸化或糖基化。子单元可以通过肽键或其它键诸如例如酯或醚键来连接。此定义涵盖全长多肽,截短多肽,点突变体,插入突变体,剪接变体,嵌合蛋白,及其片段。在各种实施方案中,多肽可具有至少10个氨基酸或至少25,或至少50或至少75或至少100或至少125或至少150或至少175或至少200个氨基酸。
如本文中使用的,术语“小分子”指可帮助调节生物学过程的,尺寸在10-9m量级上的低分子量(<900道尔顿)有机化合物。大多数药物是小分子。小分子可具有多种生物学功能,充当细胞信号分子,医学中的药物,农业中的杀虫剂,和许多其它作用。这些化合物可以是天然的(诸如次级代谢物)或人工的(诸如抗病毒药物);它们可具有针对疾病的有效效果(诸如药物)或可以是有害的(诸如致畸原和致癌原)。生物聚合物诸如核酸和蛋白质,和多糖(诸如淀粉或纤维素)不是小分子—尽管它们的组成单体-分别是核糖或脱氧核糖核苷酸,氨基酸,和单糖-常常被认为是小分子。
如本文中使用的,术语“治疗”或“处理”或“缓解”指治疗性处理,防范性和/或预防性措施,其中目标是阻止或减缓(减轻)所针对的病理性状况或病症。那些需要治疗的包括那些早就有病症的以及那些倾向于具有病症的或那些要预防病症的。
如本文中使用的,术语“治疗剂”包括在施用于患者或受试者时能够诱导期望的治疗效果的化学化合物或组合物。本发明的治疗剂的一个例子是抗PSGL-1抗体或PSGL-1融合蛋白。
如本文中使用的,药物用于治疗疾病的术语“有效量”或“治疗有效量”是能降低疾病的严重性,降低与疾病或它的治疗有关的一种或多种症状的严重性,或延迟在所治疗的状况后会以一些频率发生的更加严重的症状或更加严重的疾病发作的量。“有效量”可以关于所述目的,凭经验和以例行方式确定。
为了治疗受试者,可以通过任何合适手段来施用治疗剂,包括表面,胃肠外,皮下,腹膜内,肺内,鼻内,静脉内,和/或损害内施用。
如本文中使用的,术语“T细胞介导的疾病或病症”指会受益于PSGL-1调控剂治疗的任何状况。受益于抗PSGL-1治疗的疾病和病症的例子包括传染病,癌症和免疫性,自身免疫性和炎性疾病和病症。特别地,具有癌症或传染病的受试者能受益于PSGL-1拮抗剂治疗且具有自身免疫性或炎性疾病或病症的受试者能受益于PSGL-1激动剂治疗。
当生物体的身体受到能附着并进入易感细胞的致病性病毒,传染性病毒颗粒(病毒粒体),真菌或细菌侵袭时,发生感染。巨大数目的病毒引起传染病。传染病的例子包括但不限于肉毒中毒,淋巴腺鼠疫(黑死病),杯状病毒感染(诺如病毒和札幌病毒),禽痘(水痘),衣原体,霍乱,艰难梭菌感染,感冒(急性病毒性鼻咽炎;急性鼻炎),克-雅二氏病(CJD),登革热,白喉,埃博拉出血热,淋病,手足口病(HFMD),幽门螺杆菌感染,甲型肝炎,乙型肝炎,丙型肝炎,丁型肝炎,戊型肝炎,单纯疱疹,人免疫缺陷病毒(HIV),人乳头瘤病毒(HPV)感染,埃-巴二氏病毒传染性单核细胞增多症(传染性单核细胞增多症),流行性感冒(流感),军团杆菌病(军团病),麻风病,莱姆病(莱姆疏螺旋体病),疟疾,马尔堡出血热(MHF),麻疹,中东呼吸综合征(MERS),脑膜炎,腮腺炎,百日咳,瘟疫,进行性多灶性脑白质病,狂犬病,鼻病毒感染,洛基山斑点热(RMSF),风疹,沙门氏菌病,SARS(严重急性呼吸综合征),疥疮,败血症,志贺氏菌病(杆菌性痢疾),缠腰龙(带状疱疹),痘症(天花),梅毒,破伤风(牙关紧闭症),结核病,伤寒,谷热,病毒性肺炎,西尼罗河热和黄热病。
传染病常常用抗病毒剂,抗细菌剂或抗真菌剂来治疗。抗病毒剂包括但不限于传染病常常用抗病毒剂,抗细菌剂或抗真菌剂来治疗。抗病毒剂包括但不限于阿巴卡韦(Abacavir),阿昔洛韦(Aciclovir),无环鸟苷(Acyclovir),阿德福韦(Adefovir),金刚烷胺(Amantadine),安泼那韦(Amprenavir),Ampligen,Arbidol,Atazanavir,Atripla,Balavir,西多福韦(Cidofovir),可比韦(Combivir),Dolutegravir,Darunavir,地拉韦啶(Delavirdine),地达诺新(Didanosine),二十二(烷)醇,依度尿苷(Edoxudine),依法韦仑(Efavirenz),恩曲他滨(Emtricitabine),Enfuvirtide,恩替卡韦(Entecavir),Ecoliever,泛昔洛韦(Famciclovir),福米韦生(Fomivirsen),福沙那韦(Fosamprenavir),Foscarnet,Fosfonet,融合抑制剂,更昔洛韦(Ganciclovir),伊巴他滨(Ibacitabine),Imunovir,碘苷,咪喹莫特(Imiquimod),茚地那韦(Indinavir),肌苷,整合酶抑制剂,III型干扰素,II型干扰素,I型干扰素,干扰素,拉米夫定(Lamivudine),洛匹那韦(Lopinavir),洛韦胺(Loviride),Maraviroc,吗啉胍(Moroxydine),甲吲噻踪(Methisazone),那非那韦(Nelfinavir),奈韦拉平(Nevirapine),Nexavir,核苷类似物,Novir,奥塞米韦(Oseltamivir),PEG化干扰素α-2a,喷昔洛韦(Penciclovir),Peramivir,普来可那立(Pleconaril),鬼臼毒素,蛋白酶抑制剂,Raltegravir,逆转录酶抑制剂,利巴韦林(Ribavirin),金刚乙胺(Rimantadine),利托那韦(Ritonavir),Pyramidine,沙奎那韦(Saquinavir),Sofosbuvir,司他夫定(Stavudine),协同增强剂,茶树油,Telaprevir,替诺福韦(Tenofovir),替诺福韦(Tenofovir)disoproxil,替拉那韦(Tipranavir),曲氟尿苷(Trifluridine),三协唯(Trizivir),曲金刚胺(Tromantadine),Truvada,伐昔洛韦(Valaciclovir),缬更昔洛韦(Valganciclovir),Vicriviroc,Vidarabine,Viramidine,扎西他滨(Zalcitabine),扎那米韦(Zanamivir)和齐多夫定(Zidovudine)。
抗细菌剂包括但不限于阿米卡星(Amikacin),庆大霉素(Gentamicin),卡那霉素(Kanamycin),新霉素(Neomycin),奈替米星(Netilmicin),妥布霉素(Tobramycin),巴龙霉素(Paromomycin),链霉素(Streptomycin),大观霉素(Spectinomycin(Bs)),格尔德霉素(Geldanamycin),除莠霉素(Herbimyci),利福昔明(Rifaximin),氯拉卡比(Loracarbef),厄他培南(Ertapenem),多利培南(Doripenem),亚胺培南(Imipenem)/西司他丁(Cilastatin),美罗培南(Meropenem),头孢羟氨苄(Cefadroxil),头孢唑林(Cefazolin),头孢噻吩(Cefalotin或Cefalothin),头孢氨苄(Cefalexin),头孢克洛(Cefaclor),头孢丙烯(Cefprozil),头孢呋辛(Cefuroxime),头孢克肟(Cefixime),头孢地尼(Cefdinir),头孢托仑(Cefditoren),头孢哌酮(Cefoperazone),头孢噻肟(Cefotaxime),头孢泊肟(Cefpodoxime),头孢他啶(Ceftazidime),头孢布烯(Ceftibuten),头孢唑肟(Ceftizoxime)),头孢曲松(Ceftriaxone),头孢吡肟(Cefepime),头孢洛林酯(Ceftaroline fosamil),头孢吡普(Ceftobiprole),替考拉宁(Teicoplanin),万古霉素(Vancomycin),泰拉万星(Telavancin),达巴万星(Dalbavancin),奥利万星(Oritavanci),克林霉素(Clindamycin),林可霉素(Lincomycin),达托霉素(Daptomycin),阿奇霉素(Azithromycin),克拉霉素(Clarithromycin),地红霉素(Dirithromycin),红霉素(Erythromycin),罗红霉素(Roxithromycin),醋竹桃霉素(Troleandomycin),泰利霉素(Telithromycin),螺旋霉素(Spiramycin),氨曲南(Aztreonam),呋喃唑酮(Furazolidone),硝基呋喃妥因(Nitrofurantoin(Bs)),噁唑烷酮类(Oxazolidinones(Bs)),利奈唑胺(Linezolid),阿莫西林(Amoxicillin),氨苄西林(Ampicillin),阿洛西林(Azlocillin),羧苄西林(Carbenicillin),氯唑西林(Cloxacillin),双氯西林(Dicloxacillin),氟氯西林(Flucloxacillin),美洛西林(Mezlocillin),甲氧西林(Methicillin),萘夫西林(Nafcillin),苯唑西林(Oxacillin),青霉素(Penicillin),青霉素(Penicillin),哌拉西林(Piperacillin),青霉素(Penicillin)G,替莫西林(Temocillin),替卡西林(Ticarcillin),杆菌肽(Bacitracin),可立其丁(Colistin),多粘菌素(Polymyxin)B,环丙沙星(Ciprofloxacin),依诺沙星(Enoxacin),加替沙星(Gatifloxacin),吉米沙星(Gemifloxacin),左氧氟沙星(Levofloxacin),洛美沙星(Lomefloxacin),莫西沙星(Moxifloxacin),萘啶酸(Nalidixic acid),诺氟沙星(Norfloxacin),氧氟沙星(Ofloxacin),曲伐沙星(Trovafloxacin),格帕沙星(Grepafloxacin),司帕沙星(Sparfloxacin),替马沙星(Temafloxacin),磺胺米隆(Mafenide),磺胺醋酰(Sulfacetamide),磺胺嘧啶(Sulfadiazine),磺胺嘧啶银(Silver sulfadiazine),磺胺地索辛(Sulfadimethoxine),磺胺甲二唑(Sulfamethizole),磺胺甲噁唑(Sulfamethoxazole),胺(Sulfanilimide),柳氮磺吡啶(Sulfasalazine),磺胺异噁唑(Sulfisoxazole),甲氧苄啶(Trimethoprim),地美环素(Demeclocycline),多西环素(Doxycycline),米诺环素(Minocycline),氧四环素(Oxytetracycline),四环素(Tetracycline),链霉素(Streptomycin)和磷霉素(Fosfomycin)。
抗真菌剂包括但不限于两性霉素(Amphotericin)B,杀假丝菌素(Candicidin),非律平(Filipin),哈霉素(Hamycin),那他霉素(Natamycin),制霉菌素(Nystatin),龟裂杀菌素(Rimocidin),联苯苄唑(Bifonazole),布康唑(Butoconazole),克霉唑(Clotrimazole),益康唑(Econazole),芬替康唑(Fenticonazole),异康唑(Isoconazole),酮康唑(Ketoconazole),卢立康唑(Luliconazole),咪康唑(Miconazole),奥莫康唑(Omoconazole),奥昔康唑(Oxiconazole),舍他康唑(Sertaconazole),硫康唑(Sulconazole),噻康唑(Tioconazole),阿巴康唑(Albaconazole),艾氟康唑(Efinaconazole),氟环唑(Epoxiconazole),氟康唑(Fluconazole),艾沙康唑(Isavuconazole),伊曲康唑(Itraconazole),泊沙康唑(Posaconazole),丙环唑(Propiconazole),雷夫康唑(Ravuconazole),特康唑(Terconazole),伏立康唑(Voriconazole),阿巴芬净(Abafungin),阿莫罗芬(Amorolfin),布替萘芬(Butenafine),萘替芬(Naftifine),特比萘芬(Terbinafine),阿尼芬净(Anidulafungin),卡泊芬净(Caspofungin),和米卡芬净(Micafungin)。
免疫性疾病或病症是免疫系统的功能障碍。这些病症可以通过数种不同方式来表征:通过受到侵袭的免疫系统的成分;通过免疫系统是否过于活跃或不够活跃;及通过状况是否是先天的或获得的。自身免疫性疾病源于身体针对身体中正常存在的物质和组织的异常免疫应答(自身免疫)。关于自身免疫性疾病的根本病理生理学的一项重大理解是基因组范围关联扫描的应用,它们已经鉴定出自身免疫性疾病间惊人程度的遗传共享。
自身免疫性病症包括但不限于急性播散性脑脊髓炎(ADEM),阿狄森氏病,无丙种球蛋白血症,斑秃,肌萎缩性侧索硬化(也称作Lou Gehrig氏病),强直性脊柱炎,抗磷脂综合征,抗合成酶综合征,特应性变态反应,特应性皮炎,自身免疫性再生障碍性贫血,自身免疫性心肌病,自身免疫性肠病,自身免疫性溶血性贫血,自身免疫性肝炎,自身免疫性内耳病,自身免疫性淋巴增殖性综合征,自身免疫性胰腺炎,自身免疫性周围神经病,自身免疫性多内分泌综合征,自身免疫性孕酮皮炎,自身免疫性血小板减少性紫癜,自身免疫性荨麻疹,自身免疫性葡萄膜炎,巴类病/巴类同心硬化症,贝切特氏病,贝格尔氏病,Bickerstaff氏脑炎,Blau综合征,大疱性类天疱疮,癌症,卡斯尔曼氏病,乳糜泻,查加斯病,慢性炎性脱髓鞘性多神经病,慢性炎性脱髓鞘性多神经病,慢性阻塞性肺病,慢性复发性多灶性骨髓炎,丘-施二氏综合征,瘢痕性类天疱疮,寇甘综合征,冷凝集素病,补体成分2缺乏,接触性皮炎,颅动脉炎,CREST综合征,克罗恩氏病,库欣氏综合征,皮肤白细胞分裂性血管炎,Dego氏病,德尔肯氏病,疱疹样皮炎,皮肌炎,1型糖尿病,弥漫性皮肤系统性硬化症,盘状红斑狼疮,德雷斯勒氏综合征,药物诱发的红斑狼疮,湿疹,子宫内膜异位症,嗜酸性筋膜炎,嗜酸细胞性胃肠炎,嗜酸细胞性肺炎,获得性大疱性表皮松解,结节性红斑,胎儿成红细胞增多症,基本混合型冷球蛋白血症,埃文斯氏综合征,进行性骨化性纤维发育不良,纤维化肺泡炎(或特发性肺纤维化),胃炎,胃肠类天疱疮,肾小球肾炎,古德帕斯丘氏综合征,移植物抗宿主病,格雷夫斯病,格-巴二氏综合症,桥本氏脑病,桥本氏甲状腺炎,亨-舍二氏紫癜,妊娠疱疹也称作妊娠类天疱疮,化脓性汗腺炎,休斯-斯托文综合征,低丙种球蛋白血症,特发性炎性脱髓鞘病,特发性肺纤维化,特发性血小板减少性紫癜,IgA肾病,包涵体肌炎,间质性膀胱炎,青少年特发性关节炎也称作青少年类风湿性关节炎,川崎病,兰-伊二氏肌无力综合征,白细胞分裂性血管炎,扁平苔癣,硬化性苔藓,线性IgA病,狼疮状肝炎也称作自身免疫性肝炎,红斑狼疮,Majeed综合征,显微结肠炎,显微多血管炎,米-费二氏综合征,混合性结缔组织病,硬斑病,穆-哈二氏病也称作急性苔藓痘疮样糠疹,多发性硬化,重症肌无力,肌炎,梅尼埃氏病,发作性睡眠症,视神经脊髓炎,神经性肌强直,隐匿性瘢痕性类天疱疮,视性眼阵挛肌阵挛综合征,Ord氏甲状腺炎,回文风湿病,PANDAS(与链球菌有关的儿科自身免疫性神经精神障碍),副肿瘤小脑变性,阵发性夜间血红蛋白尿(PNH),帕-罗二氏综合征,扁平部睫状体炎,Parsonage-Turner综合征,寻常型天疱疮,静脉周脑脊髓炎,恶性贫血,POEMS综合征,结节性多发性炎症,风湿性多肌痛,多肌炎,原发性胆汁性肝硬化,原发性硬化性胆管炎,进行性炎性神经病,银屑病,银屑病关节炎,纯红细胞发育不良,坏疽性脓皮病,拉斯穆森氏脑炎,雷诺现象,莱特尔氏综合征,复发性多软骨炎,不宁腿综合征,腹膜后纤维化,风湿热,类风湿性关节炎,结节病,精神分裂症,施密特综合征,施尼茨勒综合征,巩膜炎,硬皮病,血清病,施耶格伦氏综合征,脊柱关节病,僵人综合征,斯蒂尔氏病,亚急性细菌性心内膜炎(SBE),Susac氏综合征,斯威特氏综合征,西德纳姆舞蹈病,交感性眼炎,系统性红斑狼疮,高安氏动脉炎,颞动脉炎,血小板减少症,托-亨二氏综合征,横贯性脊髓炎,溃疡性结肠炎,未分化脊柱关节病,荨麻疹血管炎,血管炎,白癜风,韦格纳氏肉芽肿病
炎性疾病是构成极其多种人疾病的一大组病症。免疫系统常常牵涉变应性反应和一些肌病二者中展现的炎性病症,许多免疫系统病症导致异常炎症。具有炎性过程的病因学起源的非免疫性疾病包括癌症,动脉粥样硬化,和缺血性心脏病。很多种蛋白质牵涉炎症,而且它们任一可发生损害或以其它方式异常调节该蛋白质的正常功能和表达的遗传突变。与炎症有关的病症的例子包括寻常痤疮,哮喘,自身免疫性疾病,乳糜泻,慢性前列腺炎,肾小球肾炎,超敏感性,炎性肠病,骨盆炎性疾病,再灌注损伤,类风湿性关节炎,结节病,移植排斥,血管炎,间质性膀胱炎,动脉粥样硬化,变态反应,肌病,白细胞缺乏和癌症。
如本文中使用的,术语“免疫调控剂”指调控免疫系统的任何治疗剂。免疫调控剂的例子包括类花生酸,细胞因子,前列腺素,白介素,趋化因子,检查点调节物,TNF超家族成员,TNF受体超家族成员和干扰素。免疫调控剂的具体例子包括PGI2,PGE2,PGF2,CCL14,CCL19,CCL20,CCL21,CCL25,CCL27,CXCL12,CXCL13,CXCL-8,CCL2,CCL3,CCL4,CCL5,CCL11,CXCL10,IL1,IL2,IL3,IL4,IL5,IL6,IL7,IL8,IL9,IL10,IL11,IL12,IL13,IL15,IL17,IL17,INF-α,INF-β,INF-ε,INF-γ,G-CSF,TNF-α,CTLA,CD20,PD1,PD1L1,PD1L2,ICOS,CD200,CD52,LTα,LTαβ,LIGHT,CD27L,41BBL,FasL,Ox40L,April,TL1A,CD30L,TRAIL,RANKL,BAFF,TWEAK,CD40L,EDA1,EDA2,APP,NGF,TNFR1,TNFR2,LTβR,HVEM,CD27,4-1BB,Fas,Ox40,AITR,DR3,CD30,TRAIL-R1,TRAIL-R2,TRAIL-R3,TRAIL-R4,RANK,BAFFR,TACI,BCMA,Fn14,CD40,EDAR XEDAR,DR6,DcR3,NGFR-p75,和Taj。免疫调控剂的其它例子包括tocilizumab(Actemra),CDP870(Cimzia),依那西普(enteracept)(Enbrel),阿达木单抗(adalimumab)(Humira),Kineret,abatacept(Orencia),英夫利昔单抗(infliximab)(Remicade),利妥昔单抗(rituzimab)(Rituxan),戈利木单抗(golimumab)(Simponi),Avonex,Rebif,ReciGen,Plegridy,Betaseron,Copaxone,Novatrone,那他珠单抗(natalizumab)(Tysabri),fingolimod(Gilenya),特立氟胺(teriflunomide)(Aubagio),BG12,Tecfidera,和阿仑单抗(alemtuzumab)(Campath,Lemtrada)。
癌症是牵涉异常细胞生长的一组疾病,它们有潜力侵入或传播至身体其它部分。(美国)国家癌症研究所描述的例示性癌症包括:急性成淋巴细胞性白血病,成人;急性成淋巴细胞性白血病,儿童;急性髓样白血病,成人;肾上腺皮质癌;肾上腺皮质癌,儿童;AIDS相关淋巴瘤;AIDS相关恶性肿瘤;肛门癌;星形细胞瘤,儿童小脑;星形细胞瘤,儿童脑;胆管癌,肝外;膀胱癌;膀胱癌,儿童;骨癌,骨肉瘤/恶性纤维性组织细胞瘤;脑干胶质瘤,儿童;脑瘤,成人;脑瘤,脑干胶质瘤,儿童;脑瘤,小脑星形细胞瘤,儿童;脑瘤,脑星形细胞瘤/恶性胶质瘤,儿童;脑瘤,室管膜瘤,儿童;脑瘤,成神经管细胞瘤,儿童;脑瘤,幕上原始神经外胚层肿瘤,儿童;脑瘤,视觉通路和下丘脑胶质瘤,儿童;脑瘤,儿童(其他);乳腺癌;乳腺癌和妊娠;乳腺癌,儿童;乳腺癌,男性;支气管腺瘤/类癌,儿童:类癌瘤,儿童;类癌瘤,胃肠;癌,肾上腺皮质;癌,胰岛细胞;未知原发性癌;中枢神经系统淋巴瘤,原发性;小脑星形细胞瘤,儿童;脑星形细胞瘤/恶性胶质瘤,儿童;宫颈癌;儿童癌症;慢性淋巴细胞性白血病;慢性骨髓性白血病;慢性骨髓增殖性病症;腱鞘的透明细胞肉瘤;结肠癌;结直肠癌,儿童;皮肤T细胞淋巴瘤;子宫内膜癌;室管膜瘤,儿童;上皮癌,卵巢;食道癌;食道癌,儿童;尤因氏家族肿瘤;颅外生殖细胞肿瘤,儿童;性腺外生殖细胞肿瘤;肝外胆管癌;眼癌,眼内黑素瘤;眼癌,视网膜母细胞瘤;胆囊癌;胃癌;胃癌,儿童;胃肠类癌瘤;生殖细胞肿瘤,颅外,儿童;生殖细胞肿瘤,性腺外;生殖细胞肿瘤,卵巢;妊娠滋养细胞肿瘤;胶质瘤,儿童脑干;胶质瘤,儿童视觉通路和下丘脑;毛细胞白血病;头和颈癌;肝细胞(肝)癌,成人(原发性);肝细胞(肝)癌,儿童(原发性);霍奇金氏淋巴瘤,成人;霍奇金氏淋巴瘤,儿童;妊娠期间的霍奇金氏淋巴瘤;下咽癌;下丘脑和视觉通路胶质瘤,儿童;眼内黑素瘤;胰岛细胞癌(内分泌胰腺);卡波西氏肉瘤;肾癌;喉癌;喉癌,儿童;白血病,急性成淋巴细胞性,成人;白血病,急性成淋巴细胞性,儿童;白血病,急性髓样,成人;白血病,急性髓样,儿童;白血病,慢性淋巴细胞性;白血病,慢性骨髓性;白血病,毛细胞;唇和口腔癌;肝癌,成人(原发性);肝癌,儿童(原发性);肺癌,非小细胞;肺癌,小细胞;成淋巴细胞性白血病,成人急性;成淋巴细胞性白血病,儿童急性;淋巴细胞性白血病,慢性;淋巴瘤,AIDS相关;淋巴瘤,中枢神经系统(原发性);淋巴瘤,皮肤T细胞;淋巴瘤,霍奇金氏,成人;淋巴瘤,霍奇金氏;童年;淋巴瘤,霍奇金氏,妊娠期间;淋巴瘤,非霍奇金氏,成人;淋巴瘤,非霍奇金氏,儿童;淋巴瘤,非霍奇金氏,妊娠期间;淋巴瘤,原发性中枢神经系统;巨球蛋白血症,瓦尔登斯特伦氏;男性乳腺癌;恶性间皮瘤,成人;恶性间皮瘤,儿童;恶性胸腺瘤;成神经管细胞瘤,儿童;黑素瘤;黑素瘤,眼内;梅克尔细胞癌;间皮瘤,恶性;转移性鳞状颈癌,隐匿性原发性;多发性内分泌瘤综合征,儿童;多发性骨髓瘤/浆细胞瘤;蕈样真菌病;骨髓增生异常综合征;骨髓性白血病,慢性;髓样白血病,儿童急性;骨髓瘤,多发性;骨髓增殖性病症,慢性;鼻腔和鼻旁窦癌;鼻咽癌;鼻咽癌,儿童;神经母细胞瘤;非霍奇金氏淋巴瘤,成人;非霍奇金氏淋巴瘤,儿童;怀孕期间的非霍奇金氏淋巴瘤;非小细胞肺癌;口腔癌,儿童;口腔和唇癌;口咽癌;骨肉瘤/骨的恶性纤维性组织细胞瘤;卵巢癌,儿童;卵巢上皮癌;卵巢生殖细胞肿瘤;卵巢低恶性潜能肿瘤;胰腺癌;胰腺癌,儿童,胰腺癌,胰岛细胞;鼻旁窦和鼻腔癌;甲状旁腺癌;阴茎癌;嗜铬细胞瘤;松果体和幕上原始神经外胚层肿瘤,儿童;垂体肿瘤;浆细胞瘤/多发性骨髓瘤;胸膜肺母细胞瘤;妊娠和乳腺癌;妊娠和霍奇金氏淋巴瘤;妊娠和非霍奇金氏淋巴瘤;原发性中枢神经系统淋巴瘤;原发性肝癌,成人;原发性肝癌,儿童;前列腺癌;直肠癌;肾细胞(肾)癌;肾细胞癌,儿童;肾盂和输尿管,移行细胞癌;视网膜母细胞瘤;横纹肌肉瘤,儿童;唾液腺癌;唾液腺癌,儿童;肉瘤,尤因氏家族肿瘤;肉瘤,卡波西氏;肉瘤(骨肉瘤)/骨的恶性纤维性组织细胞瘤;肉瘤,横纹肌肉瘤,儿童;肉瘤,软组织,成人;肉瘤,软组织,儿童;塞扎里综合征;皮肤癌;皮肤癌,儿童;皮肤癌(黑素瘤);皮肤癌,梅克尔细胞;小细胞肺癌;小肠癌;软组织肉瘤,成人;软组织肉瘤,儿童;鳞状颈癌,隐匿性原发性,转移性;胃癌;胃癌,儿童;幕上原始神经外胚层肿瘤,儿童;T细胞淋巴瘤,皮肤;睾丸癌;胸腺瘤,儿童;胸腺瘤,恶性;甲状腺癌;甲状腺癌,儿童;肾盂和输尿管的移行细胞癌;滋养细胞肿瘤,妊娠;未知的原发性部位,癌症,儿童;不寻常的儿童癌症;输尿管和肾盂,移行细胞癌;尿道癌;子宫肉瘤;阴道癌;视觉通路和下丘脑胶质瘤,儿童;外阴癌;瓦尔登斯特伦氏巨球蛋白血症;和维尔姆斯氏肿瘤。
如本文中使用的,术语“化疗剂”指用于治疗癌症的任何治疗剂。化疗剂的例子包括但不限于:放线菌素(Actinomycin),阿扎胞苷(Azacitidine),硫唑嘌呤(Azathioprine),博来霉素(Bleomycin),硼替佐米(Bortezomib),卡铂(Carboplatin),卡培他滨(Capecitabine),顺铂(Cisplatin),苯丁酸氮芥(Chlorambucil),环磷酰胺(Cyclophosphamide),阿糖胞苷(Cytarabine),柔红霉素(Daunorubicin),多西他赛(Docetaxel),去氧氟尿苷(Doxifluridine),多柔比星(Doxorubicin),表柔比星(Epirubicin),埃坡霉素(Epothilone),依托泊苷(Etoposide),氟尿嘧啶(Fluorouracil),吉西他滨(Gemcitabine),羟基脲(Hydroxyurea),伊达比星(Idarubicin),伊马替尼(Imatinib),伊立替康(Irinotecan),双氯乙基甲胺(Mechlorethamine),巯嘌呤(Mercaptopurine),甲氨蝶呤(Methotrexate),米托蒽醌(Mitoxantrone),奥沙利铂(Oxaliplatin),帕利他赛(Paclitaxel),培美曲塞(Pemetrexed),替尼泊苷(Teniposide),硫鸟嘌呤(Tioguanine),托泊替康(Topotecan),戊柔比星(Valrubicin),长春碱(Vinblastine),长春新碱(Vincristine),长春地辛(Vindesine),长春瑞滨(Vinorelbine),帕尼单抗(panitumamab),Erbitux(西妥昔单抗(cetuximab)),马妥珠单抗(matuzumab),IMC-IIF 8,TheraCIM hR3,地诺单抗(denosumab),Avastin(贝伐单抗(bevacizumab)),Humira(阿达木单抗(adalimumab)),Herceptin(曲妥单抗(trastuzumab)),Remicade(英夫利昔单抗(infliximab)),利妥昔单抗(rituximab),Synagis(帕利珠单抗(palivizumab)),Mylotarg(吉姆单抗(gemtuzumab)奥佐米星(oxogamicin)),Raptiva(依法利珠(efalizumab)),Tysabri(那他珠单抗(natalizumab)),Zenapax(达昔单抗(dacliximab)),(NeutroSpec(锝(99mTc)法索单抗(fanolesomab)),托珠单抗(tocilizumab),ProstaScint(铟-Ill标记的卡罗单抗喷地肽(Capromab Pendetide)),Bexxar(托西莫单抗(tositumomab)),Zevalin(与钇90缀合的替伊莫单抗(ibritumomab tiuxetan)(IDEC-Y2B8)),Xolair(奥马珠单抗(omalizumab)),MabThera(利妥昔单抗(Rituximab)),ReoPro(阿昔单抗(abciximab)),MabCampath(阿仑单抗(alemtuzumab)),Simulect(巴利昔单抗(basiliximab)),LeukoScan(硫索单抗(sulesomab)),CEA-Scan(阿西莫单抗(arcitumomab)),Verluma(诺非单抗(nofetumomab)),Panorex(依决洛单抗(Edrecolomab)),阿仑单抗(alemtuzumab),CDP 870,和那他珠单抗(natalizumab)。
免疫系统是生物体内针对疾病提供保护的生物学结构和过程的一种系统。此系统是保护身体免于病原体和其它外来物质,破坏受到感染的和恶性的细胞,及去除细胞残骸的相互作用的细胞,细胞产物,和细胞形成组织的弥漫的,复杂的网络:该系统包括胸腺,脾,淋巴结和淋巴组织,干细胞,白血细胞,抗体,和淋巴因子。B细胞或B淋巴细胞是适应性免疫系统的体液免疫中的一类淋巴细胞且对于免疫监督是重要的。T细胞或T淋巴细胞是在细胞介导的免疫中发挥中枢作用的一类淋巴细胞。T细胞有两大亚型:杀伤T细胞和辅助T细胞。另外还有在调控免疫应答中发挥作用的抑制T细胞。杀伤T细胞只识别偶联至I类MHC分子的抗原,而辅助T细胞只识别偶联至II类MHC分子的抗原。抗原呈递的这两种机制反映两类T细胞的不同作用。第三者次要亚型是识别未结合至MHC受体的完整抗原的γδ T细胞。相反,B细胞抗原特异性受体是B细胞表面上的抗体分子,且识别整个病原体,不需要抗原加工。B细胞的每种谱系表达不同抗体,所以整套B细胞抗原受体代表身体能制造的所有抗体。
P-选择蛋白糖蛋白配体-1(PSGL-1)是由造血细胞表达的,且是已知启动细胞迁移的粘附分子选择蛋白家族(P,E,和L)的高度保守配体。选择蛋白是更宽的细胞粘附分子家族的一部分。PSGL-1能结合该家族的所有三个成员但以最高亲和力结合P-选择蛋白。PSGL-1(在大多数白细胞上表达的重度糖基化的唾液酸粘蛋白)具有作为白细胞在炎症中表达的血管选择蛋白上翻滚的选择蛋白配体和作为静息T细胞归巢入淋巴样器官的促进物的双重功能。已经发现PSGL-1在其它背景中发挥作用,诸如经由与趋化因子相互作用造血干细胞归巢至骨髓,祖细胞归巢至胸腺,和T细胞归巢至SLO。PSGL-1缺陷看来以至少三种不同方式影响CD8+ T细胞体内稳态:1)通过干预T细胞进入淋巴结,由此限制到达淋巴结中的体内稳态性细胞因子和其它促存活信号;2)通过延长淋巴结驻留时间,由此延长T细胞对其中促存活信号的暴露;和3)通过提高T细胞对细胞因子的敏感性。
慢性病毒感染代表体内稳态的一种改变状态,即宿主和病原体之间在二者均幸存的情况下的复杂平衡,尽管付出遏制宿主免疫系统的代价。虽然认为粘附分子PSGL-1主要在细胞迁移中发挥功能,但是它的表达,信号传导能力,和结合特异性提示感染期间另外的作用。
PSGL-1是一种先前未认识的与多种免疫抑制性受体的表达水平有联系的T细胞应答的负调节物。因此,PSGL-1具有用于治疗免疫性和炎性病症,包括癌症的显著转化潜力。已经显示在鼠模型中PSGL-1缺陷使CD8+ T细胞能够发起更大的针对流感和淋巴细胞性脉络丛脑膜炎(LCMV)病毒的效应器应答,如通过增强的细胞毒性,细胞因子生成,和病毒清除测量的。此外,效应和记忆T细胞因改善的存活而以升高的频率存续。在LCMV变异株Cl13的一种慢性感染模型中,PSGL-1缺陷预防慢性感染。CD8+ T细胞保留效应器功能且不能形成衰竭的标志,包括PD-1以及数种其它抑制性受体的高表达。在黑素瘤患者的血液,淋巴结,和肿瘤浸润性细胞中找到具有衰竭特征的CD8+ T细胞。虽然抗PD-L1,PD-1,或CTLA-4的临床试验已经显示一些值得注意的功效,但是来自黑素瘤患者的T细胞的研究提示阻断多种受体会具有更大影响的概念。既然PSGL-1 KO T细胞的更大功能与更低水平的多种抑制性受体有关,那么我们提出阻断PSGL-1可能具有改善针对黑素瘤的T细胞免疫应答所必需的属性。PSGL-1还由调节性T细胞(Tregs)和DC表达,它们的耐受原性功能随PSGL-1缺陷而丧失。如此,阻断PSGL-1不仅能增强效应T细胞的应答,而且还能限制Treg和DC的免疫遏制性应答。
如下文实施例中描述的,确立了PSGL-1出乎意料地作为T细胞功能的调节物发挥作用,慢性病毒能利用它将效应T细胞免疫保持于阻止(check),如此允许持久感染但也限制免疫介导的宿主组织损伤。在PSGL-1缺陷宿主中,CD8+和CD4+ T细胞不能获得T细胞衰竭的标志,取而代之,发育成有力的多功能效应器,它们维持于升高的水平并一起促进早期病毒清除,这是机制上需要CD4+ T细胞的结局。这种有效的抗病毒免疫与CD8+和CD4+ T细胞二者上降低的抑制性受体表达以及升高的促炎性细胞因子的系统水平和免疫病理学有联系。在CD4+ T细胞缺失下,PSGL-1缺陷小鼠中的CD8+ T细胞不能下调抑制性受体,展示功能性衰竭,且不能支持病毒清除。因此,解除CD4+细胞的PSGL-1依赖性抑制对于诱导CD8+ T细胞的有效抗病毒应答是关键的。PSGL-1还在限制CD8+和CD4+效应细胞存活方面发挥T细胞固有作用,这也可能有助于降低的病毒控制。
Cl13感染后的持久病毒复制通过压制三种存活细胞因子IL-2,IL-7,和IL-21的生成,利用度,和应答来驱动CD8+ T细胞衰竭和凋亡。重要的是,PSGL-1缺陷与升高且持续的IL-7Rα以及Bc1-2表达有关,提示增强的IL-7Rα信号传导提供一种改善效应器T细胞存活的机制。这一结论得到治疗性施用IL-7扩充病毒特异性CD8+ T细胞,提高它们的效应器功能,及阻止持久Cl13感染的发现的支持。PSGL-1缺陷CD8+ T细胞上的升高的高亲和力IL-2受体CD25表达和来自CD4+ T细胞的更大的IL-2利用度也能构成改善的CD8+以及CD4+ T细胞存活和功能。先前的研究显示IL-2在施用于Cl13感染小鼠时提高病毒特异性CD8+ T细胞且降低病毒载荷。既然CD8+ T细胞的渐进性功能丧失能通过TGF-α介导的凋亡(能通过IL-2和1L-7逆转)导致高亲和力克隆的消除,那么我们的发现提示增强的对病毒特异性CD8-+ T细胞的IL-7和IL-2信号组合起来能有助于存活的机制。然而,既然在PSGL-1缺陷小鼠中的CD8+ T细胞应答的峰处检测到升高的IL-21血清水平且IL-21在慢性LCMV感染期间维持病毒特异性CD8+ T细胞,那么这种由CD4+ T细胞以及其它细胞类型生成的γc细胞因子也能有助于病毒特异性CD8+ T细胞存活的机制。还观察到升高的IL-6水平,这是T滤泡辅助细胞(Tfh)的生成和功能所必需的,由此导致改善的抗体应答,有助于最终控制慢性LCMV。下文描述的结果指示在WT小鼠中,通过限制针对数种促存活细胞因子的病毒特异性CD8+和CD4+ T细胞存活应答和通过约束牵涉CD4T细胞辅助的关键细胞因子的生成,PSGL-1在压制针对Cl13的T细胞应答方面发挥中枢作用。
慢性病毒感染将抗病毒T细胞应答维持于功能障碍的状态,与数种免疫抑制性受体有关。惊人的是,每一种所分析的受体(PD-1,CD160和BTLA)在Cl13感染后在PSGL-1缺陷CD8+和CD4+效应器上下调且抗病毒应答显著改善。结果暗示PSGL-1在正常情况下是阻止过度T细胞应答的调节程序的一个关键部分。PSGL-1缺陷对静息T细胞没有明显影响,也不导致固有的炎性应答;然而,它的缺失在Cl13感染后导致免疫病理学和升高的死亡率。这强调了PSGL-1在平衡过度的T细胞应答和宿主组织破坏与存留抗原中的功能。在机制上,发现了在抗原刺激期间连接PSGL-1导致衰竭的CD8+ T细胞的存活降低和剩余存活细胞上的PD-1上调,指示PSGL-1信号传导与这种受体的表达有联系。
通常与CD8+ T细胞功能障碍有关的转录调节的变化包括homes的表达降低和T-bet增强,有利于慢性感染期间的效应器分化,与急性感染期间的记忆形成相反。这些转录因子在慢性LCMV感染中具有相反作用,更多衰竭的病毒特异性CD8+ T细胞表达更高水平的homes和降低的T-bet水平。既然升高的T-bet表达遏制PD-1表达,那么PSGL-1缺陷引起降低的homes和更多的T-bet是惊人的,进一步支持衰竭标志物和转录调节的变化与PSGL-1表达有联系的概念。
在许多细胞类型上能找到高PSGL-1表达,包括DC和Treg,它在那里与功能性调节有关,描绘耐受原性DC和大多数抑制性Treg。因此,PSGL-1能对在慢性感染期间间接有助于T细胞功能障碍的其它细胞发挥作用。然而,我们的结果指示这些效应器如果在PSGL-1缺陷的背景中发生的话需要CD411-T细胞的活性来实现PSGL-1的调节活性。已经报告了PSGL-1缺陷小鼠具有细微表型,而且我们的数据指示感染是诱导深刻的PSGL-1依赖性抑制效应所必需的。尽管有改变的前T细胞到胸腺和幼稚CD4+ T细胞到淋巴结的运输,外周幼稚T细胞看来在PSGL-1缺失下正常生成,虽然记忆表型细胞有些增多,可能是由于更大的周转。鉴于PSGL-1缺陷对效应器细胞存活的T细胞内在影响和CD4+ T细胞消减对增强的抗病毒免疫的逆转,PSGL-1缺陷背景中的调节的更多细微方面看来对这项研究的结局没有实质性贡献。
最近的抗PD-1/PD-L1和/或CTLA-4的临床试验支持针对慢性病毒或肿瘤的免疫能通过干预抑制性途径来改善的概念。而且,靶向抑制性受体组合能导致更大的功效,而且,由于多种抑制性受体受到PSGL-1降低,因此这种受体可能是一种新靶物,它的抑制可能改善数种临床背景中的T细胞应答。
在一个实施方案中,本发明提供一种治疗T细胞介导的疾病或病症的方法,其包括对有需要的受试者施用P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂。在一个方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个另外的方面,该传染病是肉毒中毒,淋巴腺鼠疫(黑死病),杯状病毒感染(诺如病毒和札幌病毒),禽痘(水痘),衣原体,霍乱,艰难梭菌感染,感冒(急性病毒性鼻咽炎;急性鼻炎),克-雅二氏病(CJD),登革热,白喉,埃博拉出血热,淋病,手足口病(HFMD),幽门螺杆菌感染,甲型肝炎,乙型肝炎,丙型肝炎,丁型肝炎,戊型肝炎,单纯疱疹,人免疫缺陷病毒(HIV),人乳头瘤病毒(HPV)感染,埃-巴二氏病毒传染性单核细胞增多症(传染性单核细胞增多症),流行性感冒(流感),军团杆菌病(军团病),麻风病,莱姆病(莱姆疏螺旋体病),疟疾,马尔堡出血热(MHF),麻疹,中东呼吸综合征(MERS),脑膜炎,腮腺炎,百日咳,瘟疫,进行性多灶性脑白质病,狂犬病,鼻病毒感染,洛基山斑点热(RMSF),风疹,沙门氏菌病,SARS(严重急性呼吸综合征),疥疮,败血症,志贺氏菌病(杆菌性痢疾),缠腰龙(带状疱疹),痘症(天花),梅毒,破伤风(牙关紧闭症),结核病,伤寒,谷热,病毒性肺炎,西尼罗河热和黄热病。在某个方面,该癌症是前列腺,结肠,腹部,骨,乳腺,消化系统,肝,胰腺,腹膜,内分泌腺(肾上腺,甲状旁腺,垂体,睾丸,卵巢,胸腺,甲状腺),眼,头和颈,神经(中枢和周围),淋巴系统,骨盆,皮肤,软组织,脾,胸部,或泌尿生殖道。在又一个方面,该自身免疫性病症是阿狄森氏病,肌萎缩侧索硬化,克罗恩氏病,库欣氏综合征,1型糖尿病,移植物抗宿主病,格雷夫斯氏病,格-巴二氏综合症,红斑狼疮,多发性硬化,银屑病,银屑病关节炎,类风湿性关节炎,结节病,硬皮病,系统性红斑狼疮,移植排斥,或血管炎。在一个具体方面,该PSGL-1调控剂是激动剂和该T细胞介导的疾病或病症是自身免疫性或炎性疾病或病症。在某些方面,该PSGL-1调控剂是拮抗剂和该T细胞介导的疾病或病症是癌症或传染病。
在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或降低。在一个方面,CD25和T-bet的表达升高。在另一个方面,病毒清除升高。在一个另外的方面,该方法进一步包括施用治疗剂。在又一个方面,该治疗剂是免疫调控剂,化疗剂,抗病毒剂,抗细菌剂或抗真菌剂。
在一个另外的实施方案中,本发明提供一种引发T细胞应答的方法,其包括对有需要的受试者施用PSGL-1调控剂。在一方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或升高。在一个方面,CD25和T-bet的表达升高。
在又一个实施方案中,本发明提供一种恢复T细胞功能的方法,其包括对有需要的受试者施用P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂。在一方面,该PSGL-1调控剂是激动剂或拮抗剂。在另一个方面,该T细胞介导的疾病或病症是传染病,癌症,自身免疫性病症或炎性病症。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个具体方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。在另一个方面,CD4+依赖性CD8+ T细胞应答升高。在一个另外的方面,病毒特异性T细胞升高。在另一个方面,Treg和DC应答升高。在又一个方面,FoxP3,IL-10,TGF-β和/或II类MHC的表达升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表达降低或升高。在一个方面,CD25和T-bet的表达升高。在一个另外的方面,该方法进一步包括施用治疗剂。在又一个方面,该治疗剂是免疫调控剂,化疗剂,抗病毒剂,抗细菌剂或抗真菌剂。
在一个实施方案中,本发明提供一种药物组合物,其包含P-选择蛋白糖蛋白配体-1(PSGL-1)调控剂和制药学载剂。在一个方面,该PSGL-1调控剂是抗体,小分子,蛋白质,融合蛋白或核酸。在一个另外的方面,该抗体是单克隆抗体,嵌合抗体,人抗体或人源化抗体。
本发明在它的所有方面在下面的实施例中进一步例示。然而,实施例并非限制本发明的范围,本发明的范围由所附权利要求书来限定。
实施例
实施例1
PSGL-1表达在病毒特异性CD8+ T细胞上升高且PSGL-1缺陷小鼠在Cl13感染期间具有病毒特异性T细胞积累
为了在慢性病毒感染中研究PSGL-1,使用LCMV Cl13病毒,其到感染后90天导致病毒血症及到感染后200天导致脑和肾中可检测的病毒。首先通过四聚体染色来检查对GP33-41+LCMV表位特异性的CD8+ T细胞上的PSGL-I水平。虽然所有T细胞表达PSGL-1,但是与幼稚CD8+ T细胞相比病毒特异性上的水平升高(图1a)。为了检查PSGL-1对抗病毒应答的贡献,用Cl13感染WT或PSGL-1缺陷小鼠并分析对LCMV GP33-41+和NP396-404+表位特异性的CD8+ T细胞。PSGL-1缺陷小鼠在感染后8天具有大大升高的GP33-41+ CD8+ T细胞频率和数目(图1b)。直到感染后4天后没有观察到CD8+ T细胞积累的差异(图8a-b),而且四聚体细胞维持到感染后30天(图8c-e)。印象最深刻的是PSGL-1缺陷小鼠中NP396-404+ T细胞的保留(图1b,c),因为这些细胞在WT小鼠中到感染后30天大量删除(图8c-e)。还发现病毒特异性GP66-76+ CD4+ T细胞在PSGL-1缺陷小鼠中升高(图1d,e)。到感染后5天观察到这种差异(图7a)。
因为内皮上E-和P-选择蛋白对T细胞上PSGL-1的啮合对于迁移至发炎部位可能是重要的,所以PSGL-1缺陷小鼠中血液和脾中的CD8+ T细胞积累可能源自对周围部位的迁移受损。检查代表备选感染部位的肺,与脾不同,肺的T细胞进入需要粘附受体调节。与脾中的发现一致,PSGL-1缺陷小鼠的肺中的病毒特异性CD8+(图9a,b)和CD4+ T细胞(图9c,d)积累至比WT小鼠中更大的程度。结果显示在PSGL-1缺陷小鼠中,病毒特异性T细胞以比WT细胞惊人地更高数目得到保留。
实施例2
PSGL-1缺陷CD8+ T细胞具有增强的存活
增强的增殖和/或存活可能解释PSGL-1缺陷小鼠中病毒特异性T细胞的积累。为了评估增殖,在感染后8天分析病毒特异性CD8+ T细胞的体内BrdU掺入。BrdU标记-50%的WT GP33-41+CD8+ T细胞,但是仅仅标记-25%的PSGL-1缺陷GP33-41+CD8+ T细胞(图2a)。类似地,比PSGL-1缺陷CD4+病毒特异性细胞多2倍的WT GP66-76CD4+ T细胞掺入BrdU(图2b)。因为分裂看来不能解释PSGL-1缺陷CD8+ T细胞的数目更大,所以检查CD8+效应细胞的存活分子IL-7Rα及其下游信号传导靶物Bc1-2的表达水平。在感染后10天,来自PSGL-1缺陷小鼠的GP33-41+和NP396-404+ T细胞均展示与WT细胞相比升高的IL-7Rα(图2c)和Bc1-2(图2d)水平。而且,贯穿扩充期,PSGL-1缺陷病毒特异性CD8+ T细胞上的IL-7Rα水平比WT细胞上的要高(图10a,b)。来自PSGL-1缺陷小鼠的GP33-41+和NP396-404+ T细胞上的CD25水平也升高(图2e),而能增强T细胞存活的其它细胞因子的受体相似或降低,包括IL-21R,CD122和IL-6R(图10c-e)。总之,这些发现指示PSGL-1缺陷小鼠中病毒特异性CD8+ T细胞的积累最有可能是存活增强的结果。
实施例3
PSGL-1缺陷小鼠中的病毒特异性CD4+和CD8+ T细胞是多功能效应器
因为WT小鼠中的慢性病毒感染导致CD8+ T细胞连续丧失生成IFN-γ,TNF-α,和IL-2,以及同时生成超过一种这些细胞因子的能力,所以检查细胞因子生成。找到与WT细胞相比频率高得多的分泌IFNγ和IFN-γ+TNF-α二者的PSGL-1缺陷GP33-41+ T细胞(图3a)。NP396-404+ T细胞应答也是功能性的(图3b)。在每个细胞的基础上,WT中-10%的GP33-41+ T细胞生成IFN-γ,较之PSGL-1缺陷小鼠中的-70%(图3a)。而且,病毒特异性PSGL-1缺陷CD8+ T细胞生成显著更高水平的细胞因子(图11a,b)。GP33-41+和NP396-404+PSGL-1缺陷CD8+ T细胞二者具有增强的CD107a水平,指示更好的细胞毒性脱粒,连同IFN-γ分泌(图3c),尽管WT和PSGL-1缺陷GP33-41+CD8+ T细胞就粒酶B(Gzrnb)蛋白质水平而言没有差异(图3d)。
转录程序在急性较之慢性LCMV感染中有差异。虽然T-bet在急性感染期间调节CD8+ T细胞效应和记忆分化中是重要的,但是在Cl13感染期间衰竭的CD8+ T细胞具有降低的T-bet表达,这起到维持PD-1水平的作用。因为T-bet能直接结合编码PD-1的Pdcdl基因并遏制它的表达,所以检查病毒特异性CD8+ T细胞中的T-bet水平,发现感染后10天PSGL-1缺陷小鼠中的GP33-44+ T细胞中的表达与WT细胞相比升高(图3e)。而且,高Eomes水平(其标记WTCl13感染小鼠中注定死亡的终末分化的CD8+ T细胞)在PSGL-1缺陷小鼠中的GP33-41+ T细胞中降低(图3f)。如此,虽然WT小鼠中的CD8+ T细胞在Cl13感染期间发育衰竭,但是它们在PSGL-1缺陷小鼠中改为生成多功能效应器。
CD4+ T细胞消减的Cl13感染小鼠控制病毒血症失败突显CD4+ T细胞在持久感染期间的重要性。对GP66-76+CD4+细胞还观察到就细胞因子生成而言改善的功能性(图3g,图11c-e)。不仅与来自WT小鼠的那些相比来自PSGL-1缺陷小鼠的更多病毒特异性CD4+ T细胞生成升高的IFN-γ,TNF-α,和IL-2,而且这些病毒特异性CD4+ T细胞是多功能的,有增多数目的双重/三重细胞因子生成者(图3g)也生成更高水平的细胞因子(图11c-e)。这些发现证明在Cl13感染后PSGL-1缺陷小鼠中发育比WT小鼠中更大数目的功能上卓越的病毒特异性CD4+ T效应细胞。
实施例4
PSGL-1缺陷T细胞具有降低的抑制性受体表达
因为T细胞衰竭部分是包括PD-1,CD1 60,Lag-3,和BTLA在内的多种抑制性分子表达的后果,所以检查感染后WT和PSGL-1缺陷小鼠中病毒特异性T细胞上的这些受体。发现PSGL-1缺陷小鼠中病毒特异性GP66-76+CD4+ T细胞上的PD-1水平到感染后7天开始降低,且在第8天进一步降低(图4a,b)。此时,PSGL-1缺陷CD4T细胞上的BTLA水平也降低(图4b)。同样地,与WT相比,PSGL-1缺陷CD8+ T细胞在感染后8天表达更低水平的PD-1,但相似水平的CD160和BTLA(图12a,b)。到感染后9天PSGL-1缺陷病毒特异性CD8+ T细胞显示所有三种受体的表达均降低(图4c,d)。而且,PD-1下调在感染后15,30,和112天维持(图12c-e)。这些发现指示,虽然不是受到配合调节,但是降低的抑制性受体水平与Cl13感染后PSGL-1缺陷小鼠中病毒特异性CD4+和CD8+ T细胞中的功能性有关。
实施例5
病毒特异性PSGL-1缺陷T细胞的积累是细胞固有的
为了研究PSGL-1缺陷小鼠中改善的针对Cl13的应答的哪些特征是T细胞固有的,使用对LCMV的GP33-41表位特异性的WT和PSGL-1缺陷TCR转基因CD8+P14细胞并将这些细胞转移至WT宿主。离体直接检查WT和PSGL-1缺陷P14细胞的活化状态,发现相似的CD44和CD62L(图13a),及CD25,CD69,和IL-7Rα(图13b)表达水平。然后以1:1比率将WT和PSGL-1缺陷P14细胞共转染入WT宿主,并在一天后用Cl13感染小鼠。在感染后5和7天在脾(图5a)和肺(图5b)发现升高的PSGL-1缺陷P14细胞对WT P14细胞比率。感染后13天脾中更大的PSGL-1缺陷P14细胞数目(图5c)和脾和肺中升高的频率(图13c)也反映这种升高。这种积累不是增殖升高的结果,如通过感染后8天(数据未显示)和感染后13天(图13d,e)的BrdU掺入测量的,这支持PSGL-1缺陷T细胞的存活比WT细胞更好的概念。而且,WT和PSGL-1缺陷P14细胞中的CFSE稀释在感染后2天时相同,事实上此时WT细胞具有轻微的积累优势(图5e)。尽管积累更多,PSGL-1缺陷细胞在WT环境中响应Cl13感染时并不出乎意料地展现衰竭表型(降低的细胞因子生成和较高的PD-1)(数据未显示)。如此,虽然PSGL-1缺陷病毒特异性CD8+ T细胞的积累是细胞固有的,但是它们的功能性恢复依赖于PSGL-1缺陷环境中的其它因子。接着,对WT和PSGL-1缺陷转基因Smarta CD4+ T细胞检查病毒特异性CD4+细胞中PSGL-1的功能。当共转染至WT小鼠时,在感染后在脾(图5a)和肺(图5b)中在感染后5和7天观察到升高的PSGL-1缺陷对WT细胞比率,及平行升高的数目(图5d)。尽管具有细胞固有存活,在WT环境中未能功能性挽救CD8+和CD4+PSGL-1缺陷效应器二者。
实施例6
PSGL-1连接降低衰竭的CD8+ T细胞的存活
为了测定PSGL-1连接对病毒特异性CD8+ T细胞的影响,在感染后9天分离来自WT小鼠的脾细胞,这个点时CD8+ T细胞是功能性衰竭的。GP33-41刺激4天后发现-7%可存活四聚体+CD8+ T细胞(图5f)。当在抗PSGL-1抗体存在下用GP33-41肽刺激脾细胞时,四聚体CD8+ T细胞存活降低-50%,达到与只含有IgG或抗PSGL-1的培养基的培养物中的水平相似的水平(图5f)。PD-1水平在肽刺激后升高,而且当肽刺激期间存在抗PSGL-1时这些水平进一步升高(图5g)。这些结果显示抗原刺激期间的PSGL-1连接限制病毒特异性CD8+ T细胞的存活且能增强它们的PD-1表达。
实施例7
PSGL-1缺陷小鼠清除慢性LCMV控制但显示增强的免疫病理学
因为与WT相比在PSGL-1缺陷小鼠中观察到改善的功能性CD4+和CD8+ T细胞应答连同降低的免疫抑制性受体表达,所以检查PSGL1缺陷小鼠控制Cl13病毒的能力。发现与至感染后30天具有升高的病毒血症的WT小鼠相比,PSGL-1缺陷小鼠到感染后15天自血液清除病毒(图6a)。然而,改善的抗病毒T细胞应答与>50%死亡率有关,死亡在感染后8天开始(图6b)。为了研究系统性炎症,检查促炎性细胞因子,观察到PSGL-1缺陷小鼠具有显著升高的IL-6,IL-21,TNF-α,和IFN-γ血清水平(图6c)。而且,感染后8天时包括肺浸润物(图6d,图14a),水肿,和炎症(图6d,e)在内的肺免疫病理学在PSGL-1缺陷感染小鼠中升高。升高的病理学在肾,肝,和肠中也是明显的(图14a,b)。如此,尽管PSGL-1缺陷小鼠控制病毒复制比WT小鼠有效得多,但是这由于免疫病理学而导致广泛的炎症和升高的死亡率。因此,PSGL-1发挥限制过度旺盛的效应器应答的功能。
实施例8
PSGL-1缺陷小鼠中的最佳病毒特异性CD8+ T细胞功能需要CD4+ T细胞
到感染后5天在PSGL-1缺陷小鼠中观察到GP66-76+CD4+ T细胞增多,而且至感染后9天进一步提高积累(图7a),与CD4+ T细胞中的PSGL-1缺陷在影响CD8T细胞应答中的作用一致。为了检查它们的贡献,通过施用抗CD4抗体来消减来自PSGL-1缺陷小鼠的CD4+ T细胞。将针对Cl13的CD8+ T细胞应答与来自用对照抗体处理的小鼠的PSGL-1缺陷CD8+ T细胞的或WT T细胞的比较。发现CD4+ T细胞消减的PSGL-1缺陷小鼠具有降低至WT小鼠中找到的水平的GP33-41+和NP396-404+ CD8+ T细胞频率(图7b)。而且,感染后10天它们具有与具有CD4+ T细胞的PSGL-1缺陷小鼠相比降低的IFN-γ和IFN-γ+TNF-α+ CD8+ T细胞数目(图7c)。这映射为GP33-41+和NP396-404+ T细胞上PD-1水平的变化,它们保持升高且与WT细胞上的水平相似(图7d)。与血清Cl13水平在感染后10天时降低的PSGL-1缺陷小鼠不同,在CD4+ T细胞消减小鼠中,病毒水平保持与WT小鼠中的相当(图7e),而PSGL-1缺陷小鼠中的滴度此时在降低中。而且,感染后10天后PSGL-1缺陷小鼠的死亡率在CD4+ T细胞消减小鼠中得到阻止(图7e)。这些结果显示,对于病毒特异性PSGL-1缺陷CD8+ T细胞要逃避功能性衰竭,它们需要来自CD4+ T细胞的帮助。如此,通过它们改善的数目和功能,确定了CD4+ T细胞在PSGL-1缺陷背景中调控CD8+ T细胞功能。
实施例9
材料和方法
小鼠。C57BL/6.1小鼠和Selplg-/-小鼠购自Jackson laboratories。在Sanford-Burnham医学研究所,在无特定病原体的设备中繁殖和维持小鼠并在常规BSL-2设备中感染小鼠。将Selplg-/-小鼠与C57BL/6J小鼠回交超过10代。PI4和Smarta TCR转基因小鼠得自Charles D.Surh(Scripps研究所)。将这些小鼠与Ly5.1(B6.SJL-Ptprca Pepcb/BoyJ)小鼠和Thy1.1(B6.PL-Thy la/CyJ),Selplg-/-小鼠繁殖。用于实验的小鼠为至少6周龄。实验符合Sanford-Burnham医学研究所IACUC规章并得到兽医批准。
感染,增殖,和细胞转移。在幼仓鼠肾细胞中繁殖LCMV Cl13株并在Vero非洲绿猴肾细胞上滴定。用M Vero细胞培养基稀释冷冻的储液并静脉内注射2x106个噬斑形成单位(PFU)LCMV Cl13。为了评估增殖,在感染后第8或13天对小鼠腹膜内注射2mg BrdU(Sigma-Aldrich),16小时后自脾和肺分离淋巴细胞。对于过继性转移,纯化WT P14和PSGL-1 KO P14细胞(Stemcell Tech)并在1天后将1x103个细胞静脉内转移入用LCMV Cl13感染的WT小鼠。
流式细胞术和染色。在补充有FACS染色缓冲液(2%FBS和0.01%叠氮化钠)的PBS中对细胞进行针对四聚体染色的表面染色,4℃20分钟或室温1小时15分钟。使用来自Biolegend的下述抗体:抗CD8α(克隆53-6.7),抗PD-1(克隆RMP1-30),抗CD4(克隆GKI.5),抗CD90.1(克隆OX-7),抗CD45.1(克隆A20),抗IL-21R(克隆4A9),抗CD126(克隆D7715A7),抗CD44(克隆IM7),抗CD62L(克隆MEL-14)。下述克隆来自eBioscience:抗CD127(IL-7Ra克隆A7R34),抗CD160(克隆ebiocnx-3),抗BTLA(克隆6f7)。下述抗体来自BD:抗CD122(克隆TM-(31),抗BcI-2(克隆3F11),抗CD107(克隆1D4B),抗CD162(克隆2PH1),抗CD25(克隆3C7),抗CD69(克隆H12F3),抗Vα2(克隆B20.1)。H-2Db-GP33-41,H-2Db-NP396-404四聚体购自Beckman Coulter。lAb-66-77四聚体由NIH核心机构提供。将细胞用FACS染色缓冲液清洗两次并用含1%甲醛的PBS固定15分钟。清洗细胞两次,并在FACS染色缓冲液中重悬浮。对于细胞内细胞因子染色,用Cytofix/Cytoperm试剂盒(BD)固定并透化细胞,并用抗GzmB(克隆MHGBO5:invitrogen),抗TNF-α(克隆MP6-XT22:biolegend),抗IFN-γ(克隆XIVIG1.2:Biolegend),抗IL-2(克隆JES6-5H4:eBioscience)染色。使用来自eBioscience的试剂盒实施BrdU染色。对于转录因子检测,使用FoxP3染色试剂盒(eBioscience)固定并透化细胞,并用抗Tbet(克隆4B10:Biolegend),抗Eomes(克隆Dan11mag:eBioscience)染色。在LSRFortessa流式细胞仪(BD)上分析经过染色的细胞。
离体肽刺激。将2x106个来自感染动物的脾细胞接种入96孔圆底板。将细胞用2pg/mL GP33-41,NP396-404或GP61-80肽(AnaSpec),50U/mL IL-2(NCI),和1μg/ml布雷菲德菌素A(Sigma)于37℃体外(in vita-o)刺激5小时。然后对经过刺激的细胞清洗,表面染色,然后细胞内染色。
离体PSGL-1连接。将2x106个来自第9天LCMV Cl13感染动物的脾细胞接种入96孔圆底板。将细胞用补充有10mM hepes(Cellgro),1x MEM非必需氨基酸(Cellgro),1mM丙酮酸钠(Cellgro)和10%热灭活FBS(Hyclone)的RPMI-1640(Cellgro)培养基中的50U/mL IL-2(NIH)及下述条件于37℃体外刺激4天:10μg/mL大鼠IgG(JacksonImmunoResearch),10μg/mL抗PSGL-1(4RAIO BioXCell),2pg/mL GP33-41(AnaSpec),或抗PSGL-1(4RA10BioXCell)+2μg/mL GP33-41(AnaSpec)。然后清洗培养细胞,并用碘化丙啶(1μg/mL)于室温染色10分钟。清洗细胞并在FRCS染色缓冲液中用抗CD8αa,H-2D-GP33-41四聚体(Beckman Coulter),抗PD-1于室温染色1小时15分钟。在LSRFortessa流式细胞仪(BD)上分析经过染色的细胞并通过排除PI+细胞来确定活细胞。
CFSE标记。自未感染WT和PSGL-1 KO P14TCR转基因小鼠(Stemcell Tech)的脾负富集CD8+ T细胞。合并相等数目的经过纯化的WT和PSGL-1 KO P14细胞,用5μM CFSE(Life Technologies)于37℃标记10分钟,并用PBS清洗。以1:1比率(各1x106个细胞)将WT和PSGL-1 KO P14细胞静脉内共转移入WT接受者。用2x106PFU LCMV Cl13感染WT宿主并在感染后2天通过FACS检查CFSE稀释。
CD4消减。小鼠在第-1和0天接受CD4消减性抗体(克隆GM.5,BioXCell)的两次500μg腹膜内注射,然后用LCMV Cl13感染。在经过处理的小鼠的血液和脾中确认CD4消减的功效。
细胞因子和病理学。在感染后8天自WT和PSGL-1 KO小鼠分离血清并使用一种多路9珠定制细胞因子阵列(Millipore)检查IL-6,IL-21,TNF-α,和IFN-γ的细胞因子水平。在Luminex IS200仪器上分析样品。在福尔马林锌(z-fix Anatech)中固定肝,肾,和肺,在石蜡中包埋,并切片。用H&E对组织染色并使用Aperio ScanScope数码扫描。病理学打分是由病理学家对组织样品的盲评。得分范围为0-3.5,零指示无病理且更大的得分指示升高的病理。
数据分析。使用FlowJo软件(TreeStar)分析流式细胞术数据。使用GraphPad Prism软件制图。
统计分析。使用GraphPad Prism软件使用Student t检验分析实验组,显著性设置为p<0.05。使用Mantel-Cox和Gehan-Breslow-Wilcoxon检验比较存活曲线。
实施例10
抗病毒应答
在LCMV Cl13病毒在小鼠中产生慢性感染的研究中,发现PSGL-1缺陷导致感染后数目增多的病毒特异性CD8+ T细胞(图15A,B),其至少延伸至第30天(图15C),指示对T细胞持久性的持续影响。这一发现对于在Cl13感染后删除的NP396-404特异性T细胞是值得注意的。这一效果是由于改善的T细胞存活而非升高的扩充(未显示)。因为PSGL-1调节白细胞归巢且LCMV感染是系统性的,所以测试周围部位(在这种情况中是肺)的T细胞募集以查看是否有影响。然而,PSGL-1 KO小鼠中有比WT小鼠中数目要多的病毒特异性T细胞(图15D),排除迁移能力的总体受损。CD8+ T细胞在Cl13感染后逐渐丧失效应器功能,首先是生成IL-2,TNF-α的能力,最后是IFN-γ和CTL活性。在有效抗病毒应答中,CD8+ T细胞同时表达多种效应器功能。如图16中显示的,来自PSGL-1 KO小鼠的GP33-41特异性T细胞和NP396-404特异性T细胞均展现比来自WT小鼠的病毒特异性CD8+ T细胞频率要高的IFN-γ+和IFN-γ/INF-α双重阳性细胞(图16A,B),指示更大的功能性。细胞毒性脱粒与IFN-y生成组合也更大(图16C)。数据证明PSGL-1对CD8+ T细胞应答具有出乎意料的抑制效果。
衰竭的CD8+ T细胞特征在于表达多种免疫抑制性受体,特别是PD-1,还有BTLA,CD160,LAG 3,TIM-3,和2B4。发现CD8+ T细胞上水平降低的抑制性受体与GP33-41和NP396-404特异性T细胞二者改善的功能有关(图17)。还发现更低水平的2B4和LAG 3(未显示)。分析WT和PSGL-1 KO小鼠中响应Cl13的CD4+ T细胞。如为CD8+ T细胞显示的,KO小鼠中有频率大大升高的病毒特异性CD4+ T细胞(图18A),它们与更好的存活有关。而且,来自PSGL-1 KO小鼠的病毒特异性CD4+ T细胞生成比WT小鼠要多的细胞因子,而且还有更多的多功能细胞(图18B)。更大的功能与抑制性受体PD-1和BTLA的表达降低有关(图18C)。这些数据指示PSGL-1具有比在T细胞中介导迁移要宽的功能且作为CD8+和CD4+ T细胞应答二者的抑制剂起作用。为了确定改善的T细胞功能和存活是否影响抗病毒应答,测量病毒清除。如图17A中显示的,PSGL-1缺陷使Cl13病毒能够被清除。在PSGL-1 KO小鼠的血清中检测到与WT小鼠相比水平要高的细胞因子IL-6,1L-21,TNF-α,和IFN-γ(图19B),如此为改善的应答提供一项读出。为了在抗病毒免疫中进一步研究PSGL-1,分析感染受到免疫系统快速清除的Armstrong LCMV株后的PD-1表达水平。观察到这种设置中更大的CD8+ T细胞持久性(图20)及PD-1对NP396-404(图20A)比GP33-41(图20B)病毒特异性CD8+ T细胞更早且更显著的影响。对于这两种克隆,均观察到PSGL-1 KO T细胞更低水平的PD-1(图20C)。为了研究是否能靶向PSGL-1上的PD-1水平,在感染甲型流感病毒(IAV)或Cl13LCMV后对WT小鼠施用抗PSGL-1阻断性抗体(4RA10)或对照IgG。抗PSGL-1处理组具有频率升高的病毒特异性CD8+ T细胞(未显示)且这些细胞表达比对照水平要低的PD-1(图20D)。总之,发现指示PSGL-1在下调T细胞应答中具有先前未知的总体作用。
实施例11
BRAFV600E PTEN黑素瘤模型
攻击性人黑素瘤的当前可得的最好的鼠模型之一是一种诱导型遗传模型,其组合约65%的患者中存在的BRAFV600E突变与PTEN沉默,这是在约20%的患者中找到的一种组合。BRAFV600E和PTEN删除的Cre/Lox诱导在黑色素细胞中受到通过用他莫昔芬局部处理皮肤活化黑色素细胞-酪氨酸酶启动子Try:CreER的暂时控制。有100%的外显率到2周时发生色素性病变及到1个月时发生转移性疾病。检测到皮肤相关肿瘤内的CD3+ T细胞和CD45+单个核细胞(数据未显示)。通过流式细胞术分析肿瘤。容易检测到CD4+和CD8+ T细胞二者(图21A,B,左边小图)。PSGL-1在约1/2的CD4+细胞上表达,而且正是这些细胞具有高PD-1(图21A,中间和右边小图)。CD8+ T细胞唯独是PSGL-P,具有混合的PD-1表达(图21B)。而且,在黑素瘤阳性耳中,在活化的CD44+CD8+ T细胞上检测到升高的PD-1和PSGL-1表达(图22A)。这些衰竭的PD-1高T细胞也具有功能性PSGL-1结合(图22B)。这些发现指示肿瘤浸润性CD8+ T细胞具有升高的PD-1,PSGL-1和PSGL-1结合活性。在另外的研究中,通过用他莫昔芬局部处理皮肤活化黑色素细胞酪氨酸酶启动子Tyr::CreER,通过黑色素细胞中BRAFV600E突变和PTEN删除的Cre/Lox诱导在小鼠中诱导黑素瘤。在处理后1个月,我们通过流式细胞术在破裂的肿瘤内以高频率观察到CD3+ T细胞单个核细胞(图23A),和PSGL-1+,PD-1+(双重阳性)CD4+非Treg(效应T细胞)和Treg(图23B)。比较而言,在荷瘤小鼠或非荷瘤小鼠任一的皮肤引流LN中少数T细胞表达这两种分子。发现CD3+ T细胞分布遍及黑素瘤(图23A),而且CD4+非Treg以及Treg均是可检测的且共表达PD-1和PSGL-1(图23B)。来自这些小鼠的黑素瘤的另外的研究显示通过流式细胞术能容易区分免疫细胞,包括CD8+和CD4+ T细胞,Treg,MDSC和DC,NK细胞,NK T细胞,和巨噬细胞(图24)。
实施例12
在原发性和转移性黑素瘤内鉴定表达PSGL-1的细胞和它们的应答。
免疫细胞随黑素瘤发生而变化:通过在6周龄时在体侧对Tyr:CreER;Braf/Ptenlox/lox小鼠的4-羟基他莫昔芬(4-HT)处理,建立肿瘤生长的动力学和浸润物的发生。一旦检测到肿瘤,就以每周间隔使用免疫组织化学来评估肿瘤,特别关注CD44-和CD8+ T细胞和它们在肿瘤边缘较之浸润入肿瘤的定位。对于流式细胞术研究,比较原发性黑素瘤和引流LN并评估转移至其它皮肤部位,LN,和肺后发生的变化。4-HT处理后随时间分析肿瘤,引流淋巴结和非引流淋巴结,血液,脾,和肺中的CD8+,CD4+和FoxP3+Treg上的PSGL-1和抑制性受体表达(PD-1,Tim-3,Lag-1,BTLA,CTLA-4,和CD160)。B16黑素瘤模型的研究显示使用加载有pmel-1的肽gp10025-33(KVPRNQDWL)(由黑色素细胞以及恶性黑素瘤细胞表达的人黑色素体基质的一种结构成分(gp10025-33)的小鼠同源物)的MHC I类四聚体能监测肿瘤特异性CD84-T细胞。这种肽是由在BRAFV600E PTEN黑素瘤模型中诱导的黑素瘤表达的。因此,为了研究肿瘤特异性T细胞应答,使用商品化pmel-四聚体。研究黑素瘤特异性CD8+ T细胞的频率,它们的PSGL-1表达水平是否有变化及它们是否与总的CD8+ T细胞群体显示抑制性受体表达的差异。通过细胞因子生成(IL-2,IFN-γ,TNF-α)使用抗CD3刺激后的细胞内染色(ICS)来监测CD4+和CD8+ T细胞的功能,并使用pmel肽再刺激来评估肿瘤特异性CD8+ T细胞的细胞因子生成。对于CD8+ T细胞,通过粒酶B染色以及通过脱粒(通过测量CD107)测试细胞毒性活性。
通过与功能相关的FoxP3表达水平(16)测试Treg的免疫抑制性活性,以及通过ICS测试1L-10和TGF-β生成。评估黑素瘤和引流LN中效应CD4+和CD8+ T细胞对Treg的比率以测定皮肤中出现黑素瘤后随时间发生的变化。通过在饮用水中施用BrdU,在4-HT处理后1,2,3,或4周启动处理,分析黑素瘤,淋巴样组织,和血液中的T细胞来检查这些群体的扩充。为了进一步调查肿瘤微环境,分析DC(MHC II+,CD11c+),MDSC(Gr1+,CD11b+),和M4(F4/80+,CD11b+)的频率。为了研究这些群体中的功能,使用ICS来分析分别与免疫原性较之耐受原性DC(17),和M1较之M2巨噬细胞有关的IL-12和1L-10生成,而IL-10区分MDSC。
实施例13
测定靶向PSGL-1是否能延迟或控制黑素瘤及其转移的发生
PSGL-1对黑素瘤的影响。使用一种骨髓嵌合物办法,研究PSGL-1缺陷是否引起黑素瘤内或淋巴样隔室中免疫细胞的功能变化。通过将PSGL-1 KO骨髓注射入经过照射的Tyr:CreER;Braf/Ptenloxilox小鼠并在8周后用4-HT处理,在造血细胞中创建PSGL-1缺陷。对照接受WT骨髓。使用组织学和流式细胞术评估就肿瘤生长和转移而言的变化,以及肿瘤微环境,淋巴样隔室,肺和血液中的免疫细胞的频率和功能以及该免疫细胞上的抑制性受体表达的变化,关注那些研究中限定的最佳读出和时间点。通过组织学检查自身免疫/免疫病理的证据,因为抑制性受体的缺陷或阻断与炎症的发生有关。
图25显示PSGL-1缺陷小鼠中增强的抗肿瘤T细胞应答。接受黑素瘤细胞(Yumm 1.5)的皮下注射的WT(黑色柱或黑色圆圈)和PSGL-1 KO(白色柱或方框)(第14天的肿瘤重量和到注射后第12天的体积)(A)。效应CD8+(左边)和CD4+(右边)T细胞的绝对数/克肿瘤(B)。效应T细胞上的PD-1表达(C)。CD4+(D)和CD8+(E)T细胞的细胞因子生成。(F)中显示代表性细胞因子染色。
为了研究PSGL-1缺陷的T细胞固有影响,使用两种办法。第一,生成唯独在T细胞中删除PSGL-1的嵌合物,用于与具有等位基因标记WT细胞的嵌合物比较。为此,用80:20比率的TCR WS KO(CD45.2):PSGL-1 KO骨髓细胞(Thy1.1,CD45.2)重建经过致死照射的Tyr:CreER;Braf/Ptenlox/lox小鼠(Thy1.2,CD45.2)。8周后用4-HT处理小鼠并评估肿瘤的发生和转移及T细胞的应答。作为第二种办法,将pmel Tg小鼠与PSGL-1Thy1.1,CD45.2KO小鼠繁殖。以经过优化的剂量将自这些或WT pmel Tg小鼠(Thy1.1,CD45.2)分离的CD8+ T细胞注射入Tyr:CreER;Braf/Pten lox/lox(Thy1.2,Ly 5.2)。作为备选,我们使用自诱发的原发性黑素瘤衍生的一种黑素瘤细胞系(Yumm 1.5)。以5x105的剂量将肿瘤细胞皮下植入WT或PSGL-1缺陷小鼠(右体侧)。在图24中,通过体积和重量监测肿瘤生长(A),并测定效应CD8+和CD4+ T细胞的频率(B)。PSGL-1缺陷小鼠具有更小的肿瘤且含有数目更多的T细胞。T细胞表达更低水平的PD-1(C)且更具功能性,如通过细胞因子生成测量的(D-F)。
PSGL-1功能的免疫治疗性抑制。测定用激动性单抗(4RA10)或重组PSGL-1 Fc融合蛋白阻断PSGL-1是否能控制黑素瘤的生长和/或转移及逆转T细胞功能障碍。作为原发性黑素瘤的治疗以及在转移已经发生之后测试这些试剂。对于原发性肿瘤,比较将单抗局部注射入肿瘤与系统性处理。对于局部处理,在原发性肿瘤检测时使用起始剂100μg抗PSGL-1或对照IgG。对于系统性处理,腹膜内注射300μg/单抗/剂,隔天治疗,持续5天,而且跟踪动物的肿瘤生长和皮肤转移。在1个月时,对动物检查血液,脾,LN,和所示肿瘤中的pmel-四聚体+ CD8+ T细胞,它们的抑制性受体的表面表达,和它们的应答。在检测原发性肿瘤后1,2,3或4周时检测启动系统性单抗治疗的效果以研究抗PSGL-1是否能随疾病行进而影响抗肿瘤应答。作为阻断PSGL-1的第二种策略,施用PSGL-1Fc,以人Ig作为对照。每3-4天通过ELISA评估血清中的单抗和融合蛋白水平以测定半衰期及研究T细胞表型和/或应答是否随着这些试剂衰减而有变化。启动疗法后以每周间隔测量血清中的IL-6,IL-21,TNF-α,和IFN-γ水平以测定是否发生细胞因子水平变化,及是否有与改善的抗T细胞肿瘤活性或肿瘤消退的关联。
虽然已经提到上述实施例描述本发明,但是会理解,修改和变化涵盖在本发明的精神和范围内。因而,本发明只受所附权利要求书限制。
- 还没有人留言评论。精彩留言会获得点赞!