黄酮二葡萄糖醛酸苷类化合物在制备环氧合酶抑制剂中的应用的利记博彩app
本发明涉及药物领域,具体地,涉及一种黄酮二葡萄糖醛酸苷类化合物在制备环氧合酶抑制剂中的应用。
背景技术:
黄酮二葡萄糖醛酸苷类成分,可以从植物(如蒺藜苜蓿)中分离出来,在结构上两分子葡萄糖醛酸苷通过1-2糖苷键相连,再与黄酮苷元苷化。这类结构活性报道很少,主要集中在抗氧化,抗衰老活性。
环氧合酶(cyclooxygenase,COX)又称前列腺素(pros-taglandins,PG)内过氧化合成酶,为一种膜结合蛋白,是机体催化花生四烯酸转变为前列腺素的限速酶。目前研究表明,COX至少存在两种异构体,即COX-1和COX-2。COX-1结构性表达于大多数组织细胞内,参与维持生理功能。当前,COX抑制剂是抗炎药物开发的重要靶点,如我们熟悉的非甾体抗炎药吲哚美辛、布洛芬等均为COX抑制剂。此外,最新研究也表明,COX抑制剂有可能成为肿瘤、阿尔茨海默症和动脉粥样硬化等重大疾病的药物开发新靶点。
目前,大多环氧合酶抑制剂为选择性抑制剂,即只对COX-1或COX-2有抑制作用,然而,这种选择性抑制剂通常对胃肠道、心血管有副作用。
因此,本领域迫切需要开发一种副作用小、对环氧合酶抑制效果好的COX抑制剂。
技术实现要素:
本发明的目的是提供一种副作用小、对环氧合酶抑制效果好的COX抑制剂。
本发明的第一方面提供了一种式I化合物或其药学上可接受的盐的用途,用于制备(i)抗炎性疾病的组合物或制剂;和/或(ii)环氧合酶(COX)抑制剂,
式中,R1为H、甲氧基或羟基;R2为羟基。
在另一优选例中,所述环氧合酶(COX)抑制剂包括COX-1抑制剂和COX-2抑制剂。
在另一优选例中,所述炎性疾病选自下组:神经性炎症、妇科炎症、风湿性关节炎、或其组合。
在另一优选例中,所述炎性疾病选自下组:宫颈炎、阴道炎、或其组合。
在另一优选例中,所述式I化合物具有以下一个或多个特点:
(1)抗炎活性;
(2)抑制环氧合酶的活性。
在另一优选例中,所述环氧合酶选自下组:COX-1、COX-2、或其组合。
在另一优选例中,所述抑制环氧合酶的活性包括共抑制COX-1和COX-2的活性。
在另一优选例中,所述的组合物包括:药物组合物、保健品组合物、或食品组合物、或膳食补充剂组合物。
在另一优选例中,所述的组合物为药物组合物。
在另一优选例中,所述的食品组合物包括饮料组合物。
在另一优选例中,所述的药物组合物含有(a)式I所示的化合物以及(b)药学上可接受的载体。
在另一优选例中,所述组分(a)占所述药物组合物总重量的0.1-99.9wt%,较佳地10-99.9wt%,更佳地70%-99.9wt%。
在另一优选例中,所述组分(a)占所述药物组合物总重量的60.0%-99.5wt%,较佳地70.0-99.5wt%,更佳地80.0%-99.5wt%。
在另一优选例中,所述药物组合物为液态、固体、或半固体。
在另一优选例中,所述药物组合物的剂型包括片剂、颗粒剂、胶囊、口服液、或注射剂。
在另一优选例中,所述组合物为口服制剂。
在另一优选例中,所述组合物(如药物组合物)通过以下方式施用于哺乳动物:口服、静脉注射、局部施用。
在另一优选例中,所述哺乳动物包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物,如小鼠、大鼠。
在另一优选例中,所述式I化合物为黄酮葡萄糖醛酸苷类化合物。
在另一优选例中,所述式I化合物为黄酮二葡萄糖醛酸苷类化合物。
在另一优选例中,所述式I化合物为植物提取物。
在另一优选例中,所述植物选自下组:蒺藜苜蓿、紫珠、海州常山、或其组合。
本发明第二方面提高了一种用于抗炎的药物组合物,包括:
(a1)用于抗炎的第一活性成分,所述第一活性成分为式I化合物或其药学上可接受的盐;和
(a2)用于抗炎的第二活性成分,所述第二活性成分为非甾体抗炎成分;
(b)药学上可接受的载体,
其中式I化合物的定义如本发明第一方面中所述。
在另一优选例中,所述非甾体抗炎成分选自下组:吲哚美辛、阿司匹林、或其组合。
在另一优选例中,所述第一活性成分和第二活性成分的重量比为1:100至100:1,较佳地为1:10至10:1。
本发明第三方面提供了一种非治疗性的抑制环氧合酶活性的方法,包括:
在式I化合物存在下,体外培养细胞,从而抑制细胞中环氧合酶的活性。
在另一优选例中,所述细胞表达环氧合酶。
在另一优选例中,所述环氧合酶选自下组:COX-1、COX-2、或其组合。
在另一优选例中,所述环氧合酶包括COX-1和COX-2。
本发明第四方面提供了一种非治疗性的抗炎的方法,包括:
(a)给需要的对象施用式I化合物或其药物组合物,其中式I化合物如本发明第一方面中所述。
在另一优选例中,所述对象包括非人哺乳动物。
在另一优选例中,所述对象包括啮齿动物,如大鼠、小鼠。
在另一优选例中,所述的方法还包括步骤:(b)对所述对象进行处死,检测所述对象中环氧合酶的水平或活性。
在另一优选例中,所述环氧合酶选自下组:COX-1、COX-2、或其组合。
在另一优选例中,所述环氧合酶包括COX-1和COX-2。
本发明第五方面提供了一种筛选抗炎的候选药物的方法,所述方法包括步骤:
(a)提供一待测化合物以及阳性对照化合物,所述的阳性对照化合物为式I化合物或其药学上可接受的盐;
(b)在测试组中,检测所述待测化合物对环氧合酶的影响,并与阳性对照组以及阴性对照组中相应的实验结果进行比较,其中,在阳性对照组中,检测阳性对照化合物对环氧合酶的影响;
其中,如果所述待测化合物对环氧合酶的抑制程度显著高于阴性对照组,则提示所述待测化合物是抗炎的候选药物。
在另一优选例中,在步骤(b)中,将测试组与阳性对照组相比,并比较I1与I2的比值,其中I1为所述待测化合物对环氧合酶的抑制程度I 1,而I2为阳性对照化合物对环氧合酶的抑制程度,如果I 1/I2≥80%,则提示所述待测化合物是抗炎的候选药物。
在另一优选例中,所述的方法还包括步骤(c):对步骤(b)中筛选出的待测化合物,进一步测定其抗炎效果。
在另一优选例中,所述的“显著高于”指I1/I0≥2,较佳地≥3,更佳地≥4,
其中,I1为所述待测化合物环氧合酶的抑制程度;而I0为阴性对照组中环氧合酶的抑制程度。
在另一优选例中,所述的方法是非诊断和非治疗性的。
在另一优选例中,所述环氧合酶选自下组:COX-1、COX-2、或其组合。
在另一优选例中,所述环氧合酶包括COX-1和COX-2。
本发明第六方面提供了一种治疗炎性疾病的方法,包括:
给需要的哺乳动物施用式I化合物或其可接受的盐,其中式I化合物如本发明第一方面中所述。
在另一优选例中,所述式I化合物为黄酮二葡萄糖醛酸苷类化合物。
在另一优选例中,所述的哺乳动物包括人。
在另一优选例中,所述哺乳动物包括非人哺乳动物。
在另一优选例中,所述哺乳动物包括啮齿动物,如大鼠、小鼠。
在另一优选例中,施用剂量为1-100mg/kg/天,较佳地,10-100mg/kg/天, 更佳地,50-100mg/kg/天。
在另一优选例中,施用频率为1-5次/天,较佳地1-2次/天。
在另一优选例中,施用包括一个或多个周期,各周期为2-30天,较佳地3-7天。
在另一优选例中,所述炎性疾病选自下组:神经性炎症、妇科炎症、风湿性关节炎、或其组合。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
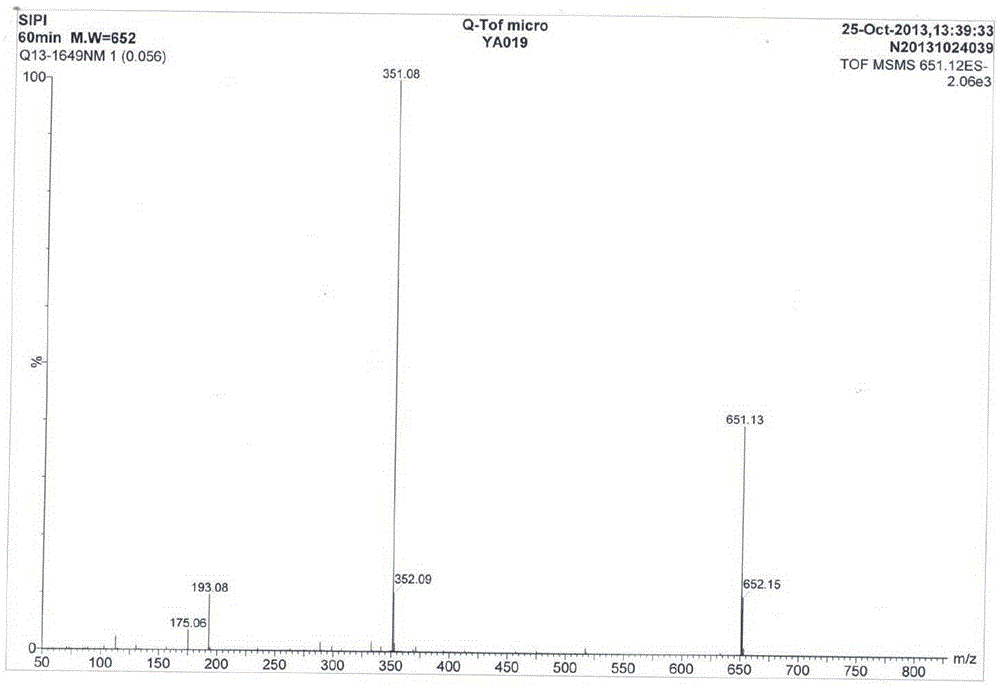
图1显示了实施例1制得的化合物1的ESI-MS谱谱。
图2显示了实施例1制得的化合物1的1H-NMR谱。
图3显示了实施例1制得的化合物1的13C-NMR。
图4显示了实施例1制得的化合物2的ESI-MS谱。
图5显示了实施例1制得的化合物2的1H-NMR谱。
图6显示了实施例1制得的化合物2的13C-NMR谱。
图7显示了实施例1制得的化合物3的ESI-MS谱。
图8显示了实施例1制得的化合物3的1H-NMR谱。
图9显示了实施例1制得的化合物3的13C-NMR谱。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,黄酮二葡萄糖醛酸苷类化合物能够同时抑制环氧合酶COX-1和环氧合酶COX-2的活性,并且还具有显著优异的抗炎活性,因此,可以将其开发成抗炎药。在此基础上完成了本发明。
如本文所用,所述“抗炎”、“抗炎性疾病”可互换使用。在本发明中,式I化合物可以治疗抗炎性疾病,也可以预防抗炎性疾病。
如本文所用,所述“环氧合酶抑制剂”与“COX抑制剂”可以互为使用,均指对环氧合酶的活性有抑制作用的物质(如化合物)。
活性成分
如本文所用,所述“活性成分”、“式I化合物”、“本发明的黄酮二葡萄糖醛酸苷类化合物”、“黄酮二葡萄糖醛酸苷类化合物”可以互为使用,具有式I结构,
其中,R1为H、甲氧基或羟基;R2为羟基。
式I化合物可以是化学合成的,可以从植物(如蒺藜苜蓿)中提取。
本发明的活性成分包括式I化合物,还可以包括式I化合物的药学上可接受的盐或酯。
本发明的活性成分具有以下特点:(i)同时抑制环氧合酶COX-1和环氧合酶COX-2的活性;(ii)抗炎活性,可以制备COX抑制剂和抗炎药物。
环氧合酶抑制剂
环氧合酶(cyclooxygenase,COX)又称前列腺素(pros-taglandins,PG)内过氧化合成酶,为一种膜结合蛋白,是机体催化花生四烯酸转变为前列腺素的限速酶。环氧合酶至少存在两种异构体,即COX-1和COX-2。
本发明的“环氧合酶抑制剂”为广谱抑制剂,即能够同时抑制COX-1和COX-2,对环氧合酶具有更好的抑制效果,且副作用小。
组合物及其应用
本发明的黄酮二葡萄糖醛酸苷类化合物以及含有本发明化合物为主要活性成分的组合物可用作环氧合酶抑制剂,用于治疗、预防以及缓解炎症疾病(如神经性炎症、妇科炎症、类风湿关节炎等)。
本发明所述的组合物包括(但并不限于):药物组合物、食品组合物、保健组合物、膳食补充剂、饮料组合物等。
以药物组合物为例。本发明的药物组合物包含安全有效量范围内的黄酮二葡萄糖醛酸苷类化合物或其药理上可接受的盐及药理上可以接受的赋形剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于 产生严重的副作用。通常,药物组合物含有1-2000mg黄酮二葡萄糖醛酸苷类化合物/剂,更佳地,含有5-200mg黄酮二葡萄糖醛酸苷类化合物/剂,最佳地含有10-100mg黄酮二葡萄糖醛酸苷类化合物/剂。较佳地,所述的“一剂”为一个胶囊或药片。
“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、直肠、肠胃外(静脉内、肌肉内或皮下)、和局部给药,优选的给药方式为口服给药。
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可 采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、娇味剂和香料。
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
用于局部给药的本发明化合物的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
本发明化合物可以单独给药,或者与其他药学上可接受的化合物(如吲哚美辛、阿司匹林等)联合给药。
使用药物组合物时,是将安全有效量的本发明化合物适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~2000mg,优选5~500mg,更优选为10-100mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明的主要优点包括:
(1)本发明首次发现黄酮二葡萄糖醛酸苷类化合物具有显著的抗炎活性。
(2)本发明首次发现黄酮二葡萄糖醛酸苷类化合物能够同时抑制环氧合酶 COX-1和环氧合酶COX-2的活性。
(3)黄酮二葡萄糖醛酸苷类化合物从植物提取出来,具有副作用小的特点。
(4)黄酮二葡萄醛酸苷类化合物从多种植物中均能提取得到,来源多样化,获取方便。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。以下实施例在统计学上例均以*P<0.05视为显著差异。
仪器及试剂
核磁共振仪:Bruker DRX 400(德国),TMS内标;FTIR-8201 PC型红外分光光度计(日本岛津);WATERS ZQ2000质谱仪(美国);中低压柱色谱仪(日本YMC公司)。
硅胶(200~300,300~400目),薄层色谱分析预制板和制备预制板均为青岛海洋化工厂生产;C18填料(日本YMC公司)。所用试剂均为分析纯(国药集团化学试剂有限公司)。
实施例1 金圣草黄素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷,芹菜素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D-萄糖醛酸苷和木犀草素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D-萄糖醛酸苷的制备
实验方法一:
(1)提取:取药材蒺藜苜蓿,粉碎(过24目筛),加80%甲醇水溶液回流提取,醇用量为药材量的10(v/m)倍,提取3次,每次1小时,将提取液过滤后合并,干燥,得蒺藜苜蓿干浸膏。浸膏混悬于4倍量水中,上清液上AB-8大孔吸附树脂,静态吸附2小时,用3倍树脂体积的水除杂,后用20%乙醇洗脱,收集洗脱液,减压浓缩即得总黄酮葡萄糖醛酸苷部位。
(2)柱层析:将得到的总黄酮葡萄糖醛酸苷部位,进行ODS C18常压柱层析(10倍体积于样品质量的ODS,即30ml ODS C-18/1g样品,100cm*20cm 的玻璃柱),分别用甲醇水溶液(10%→15%→20%→25%→30%)梯度洗脱,每个梯度所用混合溶剂量为3倍柱体积,按每个柱体积依次收集,共得到8个组份。
(3)HPLC制备:将上述各组分进一步精制并用HPLC分离,对得到的组分进行鉴定,其中一个组分对应的化合物为化合物2:芹菜素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷(tR=18.3min)。
实验方法二:
1)提取:取药材紫珠,粉碎(过24目筛),加60%乙醇回流提取,醇用量为药材量的12(v/m)倍,提取3次,每次2小时,将提取液过滤后合并,干燥,得紫珠干浸膏。浸膏混悬于4倍量水中,上清液上AB-8大孔吸附树脂,静态吸附2小时,用3倍树脂体积的水除杂,后用20%乙醇洗脱,收集洗脱液,减压浓缩即得总黄酮葡萄糖醛酸苷部位。
2)柱层析:将得到的总黄酮葡萄糖醛酸苷部位,进行ODS C18常压柱层析(10倍体积于样品质量的ODS,即30ml ODS C-18/1g样品,100cm*20cm的玻璃柱),分别用甲醇水溶液(5%→10%→15%→20%→25%)梯度洗脱,每个梯度所用混合溶剂量为3倍柱体积,按每个柱体积依次收集,共得到15个组份。收集15%甲醇洗脱第二个柱体积,即组份8,减压浓缩得洗脱部位I;收集20%甲醇洗脱第一个柱体积,即组份10,减压浓缩得到洗脱部位II;收集25%甲醇洗脱第一个柱体积,即组份13,减压浓缩得到洗脱部位III。
3)HPLC制备:将上述部位I用HPLC制备(14%甲醇水溶液,检测波长210nm,流速4ml/min),得到化合物3:木犀草素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷(tR=20.5min);将上述部位II经HPLC制备(17%甲醇水溶液,检测波长210nm,流速4ml/min),得到化合物2:芹菜素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷(tR=18.3min);将上述部位III用HPLC制备(23%甲醇水溶液,检测波长210nm,流速4ml/min),得到化合物1:金圣草黄素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷(tR=16.8min)。
鉴定结果
化合物1 (金圣草黄素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷),浅黄色无定形粉末,微溶于水,不溶于甲醇,可溶于DMSO。ESI-MS m/z651[M-H]-1,确定化合物分子量为652(见图1)。1H-NMR(DMSO-d6,400MHz)δ:12.87(1H,s,5-OH),7.56(1H,dd,J=8.4,2.0Hz,H-6′),7.49(1H,d,J=2.0Hz,H-2′),7.11(1H,d,J=8.4Hz,H-5′),6.69(1H,d,J=1.6 Hz,H-8),6.69(1H,s,H-3),6.43(1H,d,J=1.6Hz,H-6),5.39(1H,d,J=6.4Hz,H-1″),4.56(1H,d,J=8.0Hz,H-1″′),4.02(1H,d,J=9.6Hz,H-5″),3.88(3H,s,OCH3-3′),3.65(1H,d,J=9.2Hz,H-5″′),3.58(1H,t,J=8.8Hz,H-3″),3.55(1H,t,J=4.8Hz,H-2″),3.47(1H,t,J=8.8Hz,H-4″),3.29(1H,t,J=8.8Hz,H-4″′),3.27(1H,t,J=9.2Hz,H-3″′),3.05(1H,t,J=8.0Hz,H-2″′),以上数据见图2。13C-NMR数据见表1,图3。
化合物2 (芹菜素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷),浅黄色无定形粉末,微溶于水,不溶于甲醇,可溶于DMSO。ESI-MS m/z 621[M-H]-1,确定化合物分子量为622(见图4)。1H-NMR(DMSO-d6,400MHz)δ:12.98(1H,s,5-OH),7.94(1H,dd,J=6.8,1.8Hz,H-2′)7.92(1H,dd,J=6.8,1.8Hz,H-6′),6.96(1H,dd,J=6.8,2.0Hz,H-3′),6.94(1H,dd,J=6.8,2.0Hz,H-5′),6.81(1H,d,J=2.0Hz,H-8),6.79(1H,s,H-3),6.44(1H,d,J=2.0Hz,H-6),5.31(1H,d,J=5.6Hz,H-1″),4.56(1H,d,J=7.6Hz,H-1″′),3.93(1H,d,J=8.4Hz,H-5″),3.71(1H,d,J=8.4Hz,H-5″′),3.65(1H,t,J=8.4Hz,H-3″),3.56(1H,t,J=6.8Hz,H-2″),3.42(1H,t,J=8.8Hz,H-4″),3.28(1H,t,J=8.4Hz,H-4″′),3.24(1H,t,J=8.4Hz,H-3″′),3.05(1H,t,J=7.6Hz,H-2″′),以上数据见图5。13C-NMR数据见表1,图6(来自蒺藜苜蓿和来自紫珠的化合物2是同一化合物)。
化合物3 (木犀草素-7-O-[β-D-葡萄糖醛酸-(1→2)]-β-D葡萄糖醛酸苷),淡黄色无定型粉末,微溶于水,不溶于甲醇,可溶于DMSO。ESI-MS m/z637[M-H]-1,确定化合物分子量为638,见图7。1H-NMR(DMSO-d6,400MHz)δ:12.96(1H,s,5-OH),7.44(1H,dd,J=8.4,2.0Hz,H-6′),7.42(1H,dd,J=8.4,2.0Hz,H-2′),6.91(1H,d,J=8.8Hz,H-5′),6.74(1H,d,J=2.0Hz,H-8),6.71(1H,s,H-3),6.42(1H,d,J=1.6Hz,H-6),5.41(1H,d,J=6.8Hz,H-1″),4.56(1H,d,J=7.6Hz,H1″′),4.06(1H,d,J=9.2Hz,H-5″),3.65(1H,d,J=9.2Hz,H-5″′),3.58(1H,t,J=6.4Hz,H-3″),3.56(1H,t,J=6.4Hz,H-2″),3.49(1H,t,J=8.0Hz,H-4″),3.29(1H,t,J=8.8Hz,H-4″′),3.27(1H,t,J=9.2Hz,H-3″′),3.05(1H,t,J=8.0Hz,H-2″′),见图8。13C-NMR数据见表1,图9。
表1.化合物1-3的13C-NMR数据表
实施例2 本发明黄酮二葡萄糖醛酸苷类化合物的COX抑制活性
1.仪器
酶标仪Labsystems,wellscan,MK.2
离心机KA-1000上海飞鸽
双人超净工作台,苏州净化
CO2培养箱,PHARMA SCIENTIFIC
可调式移液器(芬兰,5-40ul,40-200ul,200-1000ul)
2.材料
Cox Fluorescent Inhibitor Screening Assay Kit(Cayman,USA);
96孔黑板(Corning,USA);
进口枪头(Axygen,USA);
吲哚美辛批号:080401Sigma公司;
SC-560:
NS-398:
对比化合物1:
3.方法
1)在200μl的反应体系中依次混合缓冲液(1X)、亚铁血红素、荧光底 物ADHP、COX-1/COX-2、待测化合物,25℃温孵5分钟。
2)加入环氧酶底物花生四烯酸。
3)小心振摇板几秒钟,25℃温孵2min
4)Ex:530-540nM;Em:585-590nM检测。
4.待测样品与阳性药处理方法
待测样品和吲哚美辛精确称样,实验前使用检测缓冲液稀释到工作浓度。
COX-1选择性抑制剂SC-560(CAS 188817-13-2),按照说明书要求吸取15μl加入985μl DMSO稀释成工作液;COX-2选择性抑制剂DuP-697(CAS88149-94-4)),按照说明书要求吸取50μl加入550μl DMSO稀释成工作液。
5.计算
6.实验结果
6.1初筛
表2.抑制率初筛表
6.2IC50值测定
表3、化合物1-3环氧合酶IC50表
结果如表2和表3所示。结果表明,本发明的黄酮二葡萄糖醛酸苷化合物(I)有较强的COX-1和COX-2抑制活性,显著高于对比化合物1的抑制活性。并且,化合物3对COX-1和COX-2的IC50均达到nM级,其中对COX-2的IC50强于COX-2选择性抑制剂NS-398,对COX-1的IC50与吲哚美辛处于同一数量级。因此,本发明的黄酮二葡萄糖醛酸苷(I)可为宫颈炎、阴道炎等炎症疾病的预防或治疗提供一种新途径,同时可以开发为新的环氧合酶抑制剂。
实施例3 本发明黄酮二葡萄糖醛酸苷类化合物对对角叉菜胶引起的大鼠急性炎症的药效学作用
1实验动物
1.1名称:SD大鼠
1.2来源:上海西普尔-必凯实验动物有限公司
1.3体重:130—150g
1.4性别:雄性
1.5合格证:SCXK(沪)2008-0016
2.实验剂量设计
设计低、高两个药效剂量组,剂量分别为:5mg/kg、25mg/kg。
3药物配制
低剂量组将5mg药品溶至10ml,高剂量组将25mg药品溶至10ml。
4给药途径及容量
4.1途径:口服
4.2容量:100g大鼠:1ml
4阳性药:
4.1名称:吲哚美辛
4.2提供单位:上海信谊黄河制药有限公司
4.3批号:091201
4.4剂量:5mg/kg
5实验制剂与仪器
5.1致炎剂:角叉菜胶,sigma产品,批号:1408463。
0.1g用双蒸水配至10ml成1%的角叉菜胶。每只大鼠右后足足趾中部皮下注射0.1ml致炎。
5.2测量仪:意大利UGO公司肢体体积测量仪7140–Plethysmometer
生产单位:Biological Research Apparatus 21025 Comerio VA Italy
6实验方法
6.1分组与给药
将大鼠随机分为正常组、模型组及样品的高低剂量组,并在实验当天按分组给予各剂量药物。
6.2造模
给药后1小时各组大鼠于右后肢足跖部皮下注射1%的角叉菜胶0.1ml致炎,造成大鼠急性炎症模型。
6.3指标测量
在致炎前及致炎后不同时间(0,1、2、3h)分别测定致炎足的足垫体积,在足正面做一清晰标线,用足趾容积测量仪进行测量记录。以肿胀值计算肿胀率,再以模型组及给药组的大鼠脚趾肿胀率计算抑制率。
肿胀率%=(En-Eo)/Eo*100%
En:致炎后不同时间的肿胀值Eo:致炎前的肿胀值
抑制率%=(Zn-Zo)/Zo*100%
Zn:各给药组的肿胀率Zo:模型组的肿胀率
7实验结果
实验数据见表4。致炎后,模型组的肿胀率明显升高,说明造模成功,在致炎后的2h达到顶峰。与模型组相比,阳性药吲哚美辛各时间点的肿胀率均有所降低,致炎后1h、2h、3h的抑制率分别为25.79%、45.50%、45.71%(P<0.05、P<0.01、P<0.01),显示出较好的治疗效果。
与模型组相比,化合物3低剂量组在2h抑制率为26.31%(P<0.05);高剂量组在1h、2h的抑制率分别为33.25%(P<0.01)和43.25%(P<0.01);化合物1高剂量组在1h抑制率为37.77%(P<0.01);化合物2高剂量组在2h抑制率为37.40%(P<0.01);而对比化合物1的低剂量组(相当于化合物1/2/3的高剂量组)在2h抑制率只有16.78%(P<0.01),显著低于化合物1/2/3的抑制水平。
结果表明,化合物1-3的高剂量组均显示出抗炎效果,以化合物3高剂量组效果最为显著。化合物1-3可以显著降低角叉菜胶致急性炎症的大鼠的足趾肿胀率,具有一定的预防大鼠急性炎症的药效学作用,因此,具有较好的抗炎 药物的开发潜力。
表4 化合物1-3对角叉菜胶致大鼠急性炎症的药效学作用
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!