一种用于治疗心肌梗死的混合细胞制剂及制备方法与应用与流程
本发明涉及一种用于治疗心肌梗死的混合细胞制剂及制备方法与应用,属于生物医药领域。
背景技术:
目前无论基础和临床,尽管近几十年对心肌梗死的治疗有了很大的进步,目前尚没有任何能够根治心肌梗死的药物和疗法。细胞治疗被认为是治疗心肌梗死最有希望的方法之一。无论是基础和临床研究均证明:不同类型的干细胞(包括:骨髓间充质干细胞、心脏内源性干细胞,胚胎干细胞及iPS等)对梗死心肌治,被证明是可行和安全的。但其疗效只体现在减小梗死面积,提高射血分数,改善心功能,及改善病理性左心室重构,但经移植入的干细胞大部分死亡,未能分化成熟的心肌以再生梗死心肌,因此,目前的研发瓶颈和前沿是:研发具有促进心梗缺血区和边缘区心肌再生,有效减小梗死面积,改善心功能,改善缺血心肌纤维化、以改善梗死心脏病理重构,及有效减小心梗后心衰发生的细胞疗法及细胞治疗制剂。
造成目前干细胞疗法对心梗治疗疗效未如理想的原因之一,是目前的细胞疗法往往只是单独移植不同种类的干细胞,而往往忽略了构成心肌层各类细胞存在彼此互为调控的协同作用,从而能更有效促进心梗边缘区不同来源干细胞增殖和向心肌分化,促进心梗缺血区和边缘区的血管新生、心肌再生,减小梗死面积,改善心功能,改善缺血心肌纤维化、以改善梗死心脏病理重构,及有效减小心梗后心衰发生的疗法方面,将会取得比现有单独干细胞疗法更好的疗效。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,即目前所有干细胞治疗均不具备修复缺血心肌梗死区被破坏,由心脏Teloytes细胞(CTs)构成的细胞网络结构的同时,又能有效促进经移植入的心脏内源性干细胞(CSCs)有效分化为心肌细胞,从而有效再生梗死心肌,而提供一种用于治疗心肌梗死的混 合细胞制剂。
本发明的另一目的在于提供所述用于治疗心肌梗死的混合细胞制剂的制备方法。
本发明的再一目的在于提供所述用于治疗心肌梗死的混合细胞制剂的应用。
本发明的目的通过下述技术方案实现:一种用于治疗心肌梗死的混合细胞制剂,由活性成分和溶剂组成;活性成分主要为心脏Teloytes细胞(CTs)和心脏内源性干细胞(CSCs)。
所述的活性成分还包括上述CTs和CSCs分别分泌的功能因子和小RNA中的一种或两种。即所述的用于治疗心肌梗死的细胞制剂优选由如下成分组成:CTs和CSCs分别分泌的功能因子和小RNA中的一种或两种、CTs、CSCs和溶剂组成。两种细胞与及其分泌的功能因子、小RNA经混合培养,彼此相互作用对该两种细胞本身的表型和分泌表型改变,使其在向心肌分化能力、增殖能力、移行能力、抗细胞死亡、存活能力、抗缺血与缺氧能力、抗炎症反应能力、促进血管新生能力、抗纤维化能力的增强,以及该两种细胞及分泌功能分子彼此协同作用,在上述特性而获得的提高。
所述的功能因子优选为能促进经移植细胞、心肌细胞、心脏血管内皮细胞、心脏CTs,心脏内源性干细胞及其它来源干细胞的增殖和分化、移行、存活,抗死亡、抗缺血与缺氧、抗炎症,及促进心肌血管新生,抗心肌纤维化,及其彼此的协同作用。
所述的小RNA包括microRNA、LncRNA和piRNA等,其作用也是对心肌细胞、心脏血管内皮细胞、心脏CTs,心脏内源性干细胞和内源性骨髓间充质干细胞的抗死亡与促进存活、促进增殖和诱导分化。
所述的CTs和所述的CSCs按细胞数1:1配比。
所述的CTs的纯度优选为在95%以上。
所述的CTs在所述的用于治疗心肌梗死的细胞制剂中的浓度为至少2.5×105个细胞/mL。
所述的CSCs的纯度优选为在95%以上。
所述的CSCs在所述的用于治疗心肌梗死的细胞制剂中的浓度为至少2.5×105个细胞/mL。
所述的溶剂是维持细胞生理状态的溶液,如生理盐水、PBS或含血清的培养液;优选为含血清的培养液。
所述的血清优选为胎牛血清。
所述的血清的浓度优选为体积百分比20%。
所述的培养液优选为DMEM培养液。
所述用于治疗心肌梗死的混合细胞制剂的制备方法,包括如下步骤:将CTs和CSCs混匀,得到用于治疗心肌梗死的混合细胞制剂;优选包括如下步骤:将CTs和CSCs在溶剂中混匀,于37℃、5%CO2、95%空气的无菌培养箱中培养48小时,然后对混合培养后的细胞消化,回收,得到用于治疗心肌梗死的混合细胞制剂。
所述的CTs和所述的CSCs按细胞数1:1配比。
所述的CTs的纯度优选为在95%以上。
所述的CTs在所述的用于治疗心肌梗死的细胞制剂中的浓度为至少2.5×105个细胞/mL。
所述的CSCs的纯度优选为在95%以上。
所述的CSCs在所述的用于治疗心肌梗死的细胞制剂中的浓度为至少2.5×105个细胞/mL。
所述的溶剂为含血清的培养液。
所述的消化为通过使用胰酶溶液进行消化。
所述的胰酶溶液的浓度优选为0.25(w/v)%。
所述的用于治疗心肌梗死的混合细胞制剂的应用,是将其直接用于治疗心肌梗死或是将其制备成用于治疗心肌梗死的药物或医疗器械进行应用;具体包括如下方式与途径:可通过对缺血心肌的缺血区和边缘区同时进行注射,或通过介入的方式对缺血心肌的缺血区和边缘区同时进行注射,但实施治疗的途径不仅限于上述两种方式,还包括与不同生物体内可降解材料相混合,制备成含不同浓度该细胞制剂的各种细胞制片,通过手术覆盖在缺血心肌缺血区,以发挥治疗作用;也可以把该细胞制剂的细胞使用各类特异性靶向心脏的靶向子(如:抗体或短肽等)进行表面修饰,然后通过静脉注射使用,以实施经静脉使用的心脏靶向细胞治疗。
所述的制剂发挥疗效实现途径包括但不限于如下阐述:①促进经移植的CSCs或心肌内源性CSCs,及其它来源干细胞在心梗边缘区和梗死区存活、分化与增殖;②促进缺血心肌梗死区CTs构成网状结构的修复与再生;③促进缺血心肌缺血区和边缘区的血管新生;④改善缺血心肌纤维化、以改善梗死心脏的病理重构;⑤减小缺血心肌的梗死面积,改善心功能,及有效减小心梗后心 衰的发生率,从而实现有效促进心梗心脏缺血区和边缘区心肌再生。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明提供的细胞制剂经心肌内直接注射或介入心肌内注射,对急性心肌梗死心脏的缺血区和缺血边缘区实施该混合细胞制剂移植,有效促进经移植的CSCs或心肌内源性CSCs,及其它来源干细胞在心梗边缘区存活、分化与增值,从而能更有效再生缺血梗死心肌的功能。
(2)该细胞制剂经心肌内直接注射或介入心肌内注射,对急性心肌梗死心脏的缺血区和缺血边缘区实施该细胞制剂移植,能有效修复与再生缺血心肌缺血区严重受损的由CTs构成的细胞网络,以修复有利于梗死心肌再生的细胞结构微环境,从而有利于梗死心肌的再生。
(3)该细胞制剂对急性心肌梗死实施移植治疗后,在减小梗死面积,改善心梗心脏心功能方面的疗效要优于目前常用的单独使用CSCs,BMSCs和CTs的疗效。
(4)该细胞制剂对急性心肌梗死实施移植治疗后,在改善缺血心肌纤维化、促进缺血区和边缘区血管新生,以及改善梗死心脏病理重构,减小心梗后心衰发生率方面的疗效要优于目前常用的单独使用BMSCs,CSCs和CTs的疗效。
附图说明
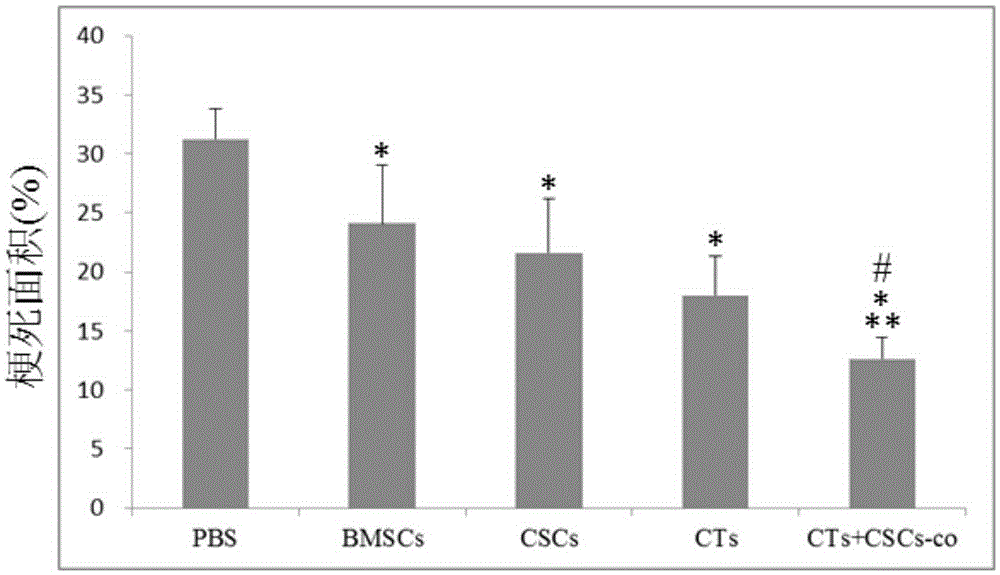
图1是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的心脏梗死面积统计结果图;其中,*表示CTs+CSCs混合细胞制剂组,BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组和CSCs组,p<0.01;#表示CTs+CSCs混合细胞制剂组相对于CTs组,p<0.05。
图2是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的心功能检测结果图;其中,图(A)为各组细胞治疗梗死心脏的射血分数图,心功能越好,其值就越大,*表示CTs+CSCs混合细胞制剂组,BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组和CSCs组,p<0.01;#表示CTs+CSCs混合细胞制剂组相对于CTs组,p<0.05;图(B)为各组细胞治疗梗死心脏的收缩末期的左心室最小直径结果图,心功能越好,其值就越小,*表示CTs+CSCs混合细胞制剂组,BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组、CSCs组和CTs组,p<0.05;图(C)为各组细胞治疗梗死心脏的舒 张末期的左心室最小直径结果图,心功能越好,其值就越小,*表示CTs+CSCs混合细胞制剂组,BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组和CTs组,p<0.05。
图3是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的梗死边缘区和梗死区心肌增殖统计结果图;其中,*表示CTs+CSCs混合细胞制剂组相对于PBS组、BMSCs组、CSCs组和CTs组,p<0.01。
图4是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的心肌层纤维化程度结果图;其中,图(A)为梗死区纤维化面积结果图,*表示CTs+CSCs混合细胞制剂组、BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.05;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组、CSCs组和CTs组,p<0.05;图(B)为非梗死区血管周边纤维化面积结果图,*表示CTs+CSCs混合细胞制剂组、BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组和CSCs组,p<0.01。
图5是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的肌成纤维细胞的数目检测结果图;其中,*表示CTs+CSCs混合细胞制剂组、BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组、CSCs组和CTs组,p<0.01。
图6是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的心肌层血管单位密度结果图;其中,图(A)为梗死区阳性血管密度的半定量分析结果图,图(B)为边缘区阳性血管密度的半定量分析结果图;其中,*表示CTs+CSCs混合细胞制剂组、BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.05;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组、CSCs组和CTs组,p<0.01。
图7是使用PBS和不同的细胞制剂注射心肌梗死模型4周后的梗死区CTs检测结果图;其中,*表示CTs+CSCs混合细胞制剂组、BMSCs组、CSCs组和CTs组分别相对于PBS组,p<0.01;**表示CTs+CSCs混合细胞制剂组相对于BMSCs组、CSCs组和CTs组,p<0.05。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
一、CTs的制备
1、SD雌性大鼠(250-300g)(广东省医学实验动物中心)乙醚麻醉后拉颈处死,在70(v/v)%乙醇中浸泡消毒5min,迅速转移至生物安全柜内。
2、无菌条件下迅速剪开胸腔取出心脏,将心脏放入无菌PBS溶液(0.01M,pH7.4)中清洗3次,除去心脏中残余的血液,在无菌平皿中剪碎心脏组织(1-2mm3),然后将心脏组织块转移至50ml无菌离心管,加入37℃预热的经过滤除菌的消化酶液[0.05(w/v)%胶原酶+0.1(w/v)%胰酶,下同]2.5ml,密闭管盖后,于37℃水浴摇床内(300rpm)消化10min,然后在生物安全柜内静置2min,弃上层悬液。
3、在生物安全柜内,往沉淀组织块中加入消化酶液2.5ml,密闭管盖后,于37℃水浴摇床(300rpm)内再消化15min,然后在生物安全柜内使用移液枪充分吹打经消化的组织块,至细胞充分分离,离心管静置2min后,取上层悬液置于一支新的15mL无菌离心管,并加入等体积的含20%胎牛血清的DMEM培养液混匀终止酶消化反应。
4、往沉淀组织中再重新加入消化酶液2.5ml,密闭管盖后转移至37℃水浴摇床(300rpm)内消化15min,重复步骤3、4收集含经分离细胞的悬液,直至组织完全消化。
5、将所有经分离细胞的悬液收集,分别使用无菌孔径为100μm和40μm的尼龙膜滤过,去除体积大组织碎片,然后将细胞悬液置50×g离心力下离心2min,将上层细胞悬液转移至一新的15ml无菌离心管,在458×g离心力下离心5min,弃上清,收集经分离细胞。
6、往含细胞沉淀的离心管内加入5ml无菌PEB液[称取牛血清白蛋白(BSA)1.00g、乙二胺四乙酸(EDTA)0.12g,溶于200ml PBS缓冲液中,溶解混匀后调节pH值至7.2,用0.22μm无菌滤膜过滤除菌,分装于无菌瓶中,4℃冰箱中保存;下同]重悬细胞沉淀,并将悬液在38×g离心力下离心2min,将上层细胞悬液转移至新的15ml无菌离心管,在200×g离心力下离心10min,收集细胞,然后加入1ml PEB液混匀细胞,获得目标分离单细胞悬液。
7、向所获目标分离单细胞悬液中加入兔抗大鼠c-Kit抗体5μl(终浓度为体积比稀释1:200),混匀后密闭管盖,4℃旋转孵育40min后,向细胞悬液中加入2ml PEB液轻微吹打,洗去未结合抗体,然后在458×g离心力下离心5min,弃上清。
8、向离心管内加入180μl PEB液并混匀细胞,然后加入羊抗兔lgG免疫磁珠 20μl,密闭管盖置4℃孵育25min后,往细胞悬液中加入2ml PEB液轻微吹打,洗去未结合二抗磁珠,然后在458×g离心力下离心5min,以收集细胞,然后加入500μl PEB混悬细胞。
9、使用磁珠分选系统,按阳性分选获得C-kit+的CTs。
10、经分离的CTs在含20%胎牛血清的DMEM培养液,37℃、5%CO2、95%空气的无菌培养箱进行培养,对经分离的细胞CTs进行传代扩增,经该法分离的细胞近95%的细胞为c-Kit+/CD34+,达到较高的纯度。按步骤1~10,能重复得到CTs。
11、所有用于制备混合细胞制剂的CTs均为传代低于五代,以确保细胞核型没有发生改变。
二、CSCs制备
1、灌注系统消毒:消毒水浸泡灌注管道系统,同时打开紫外灯照射30min,排净消毒水、无菌去离子水充分冲洗灌注管道。
2、实验前20min,大鼠腹腔注射肝素钠(500u/kg)。
3、打开胸腔取出心脏,使用冰浴的灌注液清洗后,迅速将心脏悬挂于Langendorff灌注系统上,无钙离子灌注液(称取NaCl 3.46g、KCl 0.175g、MgSO40.145g、KH2PO40.08g、NaHCO31.05g、葡萄糖1.05g,加去离子水容量瓶定容至500ml,调节pH7.38-7.42,过滤除菌)灌注5min。
4、加入酶液[含0.025%(v/v)胶原酶P,0.004%(v/v)蛋白酶的无钙离子灌注液]在37℃,6ml/min恒定流速条件进行灌注消化10min,待心脏变白,且心肌层呈现塌陷状时,取下心脏。
5、在生物安全柜内将取下的心脏剪碎(1-2mm3),加入酶消化液充分吹打,静置1min,吸出上悬液后,加入等体积含10%(v/v)胎牛血清的DMEM培养液终止消化,未完全消化的组织加入相同的酶消化液,于37℃水浴摇床中继续消化15min。
6、将收集到的经消化分离的细胞悬液,依次使用无菌的100μm尼龙膜、41μm尼龙膜滤过,去除较大组织碎片,滤液于50×g离心2min后,弃沉淀,上层细胞悬液在300×g离心10min,弃上清液以收集经分离的细胞。
7、加入5ml PEB液悬浮细胞,并把悬液在38×g离心力的作用下离心2min,弃沉淀,取上清在200×g离心力的作用下离心10min收集经分离的细胞,加入1ml PEB液重悬细胞,获得细胞悬液。
8、往上述制备的细胞悬液中加入兔抗大鼠c-Kit抗体5μl(终浓度为1:200), 混匀后,于4℃旋转孵育40min,孵育完成后加入2ml PEB液轻微吹打,在458×g离心力下离心4min,弃上清。
9、加入160μl PEB液悬浮细胞,加入羊抗兔lgG免疫磁珠20μl,在4℃孵育25min后,加入2ml PEB液轻微吹打,在458×g离心力下离心4min,收集沉淀,向沉淀中加入500μl PEB悬浮细胞。
10、利用美天旎磁珠分选系统阳性分选获得c-Kit+心脏干细胞,并使用心脏干细胞培养液[DMEM/F12培养液添加15%胎牛血清、bFGF(20μg/L)、LIF(10μg/L)],在37℃、5%CO2、95%空气的无菌培养箱进行培养,对经分离的CSCs进行传代扩增,经该法分离的细胞大于95%的细胞为c-Kit+,达到较高的纯度。
11、所有用于制备混合细胞制剂的CSCs均为传代低于5代,以确保细胞核型没有发生改变。
三、BMSCs制备
1、SD雌性大鼠(250-300g)(广东省医学实验动物中心),乙醚麻醉后拉颈处死,放入70(v/v)%酒精中浸泡5min。
2、在生物安全柜中,剪开大鼠股骨外面的皮肤、剔除肌肉,收集股骨。
3、剪开股骨两端露出骨髓腔,用无菌注射器吸取4ml 10(v/v)%FBS的L-DMEM培养液,插入骨髓腔一端将骨髓冲出。收集液用200无菌目尼龙膜过滤,然后加入4ml Tris-NH4Cl(称取3.735g氯化铵、三羟甲基氨基甲烷(Tris)1.3g加水溶解并稀释至500ml。0.22μm滤膜过滤除菌,4℃保存)溶液吹打均匀,静置5min。
4、在458×g离心力下离心4min,弃上清液,用含2ml 10(v/v)%FBS的L-DMEM重悬经收集的细胞,并接种到35mm培养皿中,置于37℃、5%CO2、95%空气的无菌培养箱进行培养,48小时换液除去未贴壁细胞,以后每隔一天换液一次。
5、待细胞生长至90%融合时用0.25(w/v)%胰酶消化,将细胞按照5×105个/ml的密度接种到35mm培养皿进行扩增培养,以获得足够数量的BMSCs以进行下一步实验。经该法分离扩增得到的细胞超过97%为CD90+、CD73+和CD105+阳性,低于0.5%的细胞为CD45+、CD14+和CD34+阳性,纯度达到95%的BMSCs。
6、所有用于制备细胞制剂的BMSCs均为传代低于五代,以确保细胞核型没有发生改变。
实施例2
(一)CTs+CSCs混合细胞制剂的制备
将CTs和CSCs用含20%(v/v)胎牛血清的无菌DMED培养液混匀,并按1.25×105:1.25×105的比例将两种细胞均匀混合成体积为2mL、细胞浓度为1.25×105/mL的细胞混合液。
把该混合细胞液置于37℃、5%CO2、95%空气的无菌培养箱培养48小时,然后使用0.25(w/v)%胰酶消化回收经混合培养的细胞,并使用含20%(v/v)胎牛血清的DMEM把细胞浓度调制为1×107/mL供移植使用。
(二)CTs+CSCs混合细胞制剂对心肌梗死实施移植治疗
使用雌性(250克)S.D.大鼠,行冠状动脉前降支(LAD)结扎术致左心室前壁缺血,进行心肌梗死建模,LAD结扎后30分钟后,左心室前壁缺血区和缺血边缘区分别行心肌内注射步骤(一)制备好的CTs+CSCs混合细胞制剂,其中,在缺血区注射10μl,且分别在缺血边缘区的12点、3点、6点和9点位置各注射10μl。其中同等体积PBS(0.01M,pH7.4),BMSCs(浓度为1×107/mL),CTs(浓度为1×107/mL)和CSCs(浓度为1×107/mL)分别按相同的注射方法进行心肌内注射作为对照组,每组动物为5-9只。
(三)检测指标
所有上述经心肌内细胞移植组别的模型鼠,于注射后4周使用B超对其进行心功能指标进行测定后,取出心脏,进行常规的石蜡包埋和组织切片,并使用Massion Trichrome染色对纤维化及梗死面积进行染色,以对不同组别梗死面积和纤维化进行比较分析;使用抗vWF(血管内皮细胞标记物)抗体进行免疫组化染色,以对不同组别的缺血区和缺血边缘区的血管密度进行比较分析,使用抗c-Kit/CD34抗体(CTs标记物)对梗死区CTs密度进行比较分析,使用抗PH3抗体和抗α骨骼肌蛋白抗体荧光免疫双标双标对梗死边缘区和梗死区的增殖心肌细胞进行分析(上述方法学均是本领域广泛认可的常规方法学)。
(四)CTs+CSCs混合细胞制剂对心肌梗死治疗的疗效
1、CTs+CSCs混合细胞制剂能显著性减小缺血心肌的梗死面积,且其疗效优于单独使用BMSCs,CSCs和CTs。
对各组梗死面积进行半定量比较柱状图(如图1所示),PBS:PBS对照组;BMSCs:骨髓间充质干细胞组;CTs:心脏CTs组;CTs+BMSCs:心脏CTs+骨髓间充质干细胞组(如下其它部分的均使用该相同的简写符号)。CTs+CSCs混合细胞制剂组,BMSCs、CSCs和CTs组组梗死面积均显著性小于PBS对照组,差 异有显著性统计学意义(p<0.01)。且CTs+CSCs混合细胞制剂组的梗死面积,显著性小于BMSCs、CSCs和CTs组的梗死面积,差异有显著性统计学意义(p<0.01:vs.BMSCs、CSCs;p<0.05:vs.CTs)。上述结果证明:使用CTs+CSCs混合细胞制剂,BMSCs,CSCs和CTs均能显著性减小缺血心肌的梗死面积,且CTs+CSCs混合细胞制剂疗效优于单独使用BMSCs,CSCs和CTs。
2、CTs+CSCs混合细胞制剂能显著性改善缺血梗死心脏的心功能,且其疗效优于单独使用BMSCs,CSCs和CTs。
左心室射血分数,左心室收缩末期直径,左心室舒张末期直径是衡量心脏功能的常用主要指标。检测结果如图2所示:
①对左心室射血分数指标的研究发现(如图2(A)所示):CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs组的左心室射血分数均显著性大于PBS对照组,差异有显著性统计学意义(p<0.05)。CTs+CSCs混合细胞制剂组的左心室射血分数显著性大于,CSCs,BMSCs和CTs组,差异有显著性统计学意义(p<0.01:vs.BMSCs和CSCs;p<0.05:vs.CTs)。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性改善缺血心脏的射血分数,且CTs+CSCs混合细胞制剂疗效优于单独使用CSCs,BMSCs和CTs。
②对左心室收缩末期直径指标的研究发现(如图2(B)所示):CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组的左心室收缩末期直径均显著性小于PBS对照组,差异有显著性统计学意义(p<0.01)。CTs+BMSCs混合细胞治疗用制剂组的左心室收缩末期直径的均值小于CSCs,CTs和BMSCs组,差异有显著性统计学意义(p<0.05)。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs能显著性改善缺血心脏的左心室收缩末期直径,且CTs+BMSCs混合细胞治疗用制剂疗效也显示优于单独使用CSCs,BMSCs和CTs。
③对左心室舒张末期直径指标的研究发现(如图2(C)所示):CTs+CSCs混合细胞治疗用制剂组,CSCs,BMSCs和CTs组的左心室舒张末期直径均显著性小于PBS对照组,差异有显著性统计学意义(p<0.01)。CTs+CSCs混合细胞治疗用制剂组的左心室舒张末期直径的均值小于CTs和BMSCs组,差异有显著性统计学意义(p<0.05)。CTs+CSCs混合细胞治疗用制剂组的左心室舒张末期直径的均值小于CSCs组。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性改善缺血心脏的左心室舒张末期直径,且CTs+CSCs混合细胞治疗用制剂疗效也显示优于单独使用CTs或BMSCs,也有优于单独使用CSCs的趋势。
综合上述三个指标证明:CTs+CSCs混合细胞治疗用制剂能显著性改善缺血梗死心脏的心功能,且其疗效优于单独使用CSCs,BMSCs和CTs(。
3、CTs+CSCs混合细胞制剂能显著提高梗死边缘区和梗死区的心肌增殖,且其疗效优于单独使用CSCs,BMSCs和CTs。
使用抗PH3(细胞增殖标记物)抗体和抗α骨骼肌肌动蛋白抗体的荧光双标,对各组心脏切片进行免疫组化染色,以比较梗死区处于分裂状态下的心肌细胞密度。对该指标研究发现(如图3所示):CTs+CSCs混合细胞制剂组梗死边缘区和梗死区处于分裂状态下的心肌细胞的密度均显著性高于PBS对照组,差异有显著性统计学意义(p<0.01)。CSCs,BMSCs和CTs组梗死边缘区和梗死区处于分裂状态下的心肌细胞的密度均高于PBS对照组,但差异没有统计学意义。且CTs+CSCs混合细胞制剂组梗死区处于分裂状态下的心肌细胞密度的均值均大于CSCs,BMSCs和CTs组,差异有显著性统计学意义(p<0.01)。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能促进缺血边缘区心肌细胞增殖,且其疗效优于单独使用CSCs,BMSCs和CTs。
4、CTs+CSCs混合细胞制剂能显著性改善缺血梗死心脏的纤维化,且其疗效优于单独使用CSCs,BMSCs和CTs。检测结果如图4所示:
梗死区纤维化面积,及非梗死区血管周边纤维化面积是衡量心肌层纤维化程度的常用主要指标。
①对梗死区纤维化面积指标的研究发现(如图4(A)所示):CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组的梗死区纤维化面积均显著性小于PBS对照组,差异有显著性统计学意义(p<0.05)。CTs+CSCs混合细胞制剂组的梗死区纤维化面积显著性小于CSCs,BMSCs和CSCs组,差异有显著性统计学意义(p<0.05)。上述结果证明:使用CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs均能显著性改善缺血心脏的梗死区纤维化面积,且CTs+CSCs混合细胞制剂的疗效优于单独使用CSCs,BMSCs和CTs。②对非梗死区血管周边纤维化面积指标的研究发现(如图4(B)所示):CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组的非梗死区血管周边纤维化面积均显著性小于PBS对照组,差异有显著性统计学意义(p<0.05)。CTs+CSCs混合细胞制剂组的非梗死区血管周边纤维化面积的均值小于BMSCs和CSCs组,差异有显著性统计学意义(p<0.05)。CTs+CSCs混合细胞制剂组的非梗死区血管周边纤维化面积的均值小于CTs组。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性改善缺血心脏的非梗死区血管周边纤维化面积,且CTs+CSCs混合细胞制剂疗 效也显示优于单独使用BMSCs和CSCs。
综合上述二个指标证明:CTs+CSCs混合细胞制剂能显著性改善缺血梗死心脏的纤维化,且其疗效优于单独使用CSCs,BMSCs和CTs。
5、CTs+CSCs混合细胞制剂能显著性减小缺血心肌梗死区,产生胶原纤维的来源细胞――肌成纤维细胞的数目,从而有效改善缺血心肌的纤维化,且其疗效优于单独使用CSCs,BMSCs和CTs。
心肌缺血缺氧会诱导心肌层的成纤维细胞分化成为肌成纤维细胞,该细胞能大量合成胶原纤维,导致心肌层纤维化。因此,评价心肌层肌成纤维细胞的单位密度,是目前常用的改善心肌纤维化的一个指标。使用抗α平滑肌肌动蛋白(肌成纤维细胞的标记物)抗体对各组心脏切片进行免疫组化染色。该指标的研究发现(如图5所示):CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组的梗死区的肌成纤维细胞密度均显著性小于PBS对照组,差异有显著性统计学意义(p<0.01)。CTs+CSCs混合细胞制剂组的肌成纤维细胞密度,显著性小于CSCs,BMSCs和CTs,差异有显著性统计学意义(p<0.01)。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性减少缺血心肌梗死区肌型成纤维细胞密度,且CTs+CSCs混合细胞制剂疗效优于单独使用CSCs,BMSCs和CTs。
6、CTs+CSCs混合细胞制剂能促进缺血心肌梗死区和边缘区的血管新生,且其疗效优于单独使用CSCs,BMSCs和CTs。
心肌层血管单位密度是评价心肌层血管新生的一个常用指标。使用抗vWF(血管内皮细胞的标记物)抗体对各组心脏切片进行免疫组化染色。对该指标研究发现(如图6所示):1)CTs+CSCs混合细胞制剂组,CSCs和CTs组的梗死区的血管密度均显著性高于PBS对照组,差异有显著性统计学意义(p<0.05)。BMSCs组的梗死区的血管密度均值高于PBS对照组,差异没有统计学意义(p>0.05)。且CTs+CSCs混合细胞制剂组梗死区的血管密度均显著性高于CSCs,BMSC和CTs组,差异有显著性统计学意义(p<0.01);2)CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组的梗死边缘区的血管密度均显著性高于PBS对照组,差异有显著性统计学意义(p<0.05)。且CTs+CSCs混合细胞制剂组梗死边缘区的血管密度均显著性高于CSCs,BMSCs和CTs组,差异有显著性统计学意义(p<0.01)。上述结果提示:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性促进缺血心肌梗死区和边缘区的血管新生,且其疗效优于单独使用CSCs,BMSCs和CTs。
7、CTs+CSCs混合细胞制剂能促进缺血心肌梗死区CTs的再生,且其疗效优于单独使用CSCs,BMSCs和CTs。
缺血心肌的梗死区的CTs在心肌梗死时大部分死亡,影响缺血梗死心肌的结构完整和缺血心肌的再生。使用抗c-Kit/CD34(CTs标记物)抗体对各组心脏切片进行免疫组化染色,以比较梗死区CTs密度。对该指标研究发现(如图7所示):CTs+CSCs混合细胞制剂组,CSCs,BMSCs和CTs组梗死区的CTs密度均显著性高于PBS对照组,差异有显著性统计学意义(p<0.01)。且CTs+CSCs混合细胞制剂组梗死区CTs密度的均值均大于CSCs,BMSCs和CTs组,差异有显著性统计学意义(p<0.05)。上述结果证明:使用CTs+CSCs混合细胞制剂,CSCs,BMSCs和CTs均能显著性促进缺血心肌梗死区CTs的再生,且其疗效优于单独使用CSCs,BMSCs和CTs。
综合上述1~7的结果证明:使用CTs+CSCs混合细胞治疗制剂对缺血梗死心肌实施移植治疗,能显著减小缺血心肌的梗死面积,改善缺血心脏的心功能,及减少心肌梗死后心衰的风险,实现上述疗效的部分机理是:有效促进经移植的CSCs或心肌内源性CSCs,及其它来源干细胞在心梗边缘区和梗死区存活、分化与增殖,有效减小梗死区产生胶原纤维来源细胞――肌成纤维细胞的数目,减小梗死区和边缘区的纤维化,以减小缺血心脏的不良左心室重构,及促进梗死区和边缘区的血管新生,促进梗死区CTs的再生,从而促进梗死心肌的修复及减少心梗死后心衰的风险。CTs+CSCs混合细胞制剂对缺血梗死心肌的上述指标的综合疗效优于单独使用CSCs,BMSCs和CTs。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!