CPT‑Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用的利记博彩app
本发明属于医药研究开发利用领域,具体涉及一种CPT-Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用。
背景技术:
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是除酒精和其他明确的损肝因素外,所致的以弥漫性肝细胞大泡性脂肪变性为主、肝脏脂质蓄积过多的临床病理综合症,包括单纯性脂肪肝及演变的脂肪性肝炎和肝硬化,按肝脂肪超过肝重程度分为轻度、中度和重度脂肪肝。NAFLD已是欧、美、日等国慢性肝病的首要病因,也是我国除乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染外,肝细胞癌(HCC)发生的主要危险因素之一,其发病机制极为复杂,国内外有关研究学说众多,主要有胰岛素抵抗、脂质过氧化、细胞因子过表达、脂质代谢紊乱和铁超载等,除此,遗传、环境、免疫和药物等对NAFLD的发生均有影响,NAFLD主要表现为脂代谢紊乱。
在正常脂代谢过程中,体内脂肪酸活化生成酰基CoA,通过肉毒碱运载进入线粒体才能氧化供能。位于线粒体内膜肉毒碱棕榈酰转移酶-Ⅱ(Carnitine palmitoyltransferase-II,CPT-II)是脂肪酸进入线粒体氧化的关键酶。在线粒体外膜脂肪酸与CoA借助线粒体外膜肉毒碱棕榈酰转移酶-I(CPT-Ⅰ),将脂酰和肉毒碱转变为脂酰肉毒碱,经内膜CPT-II作用进入基质转换为脂酰CoA进行β-氧化供能,而肉毒碱则再穿过线粒体内膜,与内源性或外源性酰基CoA结合,防止后者堆积造成细胞中毒。
目前已有研究,体内长链脂肪酸须肉毒碱转运通过线粒体内膜进入基质氧化,足量肉毒碱对脂肪酸氧化供能极为重要。肝炎病毒感染后需要内源性代谢物与肉毒碱竞争结合,抑制CPT-II表达或减低酶活性,出现肉毒碱缺乏、酰基CoA和脂肪酸积聚,损伤线粒体,导致能量代谢障碍,在此过程中,如肉毒碱缺乏,血游离脂肪酸就会增多,导致内脏脂肪积滞,生成异常的内源性代谢产物二羧酸,加重线粒体损伤。
近年来,NAFLD与HCC之间的关联已引起临床的高度重视,有文献报道以先天性肉毒碱缺乏鼠(Juvenile Visceral Steatosis,JVS)制作动物模型,发现无论是杂合子(jvs/wt)或纯合子(jvs/jvs)鼠,均出现严重的肝脂肪积聚。肝细胞发生脂肪积聚是多因素、多阶段的动态变化过程,肝脂肪积聚与位于线粒体膜内侧的CPT-II活性密切相关,CPT-II控制脂肪进入线粒体氧化,该酶对热敏感,受过氧化物酶体增殖物活化受体(PPAR)家族调控,且存多种变异。酶的催化功能是否正常,直接影响到脂肪氧化供能。然而,CPT-II活性高低与脂肪积聚关系尚未有文献报道过,在脂肪积聚状态下肝细胞恶性转化过程中表达与改变尚不清楚。
技术实现要素:
本发明要解决的技术问题是提供一种CPT-II在脂肪积聚肝细胞诱发恶性转化过程中的应用,动态观察了肝组织CPT-II表达与改变,从新角度探讨脂代谢异常与肝细胞恶性转化的关系。
为解决上述技术问题,本发明的实施例提供一种CPT-Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用。
其中,CPT-Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用,包括如下步骤:
(1)动物分组:任挑10只雄性Sprague-Dawley大鼠为对照组,然后以6只雄性Sprague-Dawley大鼠为一组,随机分配成至少8组脂肪肝组和至少8组诱癌组;
(2)模型制备:脂肪肝组大鼠予以高脂饲料喂养,诱癌组大鼠予以高脂饲料加0.05%的2-乙基氨基芴颗粒饲料喂养,每两周取1只正常鼠、一组脂肪肝鼠和一组诱癌鼠,细分成对照组、脂肪肝组、变性组、癌前组和癌变组,各组大鼠以乙醚麻醉,经鼠腹心脏抽取全部血液,分离出血清置-18~-25℃保存;
摘取对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的鼠肝组织,都分成至少3份备用;
(3)血液酶学及脂质检测:定量测定步骤(2)中对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠血液分离出的鼠血清中总胆固醇(Tch)、甘油三酯(TG)、血清谷丙转氨酶(ALT)及谷草转氨酶(AST)的吸光度值(A),根据标准曲线计算其含量;
(4)肝组织脂肪染色:步骤(2)中对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的鼠肝组织各取一份于液氮速冻后-80℃保存,冰冻切片,然后以油红O试剂进行脂肪染色,在光镜下进行观察、摄片,通过图像分析系统,测定每个视野的红色区域的面积与该视野总面积的比值,以代表每个肝组织中脂肪的相对含量,进行图像分析半定量研究;
(5)肝组织蛋白制备与浓度测定:分别称取步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织,剪碎,加入磷酸盐缓冲液在冰浴中充分匀浆,匀浆后在冰浴中静置,转移至EP管中,利用4℃离心机分离上清,通过BCA试剂盒进行蛋白浓度测定,以蛋白标准品作标准曲线,在分光光度计上562 nm处测吸光度A,根据标准曲线测出肝组织总蛋白浓度;
(6)肝CPT-II浓度定量分析:根据酶联免疫吸附法检测肝CPT-II浓度,设空白孔校零,向微孔板中分别加入标准品和肝组织匀浆上清液,孵育;弃去液体加入生物素化的CPT-II抗体,二次孵育;洗板后加入HRP标记的亲和素,三次孵育;彻底洗涤后加入TMB底物避光显色,加入稀硫酸终止反应后在酶标仪上,于450nm波长下测定吸光度A,以标准品浓度制作标准曲线,再通过标准曲线得出每一样品的CPT-II蛋白浓度,再以肝组织匀浆上清液中CPT-II蛋白浓度与总蛋白浓度之比,计算肝组织CPT-II比浓度;
(7)病理组织学分析:步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织各取一份置于9~12%中性福尔马林中固定,然后取材、固定、脱水、透明、透蜡、包埋、常规切片后经苏木素-伊红染色,光镜观察、摄片,进行病理组织学分析;
(8)肝CPT-Ⅱ免疫组织化学染色:免疫组织化学采用非生物素检测,石蜡切片脱蜡、水化,自来水冲洗;抗原修复;步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织各取一份加过氧化物酶阻断剂室温孵育8~12min,磷酸盐缓冲液PBS冲洗;加入兔抗鼠CPT-Ⅱ单克隆抗体3~5℃过夜,磷酸盐缓冲液PBS冲洗;滴加反应增强液,室温孵育20~40min,磷酸盐缓冲液PBS冲洗;加酶标抗小鼠/兔IgG聚合物,室温孵育20~40min,磷酸盐缓冲液PBS冲洗;加新鲜配置的DAB显色试剂显色;自来水冲洗终止显色,苏木素复染,磷酸盐缓冲液PBS返蓝,无水乙醇脱水,二甲苯透明,中性树胶封片,光镜观察、摄片,通过图像分析系统测定每个视野的累积积分光密度值及有效统计区域的面积,计算光密度平均值,取其平均值代表肝组织中CPT-II表达的相对水平,进行图像分析半定量研究。
上述的CPT-Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用,还包括步骤(8)之后的步骤(9)统计学分析:所有结果均以均数±标准差(M ± SD)表示,组间比较采用 t 检验,以 P<0.05表示差异。
优选的,步骤(5)的具体操作如下:(5)肝组织蛋白制备与浓度测定:步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织,各称取湿重80~100mg,剪碎,加入8~1.0ml磷酸盐缓冲液在冰浴中充分匀浆,匀浆后在冰浴中静置20~40 min,转移至1.5ml EP管中,利用4℃离心机离心5000×g,5 min,分离上清,通过BCA试剂盒进行蛋白浓度测定,以蛋白标准品作标准曲线,在分光光度计上562nm处测吸光度A,根据标准曲线测出肝组织总蛋白浓度。
步骤(6)的具体操作如下:(6)肝CPT-II浓度定量分析:根据酶联免疫吸附法检测肝CPT-II浓度,设空白孔校零,向微孔板中分别加入标准品和肝组织匀浆上清液80~100μL,35~40℃孵育2~3h;弃去液体加入生物素化的CPT-II抗体,35~40℃孵育0.8~1.5h;洗板后加入HRP标记的亲和素,35~40℃孵育20~40 min;彻底洗涤后加入TMB底物35~40℃避光显色8~12min,加入稀硫酸终止反应后在酶标仪上,于450nm波长下测定吸光度A,以标准品浓度制作标准曲线,再通过标准曲线得出每一样品的CPT-II蛋白浓度,再以肝组织匀浆上清液中CPT-II蛋白浓度与总蛋白浓度之比,计算肝组织CPT-II比浓度。
其中,步骤(1)中选用清洁级、4~6周龄、体量100~120g的雄性Sprague-Dawley大鼠。
其中,步骤(2)中,所述高脂饲料由以下组分按重量百分比组成:猪油10~15%,蛋黄粉10~15%,胆固醇3~5%,胆酸1~3%和普通饲料62~76%。
优选的,所述步骤(4)和(8)中的图像分析系统选用Image Pro Plus 6.0软件。
本发明的上述技术方案的有益效果如下:本发明通过建立脂肪肝和肝癌动态发生模型,首次观察了肝组织脂肪积累状态下,以二乙基氨基芴(2-FAA)诱发肝细胞恶性转化,在此过程中动态观察了肝组织CPT-II的表达与改变,从新角度探讨脂代谢异常与肝细胞恶性转化的关系。
附图说明
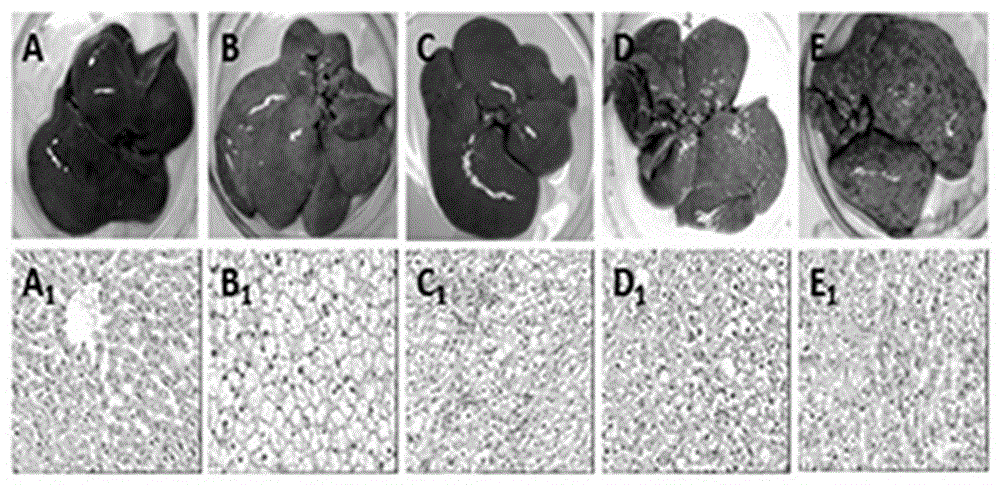
图1A~图1E分别为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织示意图;
图1A1~图1E1分别为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织H&E染色(×200)时的镜下观察图;
图2A~图2E为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织经油红O染色后放大200倍时的镜下观察图;
图2A1~图2E1为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织经油红O染色后放大400倍时的镜下观察图;
图3为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的鼠肝组织中脂肪含量对比图;
图4为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝CPT-Ⅱ比浓度的对比图;
图5为对照组、脂肪肝组、变性组、癌前组和癌变组各组平均吸光度值对比示意图;
图6A~图6E为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织放大200倍时的CPT-II的免疫组织化学分析图;
图6A1~图6E1为对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织放大400倍时的CPT-II的免疫组织化学分析图。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
一种CPT-Ⅱ在脂肪积聚肝细胞诱发恶性转化过程中的应用,包括如下步骤:
(1)动物分组:清洁级、4~6周龄,体量100~120g的雄性Sprague-Dawley(SD)大鼠,任挑10只为对照组,然后以6只雄性Sprague-Dawley大鼠为一组,随机分配成8组脂肪肝组和8组诱癌组;
(2)模型制备:脂肪肝组大鼠予以高脂饲料喂养,诱癌组大鼠予以高脂饲料加0.05%的2-乙基氨基芴(2-fluorenyl acetamide,2-FAA, Sigma,USA)颗粒饲料喂养,每两周取1只正常鼠、一组脂肪肝鼠和一组诱癌鼠,细分成对照组(正常肝细胞组)、脂肪肝组、变性组(肝细胞变性组)、癌前组(肝细胞癌前病变组)和癌变组(肝细胞癌变组),各组大鼠以乙醚麻醉,经鼠腹心脏抽取全部血液,分离出血清置-20℃保存;
摘取对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的鼠肝组织,都分成至少3份备用;
其中,高脂饲料由以下组分按重量百分比组成:猪油10%,蛋黄粉10%,胆固醇4%,胆酸1%和普通饲料75%。
(3)血液酶学及脂质检测:定量测定步骤(2)中对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠血液分离出的鼠血清中总胆固醇Tch、甘油三酯TG、血清谷丙转氨酶ALT及谷草转氨酶AST的吸光度值A,根据标准曲线计算其含量;
(4)肝组织脂肪染色:步骤(2)中对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的鼠肝组织各取一份于液氮速冻后切片,然后以油红O试剂按试剂盒(南京建成公司)使用说明操作进行脂肪染色,在OLYMPUS IX71光镜下进行观察、摄片,通过Image Pro Plus 6.0图像分析系统,测定每个视野的红色区域的面积与该视野总面积的比值,以代表每个肝组织中脂肪的相对含量,进行图像分析半定量研究;
(5)肝组织蛋白制备与浓度测定:步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织,各称取湿重100mg,剪碎,加入1.0ml磷酸盐缓冲液(PBS)在冰浴中充分匀浆,匀浆后在冰浴中静置30 min,转移至1.5ml EP管中,利用4℃离心机(Thermo Biofuge Primo R)离心5000×g,5 min,分离上清,通过BCA试剂盒(上海碧云天生物科技有限公司)进行蛋白浓度测定,以蛋白标准品作标准曲线,在分光光度计上562 nm处测吸光度A,根据标准曲线测出肝组织总蛋白浓度;
(6)肝CPT-II浓度定量分析:根据CPT-II试剂盒(美国CLOUD-CLONE公司)酶联免疫吸附法(ELISA)说明书上的步骤检测肝CPT-II浓度,设空白孔校零,向微孔板中分别加入标准品和肝组织匀浆上清液100μL,37℃孵育2 h;弃去液体加入生物素化的CPT-II抗体,37℃孵育1 h;洗板后加入HRP标记的亲和素,37℃孵育30 min;彻底洗涤后加入TMB底物37℃避光显色10 min,加入稀硫酸终止反应后在酶标仪(BioTek Synergy HT)上,于450nm波长下测定吸光度(A),以标准品浓度制作标准曲线,再通过标准曲线得出每一样品的CPT-II蛋白浓度,再以肝组织匀浆上清液中CPT-II蛋白浓度与总蛋白浓度之比,计算肝组织CPT-II比浓度;
(7)病理组织学分析:步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织各取一份置于10%中性福尔马林中固定,然后取材、固定、脱水、透明、透蜡、包埋、常规切片后经苏木素-伊红(H&E)染色,光镜(OLYMPUS BX51)观察、摄片,进行病理组织学分析;
(8)肝CPT-Ⅱ免疫组织化学染色:免疫组织化学采用非生物素检测,石蜡切片脱蜡、水化,自来水冲洗;抗原修复;步骤(2)对照组、脂肪肝组、变性组、癌前组和癌变组的鼠肝组织各取一份加过氧化物酶阻断剂室温孵育10min,磷酸盐缓冲液(PBS)冲洗;加入兔抗鼠CPT-Ⅱ单克隆抗体(美国Abcam公司,1:80)4℃过夜,磷酸盐缓冲液(PBS)冲洗;滴加反应增强液,室温孵育20 min,磷酸盐缓冲液(PBS)冲洗;加酶标抗小鼠/兔IgG聚合物,室温孵育30 min,磷酸盐缓冲液(PBS)冲洗;加新鲜配置的DAB显色试剂显色;自来水冲洗终止显色,苏木素复染,磷酸盐缓冲液(PBS)返蓝,无水乙醇脱水,二甲苯透明,中性树胶封片,光镜(OLYMPUS MX53)观察、摄片,通过Image Pro Plus 6.0图像分析系统测定每个视野的累积积分光密度值及有效统计区域的面积,计算光密度平均值,取其平均值代表肝组织中CPT-II表达的相对水平,进行图像分析半定量研究。
(9)统计学分析:所有结果均以均数±标准差(M ± SD)表示,组间比较采用 t 检验,以 P<0.05表示差异。
通过上述各步骤,分析CPT-II在脂肪积聚肝细胞诱发恶性转化过程中的作用,分析结果如下:
Ⅰ、鼠肝细胞恶性转化的病理组织学分析
鼠肝组织及对应的肝组织病理学H&E染色检查见图1,病理组织学检查将对照组、脂肪肝组、变性组、癌前组和癌变组各组大鼠的肝组织分为正常肝细胞组、脂肪肝组、肝细胞变性组,癌前病变组和癌变组(图1A~E)。正常对照组鼠肝组织呈红褐色,质软而脆;镜下肝细胞呈索状排列,核仁明显,核膜清楚,核内染色质稀疏,染色较浅,如图1 A1所示。脂肪肝组肝脏大体外观体积略增大,包膜紧张光滑,质地柔软,色黄,有油腻感;镜下可见胞浆中出现许多大小不等的空泡(脂肪滴),边界清晰,将细胞核挤向一侧;肝细胞体积增大、肿胀,细胞核明显,细胞与细胞之间界限不清如图1B1所示。变性组肝脏颜色偏黄镜下肝细胞核周围可见许多圆形空泡,可融合为一个大空泡,可见轻度肝纤维化如图1C1所示。癌前组肝脏表面出现少量小结节,镜下发现假小叶形成,肝细胞核多形性、核深染、明显的核仁、多核,不典型增生如图1D1所示。癌变组肝脏表面大量大小不一的结节弥漫性分布,镜下肿瘤细胞排列紊乱成巢状,细胞大小不一,核大深染,细胞核呈圆形或卵圆形如图1E1所示。
Ⅱ、鼠肝细胞恶化过程中肝脂肪含量的变化
肝组织切片经油红O染色,肝组织切片中脂肪着色的结果见图2,对照组肝组织中未见明显的油红O着色,见图2A和图2A1;其余各组鼠肝组织经油红O染色后,均见鼠肝细胞出现大量的脂肪积聚,见图2B~图2E和图2B1~图2E1。通过Image-Pro-Plus软件定量分析,显示正常鼠肝组织脂肪含量明显低于脂肪肝组(t=-11.556,P<0.001)、肝细胞变性组(t=-4.847,P=0.04)、肝细胞癌前病变组(t=-13.652,P=0.005)和肝细胞发生癌变组(t=-10.896,P=0.008),如图3所示。肝组织中脂肪的相对定量分析显示,正常鼠肝中脂肪无明显染色,而在脂肪肝组,肝细胞脂肪积聚程度最高,油红O染色着色最深;诱癌后肝细胞中脂肪含量估计仅占脂肪肝组的50%左右,差异十分明显(P<0.05)。
Ⅲ、肝细胞恶性转化过程中血酯变化
在肝细胞恶性转化过程中,SD鼠血脂水平与循环血肝酶活性变化如表1所示。血清TG,Tch水平明显高于正常对照组(P<0.05),血Tch浓度比正常对照鼠升高2 ~ 3倍,TG升高1.5 ~ 4.53倍。经2-FAA诱癌后肝细胞形态学表现为肝细胞发生变性、癌前病变和癌变的发展过程,伴有肝细胞损伤,AST及ALT活性显著高于正常对照组(P<0.05)的4~8倍。表1中数据显示,除正常对照鼠外,鼠肝脂肪积聚严重,伴有肝细胞损伤。
表1肝细胞恶性转化过程中血脂水平与肝酶活性变化
*P <0.05,与对照组相比。
Ⅳ、肝组织CPT-Ⅱ比浓度变化
观察肝组织CPT-II变化,定量分析了各组大鼠的肝组织CPT-II比浓度,见图4,即肝组织匀浆上清液中每mg总蛋白中CPT-II蛋白浓度(ng/mg P)。肝细胞恶性转化过程中CPT-II的动态变化如图4所示。CPT-II在对照组为124.08±26.73ng/mg P、脂肪肝组为92.84±11.18ng/mg P、变性组为39.29±6.33ng/mg P、癌前组为50.49±18.92ng/mg P和癌变组为38.73±14.95ng/mg P。统计学分析发现正常对照组肝CPT-II比浓度明显高于脂肪肝组(t=2.641, P=0.035)、肝细胞变性组(t=7.559,P<0.001)、癌前病变组(t=5.504,P<0.001)和肝细胞癌变组(t=6.825,P<0.001);脂肪肝组CPT-II比浓度明显高于变性组(t=10.210,P<0.001)、癌前组(t=4.721,P=0.001)和癌变组(t=7.100,P<0.001),显示在肝细胞恶性转化进展过程中肝组织CPT-II含量逐渐减少。
Ⅴ、肝CPT-II动态表达的免疫组织化学分析
通过Image Pro Plus软件对肝组织CPT-II免疫组化进行半定量分析,结果如图6A~图6E以及图6A1~图6E1所示。图5显示正常对照组平均吸光度值为(59.92±14.26)×10-3,明显高于脂肪肝组(40.06 ± 11.58)×10-3;t=2.648,P=0.025)、变性组(6.74±1.66)×10-3; t=9.071,P<0.001)、癌前组(9.94±3.02)×10-3;t=8.397,P<0.001)和诱癌组(7.44±2.85)×10-3;t=8.836, P<0.001),且脂肪肝组平均吸光度值明显高于变性组(t=6.976,P<0.001)、癌前组(t=6.166,P<0.001)和癌变组(t=6.698,P<0.001),显示肝组织CPT-II含量随肝细胞恶性转化而呈下调表达。
应当指出,本发明各实验参数的数值范围并不是对本技术方案的限定,本发明的实施例1也只是一个最优实施例,其实验过程中的各具体实验参数值并不是对本发明实验条件的限定,本领域技术人员可以在实验过程中根据实验对象、地理环境、实验人员自身条件等因素适当的变换实验条件,因此,本领域技术人员在本技术方案的启发下,只是更改实验条件而未付出创造性劳动的改进,仍属于本发明的保护范围。
本发明成功制备了脂肪积聚状态下的体内模型,首次动态观察了经化学诱癌肝细胞发生恶性转化过程中CPT-II的表达与变化规律。摄入脂肪后SD鼠肝细胞见大量脂肪积聚,正常对照鼠脂肪含量明显低于脂肪肝鼠、变性组、癌前病变组和癌变组。血清TG,Tch水平明显高于正常对照组,TG和Tch升高。经2-FAA诱癌后肝细胞形态学表现为肝细胞发生变性、癌前病变和癌变的发展过程,伴有肝细胞损伤,AST及ALT活性显著高于正常对照组的4~8倍。提示在肝脂肪积聚过程中伴有肝细胞损伤,也影响到线粒体中脂肪的氧化。
本发明通过建立脂肪肝和肝脏的大鼠模型,检测在肝细胞恶性转化过程中CPT-II变化,发现脂肪肝模型中CPT-II含量明显低于正常对照组,表明肝脏脂质积累,脂肪变性会导致肝细胞CPT-II减少,同时肝癌鼠CPT-II含量显著低于脂肪肝,与肝细胞恶性程度呈负相关。肝CPT-Ⅱ比浓度与免疫组织化学证实,肝细胞癌变过程中呈进行性降低,表明CPT-Ⅱ低表达或功能丧失加重肝细胞脂肪积聚,对肝细胞恶性转化过程起促进作用。
综上所述,CPT-II通过阻断体内脂肪酸的β氧化,造成肝脏脂质的积累,而肝脂质积累又进一步损伤肝细胞导致CPT-II含量减少,造成恶性循环,提示肝细胞脂肪积聚促进了肝细胞的恶性转化。
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!